嗜氮酮类化合物Penicilone B的体外抗氧化活性研究
2021-03-10张良聪黄午阳
张良聪, 孙 丽, 陈 敏, 黄午阳, 4, 申 丽
(1.扬州大学 医学院/转化医学研究院, 江苏 扬州, 225001;2.江苏省中西医结合老年病防治重点实验室, 江苏 扬州, 225001;3.扬州大学 环境科学与工程学院, 江苏 扬州, 225127;4.江苏省农业科学院农产品加工研究所, 江苏 南京, 210014)
氧化应激是指在内外环境有害刺激的条件下,体内产生活性氧自由基和活性氮自由基所引起的细胞和组织的生理、病理反应。氧化应激与衰老[1]、心血管疾病[2]、肿瘤[1]、糖尿病[3]和神经退行性疾病[4]等多种疾病的发生、发展密切相关。采用抗氧剂清除体内过量的自由基,可以减少机体的氧化胁迫损伤,对延缓衰老和防治氧化应激相关疾病具有重要的意义。微生物是抗氧化活性成分的重要来源。近年来,已从特殊生境微生物次生代谢产物中分离得到许多结构新颖、具有良好抗氧化活性的化合物。从海绵共生菌Hansfordiasinuosae发酵液中分离得到新间苯二酚衍生物Hansfordiol H和Hansfordiol I, 其自由基清除活性明显优于Trolox(一种水溶性维生素E类似物)[5]; 从药用植物内生菌CytosporarhizophoraeA761中分离得到的新聚酮化合物Rhizophol A具有显著的1, 1-二苯基-2-三硝基苯肼(DPPH)自由基清除活性,半数有效浓度(EC50)为(13.07±0.94)μmol/L[6]。
Penicilone B是从红树林根际土壤青霉菌PenicilliumjanthinellumHK1-6中分离得到的新嗜氮酮类化合物[7]。嗜氮酮类化合物是一类结构新颖的真菌次生代谢产物,主要有10种结构类型[8], Penicilone B在结构上属于带有脂肪侧链和芳香环的双环嗜氮酮类化合物。嗜氮酮类化合物具有广泛的生物活性,如抗氧化、抗病毒、抗感染、抗癌和酶抑制活性等[8-9]。前期实验[7]发现, Penicilone B对耐甲氧西林金黄色葡萄球菌(S.aureusATCC 43300和ATCC 33591)具有显著的抑制作用,最低抑菌浓度(MIC)均为3.13 μg/mL。为进一步分析Penicilone B的药理活性,本研究采用2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)法、DPPH法和氧自由基吸收能力法(ORAC)测定Penicilone B的体外抗氧化活性,并首次采用量子化学密度泛函理论(DFT),从分子结构参数、酚羟基解离焓(BDE)、电离势(IP)和前线分子轨道(FMO)等方面分析其抗氧化机理,以期为进一步开发嗜氮酮类化合物奠定基础。
1 材料与方法
1.1 仪器与材料
TriStar LB941多功能酶标仪(德国Berthold公司), UV1240紫外分光光度计(日本岛津公司), L-420低速离心机(长沙湘仪离心机仪器有限公司), BS 224S分析天平(德国赛多利斯仪器系统有限公司), KQ-250DE数显恒温水浴锅(江苏省金坛市维诚实验器材有限公司)。
化合物Penicilone B是陈敏博士从红树林根际土壤青霉菌PenicilliumjanthinellumHK1-6中分离得到的新嗜氮酮类化合物[7],化学结构见图1。Trolox对照品和DPPH购自东京化成工业株式会社; 荧光素钠购自上海瑞永生物科技有限公司; 维生素C(Vc)对照品和2, 2′-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)购自美国Sigma公司; ABTS购自上海麦克林生化科技有限公司; 其他试剂均为分析纯。

图1 化合物Penicilone B的化学结构
1.2 化合物ABTS自由基清除能力测定[10]
配制7 mmol/L ABTS溶液和140 mmol/L过硫酸钾溶液,按照5 000∶88的比例混合成ABTS自由基储备液,避光静置16 h; 使用前在30 ℃、734 nm条件下用80%无水乙醇将其稀释成(0.700±0.200)吸光度的ABTS工作液。在96孔板中加入10 μL不同浓度的待测化合物溶液和190 μL ABTS工作液,轻轻震荡96孔板,室温下避光静置6 min, 在734 nm波长下测定各孔吸光度。Vc为阳性对照,溶剂为空白对照, ABTS工作液为阴性对照。实验结果用ABTS自由基清除率来表示:
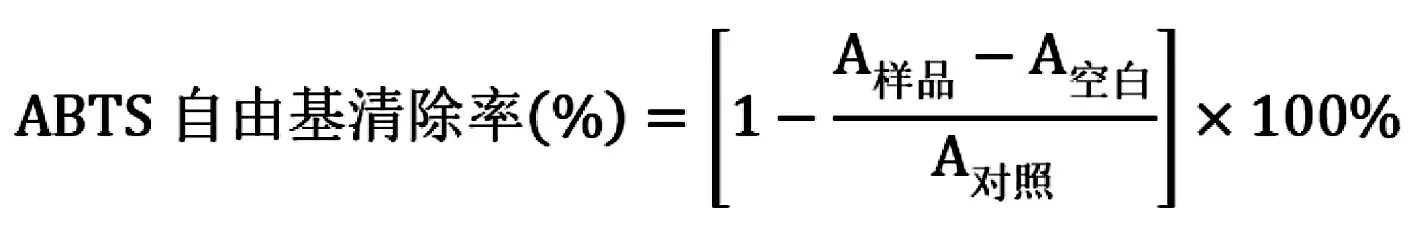
1.3 化合物DPPH自由基清除能力测定[11]
在96孔板中加入5 μL不同浓度的待测化合物溶液,再加入195 μL DPPH溶液(0.2 mmol/L), 37 ℃避光静置30 min, 在517 nm下测定各孔吸光度。Vc为阳性对照,溶剂为空白对照, DPPH溶液为阴性对照。实验结果用DPPH自由基清除率表示:
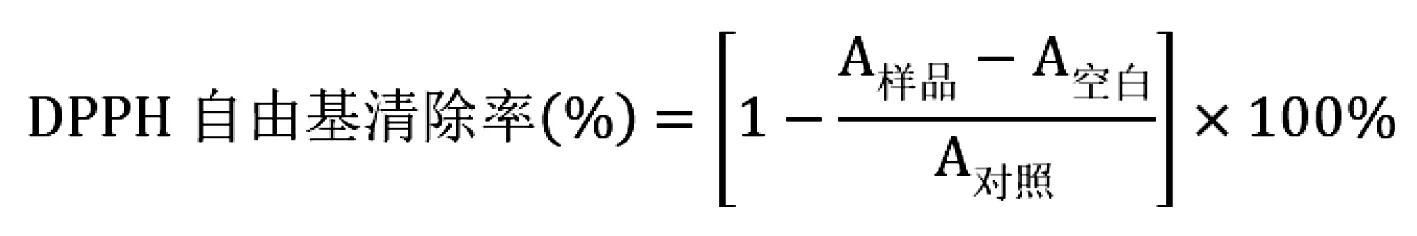
1.4 化合物氧自由基吸收能力测定[11]
氧自由基吸收能力测定,即总抗氧化能力(TEAC)测定,是公认的评价抗氧化能力最全面的方法。在黑底96孔板中分别加入100 μL不同浓度的待测化合物溶液以及Trolox对照品,再加入50 μL荧光素钠(0.2 μmol/L), 室温下避光静置15 min, 使样品和荧光素钠充分混合。再向各孔中快速加入50 μL AAPH(80 mmol/L), 然后立即用酶标仪测定各孔荧光强度(激发波长为485 nm, 发射波长为535 nm), 测定温度为37 ℃, 每隔1 min检测1次, 共持续100 min。采用积分法在GraphPad Prism软件上计算荧光衰退曲线下面积(AUC)。样品衰退荧光下的净面积(net AUC)等于样品的AUC减去空白对照的AUC。氧自由基清除能力ORAC值(即总抗氧化能力指数)为浓度梯度的样品AUC-net AUC曲线与浓度梯度Trolox标准品AUC-net AUC曲线的斜率比, ORAC值以Trolox当量表达,即μmol Trolox/mg。Vc为阳性对照。
1.5 DFT计算
通过Gauss View 6.0建立优化分子模型,使用Gaussian 16在M06-2x/6-31+G**水平上对分子进行几何结构全优化,并在同等水平下对每一个稳定的结构进行频率计算,确保每一个得到的结构都不含有虚频。使用Gaussian 16量子化学程序包进行几何结构参数分析和能量计算,包括键长、BDE、IP、最高占据分子轨道(HOMO)和最低电子未占轨道(LUMO)能级等[12]。为了得到更加精确的单点能,采用M06-2x/Def2-TZVP方法对每一个稳定结构的单点能进行计算,有效避免因基组重叠误差带来的结果误差。
1.6 统计学分析

2 结 果
2.1 化合物Penicilone B的体外抗氧化活性
ABTS自由基清除能力和DPPH自由基清除能力是2种常用的体外抗氧化活性测定方法。化合物Penicilone B对ABTS自由基和DPPH自由基具有一定的清除作用,其水平为100 μg/mL时,对ABTS自由基和DPPH自由基的清除率分别为(11.62±1.19)%、(22.68±2.81)%, 而阳性对照Vc对ABTS自由基和DPPH自由基的清除率分别为(43.17±3.88)%、(58.73±4.70)%。
ORAC法可针对亲水过氧基、亲脂过氧基、氢氧基、过氧亚硝基和单线态氧等多种自由基进行综合检测。ORAC值越大,待测物抑制自由基生成的抗氧化能力就越强[13]。本研究ORAC法测定显示, Penicilone B具有较好的总抗氧化能力,其ORAC值为(1.06±0.06)μmol trolox/mg, 阳性对照Vc的ORAC值为(2.87±0.15)μmol trolox/mg, 差异有统计学意义(P<0.05)。
2.2 化合物Penicilone B的DFT计算
2.2.1 化合物Penicilone B的几何构型及结构参数: 采用DFT方法在M06-2x/6-31+G**水平对化合物Penicilone B进行分子结构优化,见图2。
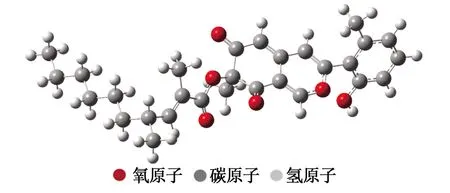
图2 化合物Penicilone B的优化构型
Penicilone B的C15位羟基的O原子为sp2杂化且具有1对孤对电子,易与苯环形成大π键。随着大π键的形成,在电子离域的作用下,氧原子电荷密度降低,其对氢原子的束缚能力降低,氢原子更容易解离。同时计算发现, Penicilone B的酚羟基键长为0.963 6 Å, 而一般酚羟基键长为0.960 0 Å, 说明Penicilone B的酚羟基比一般酚羟基要活泼,羟基氢更易于解离[14]。上述结构特征提示Penicilone B具有一定的抗氧化活性,C15位羟基氢易于解离是其具有抗氧化能力的基础。
2.2.2 BDE和IP分析: BDE 表征化合物清除自由基能力的大小[15]。为进一步揭示Penicilone B的抗氧化机理,本研究在M06-2x/6-31+G**水平上对Penicilone B酚羟基脱氢后的苯氧自由基进行结构优化计算,并在M06-2x/Def2-TZVP水平计算,结果发现,其BDE为356.42 kJ/mol。BDE与化学键的强弱直接相关, BDE越小,化合物与自由基反应时其化学键就越容易断裂,抽氢反应越容易进行,生成的半醌式自由基的稳定性越高,抗氧化活性越高[15]。BDE计算结果提示, Penicilone B的C15位酚羟基容易发生抽氢反应,是其活性位点。
IP是与单电子转移抗氧化途径相关的重要参数。IP值越低,电子越容易转移,抗氧化能力越强[16]。计算表明, Penicilone B的IP为1 669.14 kJ/mol。
2.2.3 化合物Penicilone B的FMO分析: 前线轨道理论表明,在化学反应过程中, FMO发挥着重要的作用。FMO包括HOMO和LUMO。HOMO高低和失电子能力有关, HOMO轨道能量越高,化合物越容易失去电子; LUMO高低和电子亲和能力有关, LUMO轨道能量越低,则化合物越容易得到电子[17]。△E(LUMO-HOMO)是HOMO和LUMO的能级差,反映了电子从HOMO到LUMO所需的能量,能级差越小,电子越容易转移,则化合物活抗氧化性越强。此外,去质子化过程与HOMO/LUMO附近的分子轨道(HOMO-1、HOMO-2等和LUMO+1、LUMO+2等)的跃迁过程紧密相关[18]。
本研究在M06-2x/6-31+G**水平计算Penicilone B的EHOMO、ELUMO和△E(LUMO-HOMO), 发现HOMO-1轨道(次高占据分子轨道)、HOMO轨道、LUMO轨道和LUMO+1轨道(次低未占据分子轨道)的能量依次增大,分别为-766.72、-692.97、-94.96和-57.71 kJ/mol; 能级差△E(LUMO-HOMO)为598.01 kJ/mol。在HOMO轨道图中,对最高占据轨道贡献最大的是Penicilone B的A环和B环上碳氧原子的p轨道;在HOMO-1轨道图中,化合物侧链中与酯羰基共轭的双键作用最大。在LUMO轨道中, A环和B环上的电子云密度大于C环上的电子云密度,说明A环和B环接受电子的能力大于C环。见图3。据此推测, Penicilone B可能通过与活泼自由基结合形成一个新的较为稳定的自由基,从而终止氧化的链锁反应,发挥抗氧化作用, A环和B环是主要的反应活性位点。

图3 化合物Penicilone B的前线分子轨道图
3 讨 论
特境微生物是指栖息于“特殊生态环境”的微生物,近年来特境微生物次生代谢产物成为天然药物研究的重要领域。红树林是生长在热带和亚热带海岸潮间带环境中的耐盐植物类群,是世界上最富多样性的海洋生态环境之一。红树林具有丰富、特色的微生物资源,栖息于红树林特殊生态环境的红树林真菌具有独特的代谢途径和遗传背景,能够产生结构新颖、活性显著的次生代谢产物[19], 为新药研制提供了丰富的先导化合物。
前期实验[7]发现,红树林根际土壤青霉菌PenicilliumjanthinellumHK1-6产生的新嗜氮酮类化合物Penicilone B对耐甲氧西林金黄色葡萄球菌(S.aureusATCC 43300和ATCC 33591)具有显著的抑制作用。本研究采用ABTS法、DPPH法和ORAC法这3种方法评价其抗氧化活性,结果发现, Penicilone B对自由基具有一定的清除能力,表现出一定的体外抗氧化活性。DFT计算显示, Penicilone B的酚羟基键长较长,比一般的酚羟基更易离子化,其A环和B环易接受电子,是主要的反应活性位点,提示该化合物具有一定的抗氧化活性。DFT计算结果与体外抗氧化实验结果相一致。
DFT是一种广泛应用的量子化学计算方法,可用于研究分子结构、能谱、光谱、反应机理、过渡态结构和活化势垒,其在天然药物的抗氧化机制分析、立体构型确定等方面也发挥着重要作用。在进行抗氧化机制分析时, DFT计算通过计算机模拟化合物在不同反应条件及不同状态下的抗氧化活性,尤其是能对难以获得的新化合物进行分子模拟,找到其关键基团,预测其抗氧化活性。本研究首次采用DFT分析嗜氮酮类化合物的抗氧化机制,为嗜氮酮类化合物的抗氧化构效关系研究,进一步开发嗜氮酮类化合物提供了理论依据。
