系统性红斑狼疮合并肺动脉高压的相关危险因素
2021-03-10夏恩良高聪聪梁文芳张纯祎孙文博郑朝晖
夏恩良,高聪聪,梁文芳,张纯祎,孙文博,郑朝晖
(1.郑州大学第一附属医院 风湿免疫科,河南 郑州 450052;2.商城县人民医院 儿科,河南 信阳 465350)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种多器官受累的自身免疫性疾病,肺动脉高压(pulmonary arterial hypertension,PAH)是SLE严重并发症之一。根据中国系统性红斑狼疮研究协作组(Chinese SLE Treatment and Research Group,CSTAR)104个风湿病中心的多中心数据库报道,SLE患者合并PAH的发生率为3.8%[1],1 a、3 a和5 a的生存率分别为92.1%、84.8%和72.9%[2]。PAH成为继狼疮性肾炎、神经精神性狼疮后导致患者死亡的第三位病因。SLE合并PAH患者的主要症状有进行性呼吸困难、心悸、疲劳及运动耐量降低等,因临床表现不特异易被忽视而延误诊断和治疗[2-3]。早期诊断及达标治疗对SLE合并PAH的预后有重要意义。预防靶器官损害是治疗SLE的长期目标之一,也是治疗的关键。前期调查了郑州大学第一附属医院收治的SLE合并狼疮性肾炎患者的生存及预后[4],而河南地区尚缺乏SLE合并PAH相关危险因素及预后分析的数据。研究表明,雷诺现象、浆膜炎、间质性肺病、抗RNP抗体阳性、血尿酸水平等为SLE合并PAH患者的危险因素[5-8]。本研究探讨SLE合并PAH的相关危险因素,旨在为早期识别高危人群提供客观依据。
1 资料与方法
1.1 研究对象选取2019年1月至2020年6月于郑州大学第一附属医院就诊的病历资料完整的477例SLE患者,其中429例未合并PAH(无PAH组),48例合并PAH(PAH组)。SLE均符合1997年美国风湿病学会修订的SLE分类标准[9]。PAH定义参照2015年欧洲心脏病学会及呼吸学会《PAH诊断和治疗指南》推荐的超声心动图PAH诊断标准[10],即静息状态下经胸超声心动图估测的肺动脉收缩压>36 mmHg(1 mmHg=0.133 kPa)。排除标准:年龄<18岁、其他结缔组织病合并PAH、先天性心脏病、肺栓塞、冠心病或心肌梗死病史、严重心脏瓣膜病、风湿性心脏病、严重出凝血功能障碍、严重肝肾功能不全、妊娠状态等。
1.2 收集资料收集符合标准的SLE患者的一般资料(性别、年龄、病程等)、主要临床特点(颊部红斑、雷诺现象、狼疮性肾炎、血管炎、间质性肺病、口腔溃疡等)、辅助检查(白细胞、血小板、肌酐、尿酸、C反应蛋白、补体、自身抗体谱等)及SLE疾病活动度指数(SLE disease activity index,SLEDAI)等资料。
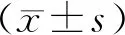
2 结果
2.1 临床特征与无PAH组比较,PAH组女性占比、雷诺现象占比、浆膜炎占比、间质性肺病占比、血尿酸和C反应蛋白水平较高,年龄较大,病程较长(P<0.05);两组SLEDAI、颊部红斑、狼疮性肾炎、血管炎、关节炎、脱发、口腔溃疡、神经精神损害、白细胞计数、血红蛋白、血小板计数、肌酐、红细胞沉降率情况比较,差异无统计学意义(P>0.05)。见表1。
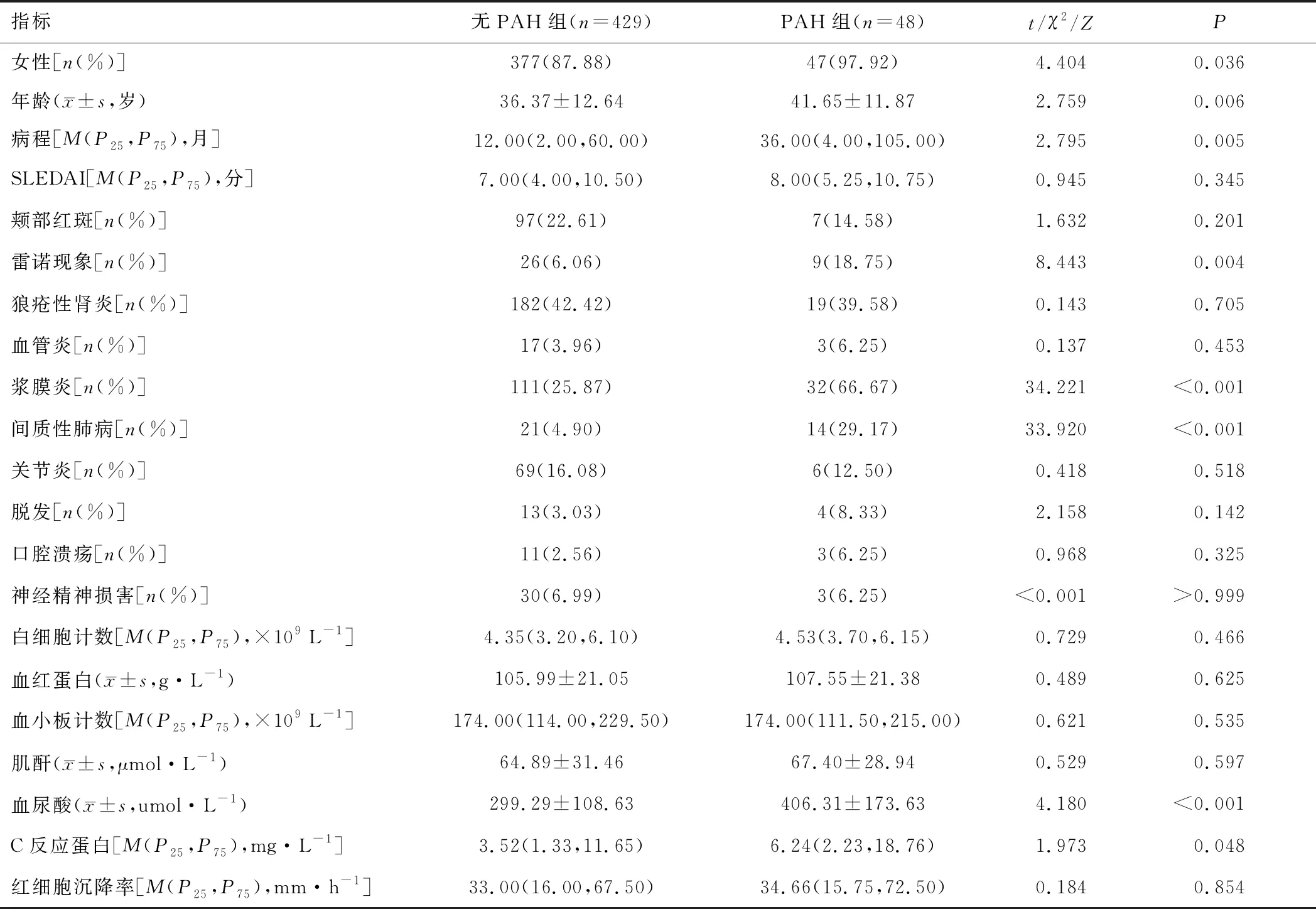
表1 无PAH组与PAH组患者临床特征比较
2.2 免疫学特征PAH组抗dsDNA抗体阳性率低于无PAH组,抗RNP抗体阳性率高于无PAH组(P<0.05);PAH组补体C3、补体C4水平分别与无PAH组比较,差异无统计学意义(P>0.05);PAH组抗Sm抗体、抗SSA抗体、抗SSB抗体、抗着丝点抗体、抗Scl-70抗体、抗Ro52抗体的阳性率分别与无PAH组比较,差异无统计学意义(P>0.05)。见表2。
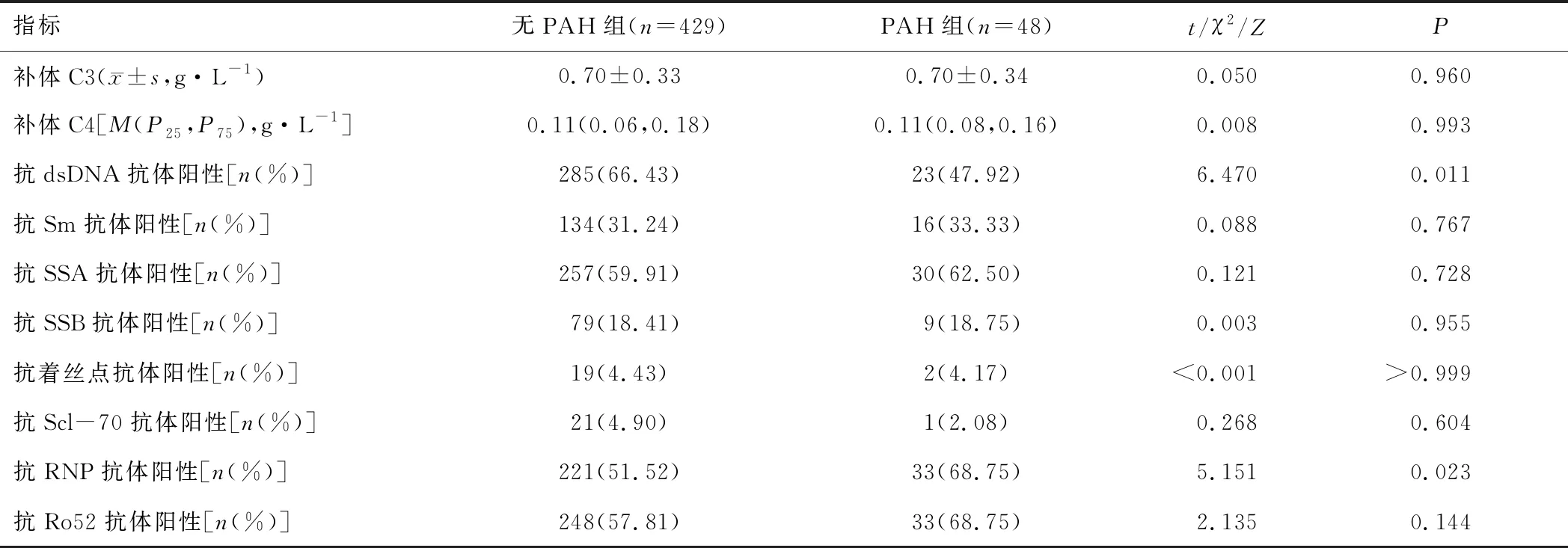
表2 无PAH组与PAH组患者免疫学特征比较
2.3 SLE患者合并PAH的危险因素将单因素分析P<0.05的指标,如女性、年龄、病程、雷诺现象、浆膜炎、间质性肺病、血尿酸、C反应蛋白、抗dsDNA抗体、抗RNP抗体,纳入多因素logistic回归分析,结果显示,女性、高龄、长病程、合并浆膜炎、合并间质性肺病、血尿酸水平高为SLE患者合并PAH的独立危险因素(P<0.05)。见表3。

表3 SLE患者合并PAH的多因素logistic回归分析
3 讨论
SLE合并PAH是SLE患者主要的死亡原因之一,其发生可能与血管内皮功能障碍、肺血管重构、间质性肺病、免疫复合物介导肺血管炎及微血栓形成等有关[11]。目前主要依据经胸超声心动图筛查PAH,但早期诊断不特异且易受人为因素的影响。因此,探讨诊断PAH的早期临床指标尤为重要。本研究结果显示,女性、间质性肺病、浆膜炎、高龄、长病程、高血尿酸水平为SLE合并PAH的独立危险因素,与既往研究结果[5-8]相似。除了常见的危险因素浆膜炎外,女性、间质性肺病均为风险较高的因素。
我国CSTAR-PAH数据库显示,SLE合并PAH中女性占99.4%[2]。在本研究中,PAH组女性占97.92%,与Chen等[12]研究结果一致。推测SLE合并PAH的性别差异可能与雌激素有关。雌激素可能通过增加抗体导致免疫复合物沉积、组织损伤和炎症[13],进而促使SLE合并PAH进展。雌激素可以激活凝血系统,降低凝血酶抑制物及纤维酶原激活物抑制剂的水平及活性,从而增加血栓形成风险,而肺血管血栓可导致PAH[14]。然而,Lahm等[15]发现雌激素可通过其受体介导激活多个细胞内信号转导途径发挥调节肺血管系统、保护肺血管的作用,推测SLE合并PAH患者体内可能存在雌激素受体不足或者细胞内信号转导过程异常,减弱或抵消雌激素对肺血管的保护效应。
有研究显示,SLE合并PAH与间质性肺病、浆膜炎等有关[7],这与本研究结果一致。SLE患者可并发间质性肺病,间质性肺病以不同程度的炎症及纤维化为特征,可导致毛细血管床减少以及走形紊乱、重构,达到一定程度时可引起低氧血症及肺循环阻力增加,进而促进PAH的产生。
SLE疾病活动性与SLE合并PAH的联系存在争议。周巧云等[16]研究认为SLE疾病活动性与PAH的发生呈正相关,但是基于CSTAR-PAH数据库的研究表明两者呈负相关[5]。本研究显示两者无关,与Kim等[7]通过多因素回归分析得到的结论一致。基于临床特点将SLE合并PAH分为血管炎亚型和血管病亚型[17]。血管炎亚型以自身免疫介导的炎症过程为病理特点,通常表现为全身较高的疾病活动度。血管病亚型以非炎症性血管重塑为病理特点,表现为单纯PAH及较低的疾病活动度。纳入研究时患者的亚型及病情活动状态不同可能是引起这种差异的原因。鉴于两者的复杂关系及PAH的隐匿性、预后不良等特点,推荐无论SLE是否处于疾病活动状态都应进行持续规律的肺动脉压监测。
多因素logistic回归分析显示,长病程及高龄为SLE合并PAH的危险因素。这可能与高龄患者动脉血管顺应性下降及原发病的进展有关。本研究结果显示,高血尿酸水平也为SLE合并PAH的危险因素,与既往研究结果[8]一致。尿酸是人体内嘌呤代谢的产物,与组织缺氧、炎症等有关。高尿酸患者体内析出的尿酸盐结晶可附着血管壁,损伤血管内皮功能,进一步加重缺氧,进而促使SLE患者肺血管疾病的进展。
总之,女性、高龄、长病程、合并浆膜炎、合并间质性肺病、血尿酸水平升高为SLE患者合并PAH的独立危险因素。对存在上述危险因素的SLE患者,应警惕合并PAH的可能,建议尽早行经胸超声心动图或右心导管评估,一旦诊断为PAH应及早干预。
