枸杞多糖对LPS诱导的人视网膜色素上皮细胞炎性反应的影响及机制
2021-03-10马雅玲马立萍
闫 梅,马 倩,马雅玲,,刘 媛,马立萍
0引言
年龄相关性黄斑变性(age-related macular degeneration,ARMD)是一种影响视网膜黄斑区,导致中央视力逐渐丧失的疾病,多发生于60岁以上的人群中,是造成视觉损害的主要原因之一[1-2]。我国现已步入老龄化社会,人口老龄化呈指数增长,其患病率将进一步上升。研究发现,ARMD的发病机制涉及氧化应激、光损伤、炎症、遗传基因等方面[3-5]。其中,视网膜色素上皮(retina pigment epithelium,RPE)的炎性损伤是重要环节[1,3]。RPE具有维持视网膜感光细胞层的功能,可保护视网膜免受过度光照,并参与形成血-视网膜屏障及视网膜中央黄斑的免疫防御等[4-5]。研究表明,各种刺激形成的RPE炎性损伤能够促进新生血管生成,加速病情进展为渗出性ARMD[3-6]。所以,抑制RPE细胞内炎性损伤,同时预防RPE的丢失,是开发治疗ARMD新方案的关键。研究证实,枸杞多糖(lycium barbarum polysaccharide,LBP)具有抗炎、抗氧化应激、抗衰老等作用[7-9]。本课题组既往研究也表明枸杞多糖对糖尿病大鼠视网膜具有保护作用,对氧化应激造成视网膜神经节细胞的凋亡具有抑制作用[10-11],但是,枸杞多糖对RPE炎性反应的影响尚不明确。所以,本实验通过细菌脂多糖(Lipopolysaccharide,LPS)刺激人视网膜色素上皮(ARPE-19)细胞构建ARMD的体外炎症反应模型,探索枸杞多糖对RPE炎性反应的影响及机制,为治疗渗出性ARMD及RPE炎症相关疾病提供新思路。
1材料和方法
1.1材料
1.1.1主要试剂ARPE-19细胞株(中科院上海细胞库)、枸杞多糖(宁夏沃福百瑞)、LPS(美国Sigma)、胎牛血清(美国Gibco)、DMEM-F12培养基(美国Hyclone)、0.25%胰蛋白酶+EDTA(索莱宝)、青-链霉素混合液(100×)(索莱宝)、RT-PCR逆转录试剂盒(Invitrogen)、SYBR Green qPCR Master Mix(DBI Bioscience)、总RNA提取试剂盒(北京天根)、引物(上海生工)、CCK-8细胞增殖及细胞毒性检测试剂盒(上海贝博)、全蛋白提取试剂盒(凯基生物)、BCA蛋白定量试剂盒(凯基生物)、ECL高敏检测试剂盒(凯基生物)。一抗:p-IκBα、IκBα、p-ERK、p-p38及p-JNK(Affinity,CAT:5002、2002、1015、4001、3318),p-p65、p65(CST,CAT:3033、8242),ERK、p38及JNK(万类生物,CAT:01864、00764、01295),β-Actin(中杉金桥,CAT:TA-09)。
1.1.2仪器Infinite M200 Pro酶标仪(瑞士TECAN)、PowerPac 200电泳仪(美国Bio-Rad)、IQ5 Real-Time PCR仪(美国Bio-Rad)、ChemiDoc Touch化学发光成像系统(美国Bio-Rad)。
然而,企业减排导致生产成本增加,成本增加导致国际竞争力下降,国际竞争力下降导致国内经济现代化受阻。不减排,国际舆论压力大,绿色贸易壁垒愈演愈烈,在国际分工中将长期处于产业价值链的低端水平,国内经济也无法实现高质量发展。
1.2方法
1.2.1 ARPE-19细胞培养收到ARPE-19细胞后放置入培养箱,于37℃、5% CO2条件下培养,待细胞密度约为85%时使用胰酶进行消化,1200r/min离心5min,1∶3传代,接种于T25培养瓶中,加入完全培养基培养(10% FBS,1%青-链霉素混合液,89% DMEM-F12),2d换液一次,稳定传代后取2~4代用于实验。同时,细胞密度为85%时进行消化离心,加入冻存液(10% DMSO,90% FBS)重悬,放入-80℃冰箱冻存,次日投入液氮长期保存。
1.2.2实验分组及处理将细胞随机分为空白组、LPS组、低浓度LBP组、中浓度LBP组、高浓度LBP组。所有分组加药前均使用不含血清的培养基饥饿24h。空白组使用完全培养基培养,与其余组同时换液;LPS组给予含10μg/mL LPS的完全培养基刺激24h;LBP组分别给予含有低浓度LBP(0.1mg/mL)、中浓度LBP(0.5mg/mL)及高浓度LBP(1mg/mL)的完全培养基孵育24h,再以同样方式给予10μg/mL LPS作用24h。
1.2.3 CCK-8观察各组细胞存活率细胞以浓度为1×104个/mL接种于96孔板中,每孔加入200μL培养基,培养24h,待细胞贴壁后PBS冲洗两遍并给予无血清DMEM培养基饥饿24h。各组处理同上,处理后PBS冲洗换液加入含10% CCK-8的无血清培养基,37℃培养箱中避光孵育2h,酶标仪450nm检测OD值,使用公式:细胞存活率=[(实验孔-空白孔)/(对照孔-空白孔)]×100%,计算出细胞存活率。
1.2.4 Real Time-PCR检测各组细胞内炎性因子的mRNA表达量上述各组细胞接受处理后按照天根总RNA提取试剂盒步骤过柱提取,提取后测定RNA浓度并用琼脂糖凝胶电泳验证纯度后,每组取等量RNA参照Invitrogen逆转录试剂盒步骤,进行逆转录合成为cDNA,-80℃保存。使用DBI SYBR Green qPCR Master Mix试剂盒,严格按照步骤,以cDNA为模板进行实时荧光定量PCR扩增。引物序列见表1。反应体系为:20μL。采用试剂盒中标准三步法进行Real Time-PCR扩增,反应条件为:预变性,95℃ 2min;PCR反应,95℃ 10s,50℃~60℃ 30~34s,72℃ 30s,共40循环。熔解曲线,55℃~98℃ 84循环。得出Ct值,以GAPDH为内参,使用相对定量法,计算2-△△Ct值。
1.2.5 Western-blot检测各组蛋白表达量各组细胞接受处理后,根据全蛋白提取试剂盒步骤,冷PBS洗涤细胞2次,加入提前配置的裂解液并刮出细胞,收集悬液放置冰上,间隔4min震荡一次,每次持续1min,循环5次。离心机12000r/min、4℃离心20min取上清液,依照BCA蛋白定量试剂盒步骤进行蛋白定量。定量后加入5×上样缓冲液,100℃变性5min备用。配制10% SDS-PAGE凝胶,取40μg蛋白(p-p65、p65、p-IκBα、IκBα)或80μg蛋白(p-p38、p-ERK、p-JNK、p38、ERK、JNK)上样,加入电泳液,连接电泳仪调整电压为80V进行电泳,至分离胶时转120V电泳至底部,打开切胶进行转膜(PVDF膜,湿转,220mA,60min),5%脱脂奶粉或5% BSA溶液(磷酸化蛋白)封闭4h,洗膜(0.1% PBST 5min,重复3次)后一抗封闭过夜,第2d洗膜后二抗孵育2h,再洗膜,取出表面滴ECL发光液进行曝光。一抗浓度:p-p65、p65、p-IκBα、IκBα、p-p38、p38及p-ERK(均1∶1000),p-JNK及JNK(1∶800),ERK(1∶500),β-Actin(1∶1000)。二抗浓度:1∶10000。使用Image J软件分析条带,p-p65与p65比值,p-IκBα、IκBα与β-Actin比值进行计算,p-p38、p-ERK及p-JNK分别与p38、ERK和JNK比值进行计算。

2结果
2.1枸杞多糖对LPS诱导下ARPE-19细胞活力的影响空白组、LPS组、低浓度LBP组、中浓度LBP组、高浓度LBP组细胞存活率分别为(96.33±6.51)%、(61.79±19.78)%、(107.58±40.47)%、(118.29±34.42)%、(114.01±20.70)%,差异有统计学意义(F=3.496,P=0.026)。与空白组相比,LPS组细胞存活率下降,但差异无统计学意义(P>0.05)。相较于LPS组,各LBP处理组细胞存活率升高,均大于80%,差异有统计学意义(P<0.05),但各浓度处理组之间相比差异均无统计学意义(P>0.05),表明一定浓度的LBP对LPS诱导ARPE-19细胞的炎性损伤具有抑制作用,见图1。

图1 枸杞多糖对LPS诱导ARPE-19细胞活力的影响 a P<0.05 vs LPS组。

图2 枸杞多糖对LPS诱导ARPE-19细胞内炎性因子的影响 A:IL-6的mRNA表达量;B:IL-1β的mRNA表达量;C:MCP-1的mRNA表达量。 b P<0.01 vs LPS组。

表1 RT-PCR引物序列
2.2各组细胞内炎性因子mRNA表达量的变化各组细胞内炎性因子IL-6、IL-1β和MCP-1的mRNA表达量比较,差异均有统计学意义(P<0.001),见表2。其中,LPS组表达量较空白组均明显升高,差异均有统计学意义(P<0.001);与LPS组相比,低、中、高浓度LBP组的IL-6及MCP-1表达量均明显下降,高浓度LBP组的IL-1β表达量也明显降低,差异均有统计学意义(P<0.01)。但各因子的三个LBP浓度组之间进行比较,表达量未见明显变化,差异均无统计学意义(P>0.05)。可见,在转录水平,LBP能够抑制LPS诱导的ARPE-19细胞中炎性因子IL-1β、IL-6及MCP-1的表达,而此作用与LBP的剂量无关,见图2。
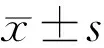
表2 各组细胞内炎性因子mRNA的表达

图3 枸杞多糖对LPS诱导的ARPE-19细胞内NF-κB通路相关因子蛋白表达量的影响 A:p-p65相对蛋白表达量;B:p-IκBα相对蛋白表达量;C:IκBα相对蛋白表达量;D:蛋白表达检测条带。a P<0.05,b P<0.01 vs LPS组。
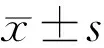
表3 各组细胞内NF-κB/MAPK通路相关蛋白的表达
2.3各组细胞内NF-κB/MAPK通路相关蛋白表达量的变化
2.3.1 NF-κB通路各组NF-κB通路的p-p65、p-IκBα及IκBα蛋白表达水平比较,差异均有统计学意义(P<0.05,表3)。LPS组的p-p65、p-IκBα表达水平较空白组明显升高,而IκBα蛋白表达量降低,差异均有统计学意义(P<0.05);与LPS组相比,低、中、高浓度LBP组的p-p65表达量均明显降低,差异均有统计学意义(P<0.01);与低浓度LBP组比较,高浓度LBP组的p-p65、p-IκBα蛋白表达量均降低,差异均有统计学意义(P<0.05),可见LBP的作用随浓度升高而增强;同时,高浓度LBP组的IκBα表达量较LPS组升高,而p-IκBα表达量降低,差异均有统计学意义(P<0.05),表明LBP能够抑制IκBα蛋白向p-IκBα转化。所以,枸杞多糖能够抑制LPS刺激ARPE-19细胞NF-κB通路的激活,并可通过抑制NF-κB通路相关蛋白p65、IκBα的磷酸化发挥效应,且呈现出LBP剂量依赖性,见图3。
2.3.2 MAPK通路检测各组MAPK通路磷酸化因子的蛋白相对表达量进行比较,差异均有统计学意义(P<0.05),见表3。与空白组相比,LPS刺激后p-JNK、p-ERK及p-p38的蛋白表达量升高,差异均有统计学意义(P<0.05);与LPS组相比较,低、中、高浓度LBP组p-p38的蛋白表达量可见明显下降,中、高浓度LBP组p-JNK的蛋白表达量降低,并且在高浓度LBP组的细胞中p-ERK的蛋白表达量有所减少,差异均具有统计学意义(P<0.05);比较低浓度LBP组与高浓度LBP组,发现三种磷酸化蛋白表达量随着LBP浓度的升高均有降低,差异均有统计学意义(P<0.05),见图4。由此可见,枸杞多糖能够抑制LPS刺激ARPE-19细胞内JNK、ERK及p38的磷酸化,并具有剂量依赖性,揭示枸杞多糖可通过JNK/ERK/p38通路抑制LPS诱导的ARPE-19炎性反应。

图4 枸杞多糖对LPS诱导的ARPE-19细胞内MAPK通路相关因子蛋白表达量的影响 A:p-JNK相对蛋白表达量;B:p-ERK相对蛋白表达量;C:p-p38相对蛋白表达量;D:蛋白表达检测条带。a P<0.05, b P<0.01 vs LPS组。
3讨论
LBP具有明确的抗炎作用,研究发现它可通过抗炎、抗氧化和抗凋亡等机制发挥神经保护作用[12-13]。在小鼠巨噬细胞中,LBP可通过抑制TLR4/NF-κB信号通路减轻LPS诱导的炎性反应[14];并且,LBP可通过MAPK通路调节促炎细胞因子的变化,进而抑制小鼠肝脑损伤及运动障碍[15]。眼科研究中,已证实雷公藤、血管紧张素转换酶2激动剂等药物可通过NF-κB/MAPK通路抑制LPS诱导的RPE炎症性反应[16-17]。所以,我们采用LPS诱导ARPE-19细胞建立炎性反应模型观察LBP的作用,证实LPS可诱导ARPE-19发生炎性损伤、细胞存活率下降,并且发现一定浓度的LBP预处理能提高炎性损伤后的RPE细胞活力。而且,LPS与LBP同时应用并未降低细胞活力,证实了LBP应用的无毒性,这可为预防RPE的炎性损伤提供一种安全的新药物。
在ARMD的机制及治疗研究中,炎性因子一直受到广泛关注。近年研究发现,眼部衰老相关疾病可伴随有IL-6、IL-1β及MCP-1等炎性因子的增加[18-19];有人使用IL-1β刺激RPE细胞,发现IL-6、IL-8及MCP-1等炎性因子的升高[20];还发现通过LPS刺激RPE细胞也可出现IL-6、IL-8及MCP-1等升高[17-21]。而在本实验中,我们也观察到LPS诱导ARPE-19细胞后,细胞内炎性因子IL-6、IL-1β及MCP-1的表达量明显升高,并且发现 LBP可发挥明显的抗炎作用,降低这些炎性因子的表达,为LBP能够抑制RPE细胞的炎性反应提供了有力证据。另外,细胞产生炎性反应时,几乎都存在NF-κB通路的激活。比如LPS刺激细胞后,可与细胞表面的Toll样受体结合,激活IκBα激酶,合成IκBα复合物,进一步诱导IκBα磷酸化、泛素化,后被相应蛋白酶识别降解,使得p50/p65从IκBα复合物中释放出来,形成p50/p65二聚体,再迅速发生核转位,由p65形成p-p65,最后启动细胞核中如TNF-α、IL-1β、IL-6及MCP-1等细胞炎性因子的靶基因表达[22-24]。在本实验中我们观察到LPS诱导后ARPE-19细胞中IκBα、p65的磷酸化水平升高,进一步证实LPS能够通过诱导RPE细胞中NF-κB通路的激活发挥其致炎作用。在此基础上新发现LBP可上调RPE细胞中IκBα蛋白水平,下调磷酸化因子p-IκBα、p-p65的表达,表明LBP能够抑制胞内NF-κB通路激活、阻碍IκBα及p65向磷酸化转化。此结果明确了在RPE细胞中,LBP的抗炎作用机制可通过抑制NF-κB通路进行。并且我们还对LBP在三个浓度梯度下的抗炎作用进行了研究,发现浓度越高,LBP抑制NF-κB通路激活的作用越强。这显示出LBP的抗炎作用存在剂量依赖性,可为下一步进行体内及临床研究时选择药物浓度提供参考。
MAPK通路与细胞增殖、应激、炎症、凋亡等信号转导通路密切相关。作为这些通路的交汇点,它将胞外信号经受体、G蛋白、蛋白激酶、转录因子等组成信号网络,传递到胞内,参与细胞分化、癌变、迁移、凋亡等细胞病理生理过程。MAPK通路是信号从细胞表面到细胞核内部的重要传递者,分为ERK、p38、JNK和ERK5等亚族,其激活通过级联过程进行,被激活后表现为逐级的磷酸化[25]。研究表明,LPS刺激可通过激活细胞内信号通路适配器MyD88蛋白的表达进行,再启动下游信号转导级联,引起MAPK通路中p-JNK、p-ERK及p-p38的激活[26-27]。我们的实验结果也证实了这一点。同时发现LBP可降低LPS刺激后RPE细胞内JNK、ERK及p38的磷酸化表达,这显示LBP是通过抑制MAPK中亚级通路JNK/ERK/p38的激活来降低RPE炎性反应。除此之外,不同浓度LBP作用强度不同,在低浓度LBP的处理下抑制MAPK通路激活的作用并不明显,但在高浓度LBP组中,三种因子的磷酸化表达均有很大程度的减低,所以,LBP的抗炎作用与药物用量密切相关。再者,由于MAPK通路与细胞增殖及凋亡联系紧密,所以ARMD中RPE细胞的炎症相关死亡方式也值得关注。
本实验虽然得出细胞水平的结论,无体内实验证据,但可为下一步继续深入探讨LBP对ARMD中炎症方面的作用提供基本依据。基于细胞实验,还可进行细胞死亡方式的研究,并观察其他可能参与RPE炎性反应的信号通路,为ARMD及眼科RPE相关炎症性疾病的治疗提供新靶点。
综上所述,枸杞多糖对于LPS诱导的人视网膜色素上皮细胞炎性反应具有抑制作用,并通过抑制NF-κB/MAPK通路相关因子的磷酸化及阻碍细胞内炎性因子IL-1β、IL-6及MCP-1的转录过程而发挥影响。
