基于网络药理学探讨辛热中药挥发油外用的药效物质基础及潜在分子机制
2021-03-09魏旭超蔡徐艺
顾 琦,魏旭超,刘 露,梁 莹,李 健,董 洁,蔡徐艺,顾 薇,,陈 军,
1.南京中医药大学药学院,江苏 南京 210023
2.江苏省中医外用药开发与应用工程研究中心,江苏 南京 210023
3.江苏省中药炮制重点实验室,江苏 南京 210023
4.南京中医药大学 江苏省中药资源产业化过程协同创新中心,江苏 南京 210023
大部分作用于皮肤屏障的中药挥发油均来自于辛味中药[1],符合“辛开腠理”药性。课题组前期对已报道的34 种有促渗作用的辛味中药挥发油进行数据挖掘[2],通过实验对21 种辛味中药挥发油的透皮促渗效果进行比较[3],并考察了“四气”对挥发油透皮促渗效果的影响[1,4],发现辛味中药挥发油透皮促渗能力排序为热性>温性>寒凉,与清代外治大家吴尚先“膏药热者易效”的观点一致[5]。挥发油成分是芳香中药中不可或缺的功效物质,中药挥发油作为透皮促渗剂备受重视[6-7]。目前仅遵循化学促渗剂的研究路径,以自身的透皮促渗作用进行复方配伍[8]忽略了中药挥发油自身的药理作用,这种“重辅轻药”的研究模式并不适用于中药挥发油的外用研究。目前的外用中药挥发油以辛温中药挥发油品种最多,单一品种以辛凉的薄荷油应用最多,而辛热中药挥发油应用近乎空白。基于此,本研究根据“膏药热者易效”的指导思想,对高良姜、吴茱萸、胡椒、干姜、肉桂5 种辛热中药挥发油进行成分分析与挖掘,并通过网络药理学与分子对接研究,探寻辛热中药挥发油外用的药效物质基础及作用靶点,阐释其药性显“热”的分子机制,为辛热中药挥发油的开发与利用提供新的思路。
1 材料
1.1 药材
高良姜、干姜、防风、花椒、八角茴香、小茴香、胡椒、荜澄茄、吴茱萸、荆芥、肉桂、丁香、木香、藁本(批号分别为171208、180117、171224、171122、171217、171209、170920、171227、170620、180127、171218、170711、180112、171119)均购自苏州市天灵中药饮片有限公司;乳香(批号16010500)购自北京仟草中药饮片有限公司。以上饮片经南京中医药大学药学院刘圣金副教授分别鉴定为姜科植物高良姜Alpinia officinarumHance 的干燥根茎、姜科植物姜Zingiber officinaleRosc.的干燥根茎、伞形科植物防风Saposhnikovia divaricata(Turcz.) Schischk.的干燥根、芸香科植物花椒Zanthoxylum bungeanumMaxim.的干燥成熟果皮、木兰科植物八角茴香Illicium verumHook.f.的干燥成熟果实、伞形科植物茴香Foeniculum vulgareMill.的干燥成熟果实、胡椒科植物胡椒Piper nigrumL.的干燥成熟果实、樟科植物山鸡椒Litsea cubeba(Lour.)Pers.的干燥成熟果实、芸香科植物吴茱萸Euodia rutaecarpa(Juss.) Benth.的干燥近成熟果实、唇形科植物荆芥Schizonepeta tenuifoliaBriq.的干燥地上部分、樟科植物肉桂Cinnamomum cassiaPresl 的干燥树皮、桃金娘科植物丁香Eugenia caryophyllataThunb.的干燥花蕾、菊科植物木香Aucklandia lappaDecne.的干燥根、伞形科植物藁本Ligusticum sinenseOliv.的干燥根、橄榄科植物乳香树Boswellia carteriiBirdw.树皮渗出的树脂,均符合《中国药典》2015年版标准。
1.2 药品与试剂
无水硫酸钠(批号170328041V)购自南京化学试剂有限公司;醋酸乙酯(批号20171102)购自永华化学科技有限公司。
1.3 仪器
PTHW 型调温电热套(南通市通州申通电热器厂);TGL-16B 型高速离心机(上海安亭科学仪器厂);BAS-124S 型分析天平、BT-52S 型分析天平(德国赛多利斯股份有限公司);WAY-2S 型阿贝折光仪(上海精密科学仪器有限公司);7890A-5975C 型气相色谱质谱联用仪(美国安捷伦公司);DHG9123A型恒温鼓风干燥箱(上海精宏实验设备有限公司);HH-4 型恒温水浴锅(国华电器有限公司)。
1.4 数据库与软件
Swiss Target Prediction 网站(http://new.swisstargetprediction.ch)、中药系统药理学数据库与分析平台(TCMSP,http://lsp.nwu.edu.cntcmspsearch.php)、TIGER 数据库(http://bioinfo.wilmer.jhu.edu/tiger)、Uniprot 数据库(http://www.uniprot.org)、京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路数据库(http://www.genome.jp/kegg)、STRING 数据库(http://string-db.org)、DAVID 数据库(https://david.ncifcrf.gov/home.jsp)、PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)、Cytoscape 3.7.0 软件。
2 方法
2.1 辛热、辛温中药挥发油的制备
称取适量中药饮片,粉碎后加入圆底烧瓶中,加入10~15 倍体积的蒸馏水,连接挥发油提取器、冷凝管,自冷凝管上端加蒸馏水至溢出挥发油提取器支口,浸泡0.5~1.0 h,加热保持微沸至挥发油体积无明显变化,停止加热。室温冷却,用棕色玻璃瓶接收挥发油,加入适量无水硫酸钠脱水,于4℃避光密封保存备用[1]。
2.2 基于气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)联用技术的中药挥发油成分分析
2.2.1 供试品的制备 精密称定中药挥发油0.10 g于10 mL 量瓶中,用醋酸乙酯定容。12 000 r/min离心10 min,取上清液进样分析。
2.2.2 GC-MS 条件 HP-5ms 色谱柱(5%苯甲基聚硅氧烷石英毛细管柱,30 m×0.25 mm×0.25 μm);载气为氦气;体积流量为1 mL/min;EI 离子源;电离能量为70 eV;离子源温度为230 ℃;进样口温度为250 ℃;进样体积为1 μL;分流进样,分流比50∶1(木香油与肉桂油的分流比为40∶1)[1]。
2.3 辛热中药挥发油中倍半萜类成分与靶点网络及蛋白质-蛋白质互作(protein-protein interaction,PPI)网络的构建
选取5 种辛热中药挥发油(高良姜油、肉桂油、胡椒油、吴茱萸油、干姜油)中倍半萜类成分,基于TCMSP 和Swiss Target Prediction 数据库进行潜在活性成分及靶点筛选,用Uniprot 数据库进行基因名校正。课题组前期研究发现辛热中药挥发油外用给药时,倍半萜类成分相较于其他成分更倾向于滞留在皮内[9],因此本研究同时用TIGER 数据库筛选在皮肤中表达的蛋白,最后运用Cytoscape 软件构建“药材-成分-靶点”网络。采用STRING 数据库对潜在关键靶点建立PPI 网络。
2.4 统计学分析
实验数据采用SPSS 19.0 软件分析,数据以±s表示,组间比较用t检验。
3 结果
3.1 辛热与辛温中药挥发油的差异成分测定
选择透皮促渗性能较优的辛热类药材高良姜、干姜、肉桂、吴茱萸、胡椒,辛温类药材防风、花椒、八角茴香、小茴香、荜澄茄、荆芥、丁香、木香、藁本、乳香,分别提取得到辛热中药挥发油(高良姜油、干姜油、肉桂油、吴茱萸油、胡椒油)和辛温中药挥发油(防风油、花椒油、八角茴香油、小茴香油、荜澄茄油、荆芥油、丁香油、木香油、藁本油、乳香油)。GC-MS 成分分析[3]如图1中所示,辛热、辛温中药挥发油中主要含倍半萜类、单萜类、芳香族类化合物,其中高良姜油、干姜油、吴茱萸油、胡椒油主要由倍半萜类、单萜类化合物组成,肉桂油主要由倍半萜类、芳香族类化合物组成,防风油、花椒油、荜澄茄油、荆芥油主要由单萜类化合物组成,八角茴香油、小茴香油、丁香油、藁本油主要由芳香族类化合物组成,乳香油、木香油含有较多脂肪族及脂肪酸类化合物。
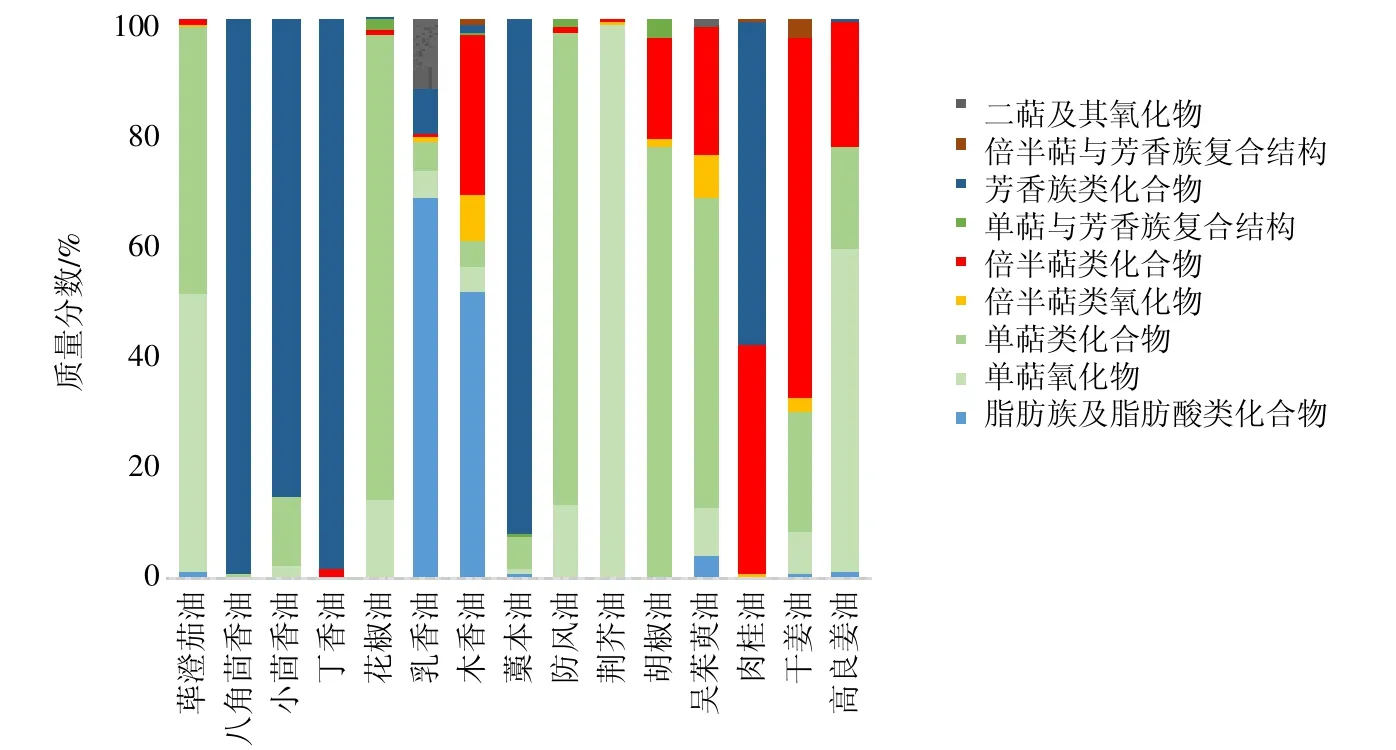
图1 辛温、辛热中药挥发油成分分布Fig.1 Component distribution in “warm” and “hot” pungent CMM
辛热中药挥发油中倍半萜类成分质量分数高于辛温中药挥发油,其中辛热中药挥发油中质量分数大于1%的倍半萜类成分有14 个,如表1所示,分别为β-石竹烯、α-muurolene、吉马烯、β-榄香烯、δ-榄香烯、β-芹子烯、α-胡椒烯、δ-杜松烯、γ-muurolene、α-香柠檬烯、姜烯、β-倍半水芹烯、β-甜没药烯、α-法呢烯。如表2所示,β-石竹烯为5种辛热中药挥发油的共性倍半萜类成分,且其质量分数最高。

表1 5 种辛热中药挥发油中质量分数大于1%的倍半萜类化合物Table 1 Sesquiterpenoids with mass fraction greater than 1% of essential oils of five “hot” pungent CMM

表2 辛热中药挥发油中的共性倍半萜类化合物信息Table 2 Information of common sesquiterpees in essential oils of “hot” pungent CMM
课题组前期研究发现倍半萜类成分可能是决定辛热中药挥发油透皮促渗能力的关键成分[1],温性的生姜炮制成热性的干姜后,挥发油中倍半萜类成分质量分数增加且透皮促渗能力增强[10]。研究发现,唇形科中药物质成分与药性间存在相关性,其中侧柏酮、水芹烯、γ-荜澄茄烯、3-蒈烯、紫苏醛、莳萝油脑与热性的关联最为密切,其中多个成分为倍半萜类成分[11]。
综上,倍半萜类成分可能是辛热中药挥发油区别于辛温中药挥发油的关键物质基础,从透皮促渗作用和药理活性两方面产生“热者易效”的作用。因此,基于辛热中药(高良姜、干姜、肉桂、吴茱萸、胡椒)挥发油中的倍半萜类成分开展后续实验。
3.2 辛热中药挥发油中倍半萜类成分与靶点网络的分析
“药材-成分-靶点”网络如图2所示,辛热中药挥发油中倍半萜类成分的潜在作用靶点包括前列腺素内过氧化物合酶2(prostaglandin G/H synthase 2,PTGS2)、核受体共激活蛋白2(nuclear receptor coactivator 2,NCOA2)、PTGS1、类视黄酸X 受体α(retinoic acid X receptor α,RXRA)、毒蕈碱型乙酰胆碱受体3(cholinergic receptor muscarinic3,CHRM3)、γ-氨基丁酸受体α6(gamma-aminobutyric acid receptor α6,GABRA6)、单胺氧化酶 B(monoamine oxidase B,MAOB)、过氧化物酶体增殖剂激活受体α(peroxisome proliferator-activated receptor alpha,PPARA )、白细胞介素-6(interleukin-6,IL-6)、γ-氨基丁酸受体α5(gamma-aminobutyric acid receptor α5,GABRA5)。
3.3 蛋白互作网络分析
如图3和表3所示,辛热中药挥发油外用潜在靶点主要聚焦在产热(靶点包括NCOA2)、脂代谢(靶点包括PPARA、RXRA、NCOA2)及抗炎(靶点包括PTGS1、PTGS2、IL-6),提示产热、减脂、抗炎为辛热中药挥发油倍半萜类成分的主要药理作用,其对应的化合物(β-石竹烯、α-muurolene、吉马烯、β-榄香烯、δ-榄香烯、β-芹子烯、α-胡椒烯等)为潜在的关键作用成分。研究发现,倍半萜类成分具有显著的药理活性,如β-甜没药烯具有抗肿瘤活性[12],β-石竹烯具有抗炎、抗癌、镇痛、神经保护、抗肿瘤、调血脂和防治肝损伤作用[13],β-榄香烯、α-胡椒烯、姜烯等具有抗肿瘤、抗炎的作用[14-16]。
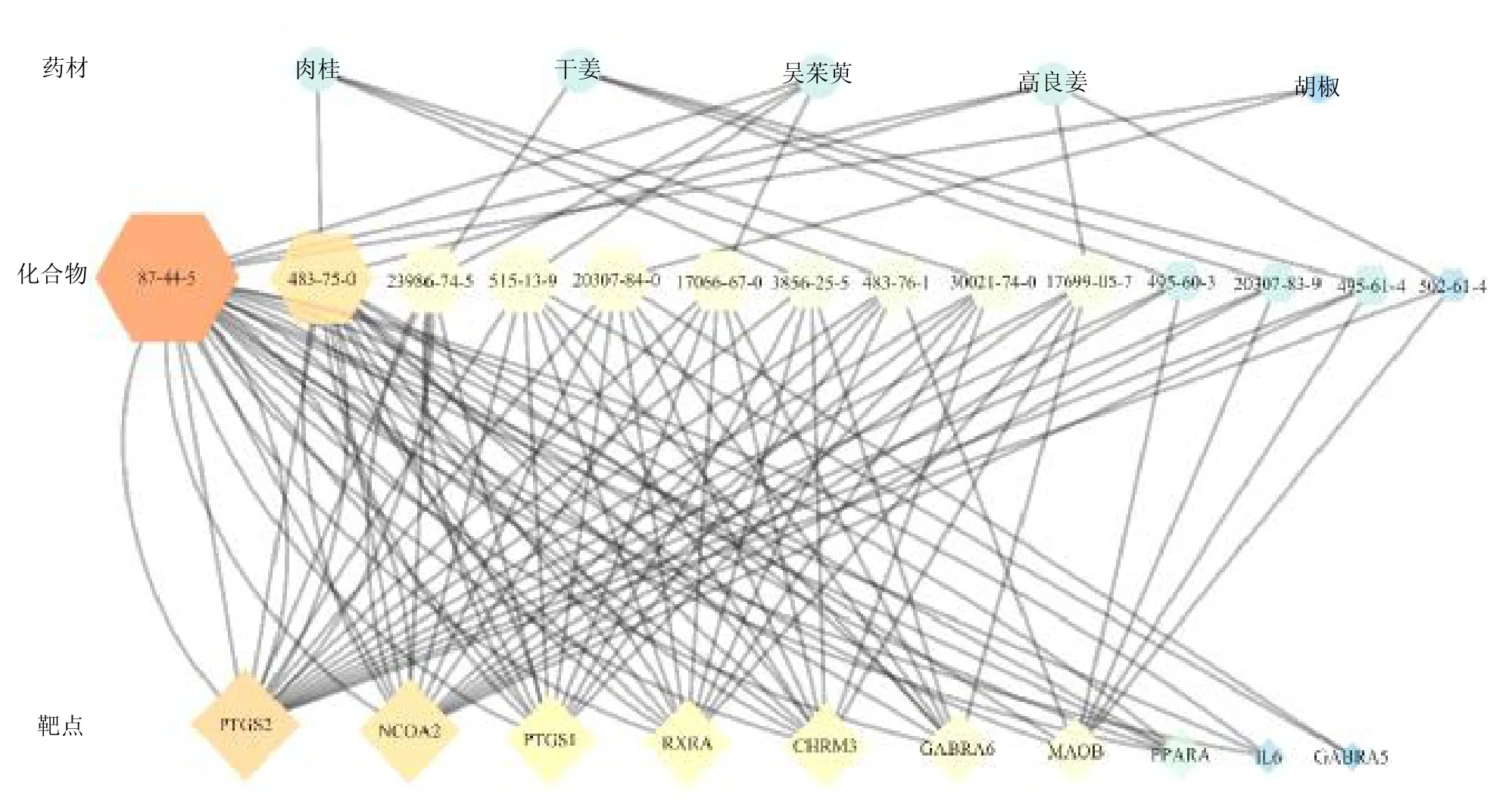
图2 5 种辛热中药挥发油中倍半萜类成分与靶点网络图Fig.2 Network of sesquiterpenoids and targets in essential oils of five “hot” pungent CMM
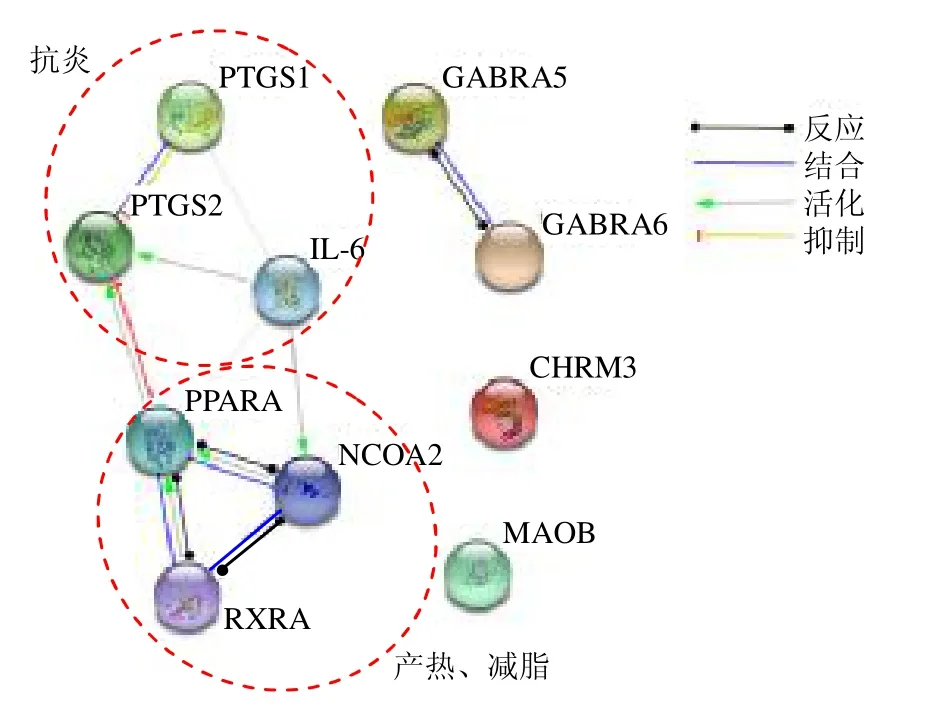
图3 5 种辛热中药挥发油中倍半萜类成分潜在关键靶点的PPI 网络图Fig.3 PPI network of potential key target corresponding to sesquiterpenoids in essential oils of five “hot” pungent CMM
3.3.1 辛热中药挥发油作用于 NCOA2 靶点产热 研究发现,NCOA2−/−小鼠适应性生热增强,能量消耗增加,胰岛素敏感性显著增加,对肥胖具有抵抗力;NCOA1−/−小鼠能量消耗减少,容易肥胖;NCOA2/NCOA1 在高脂饮食中可用来评价机体脂肪储存和产热状况[17]。NCOA2−/−小鼠肝脏中能量代谢增加,脂肪酸降解和糖酵解途径上调,脂肪酸、胆固醇和类固醇生物合成途径下调[18],表明抑制NCOA2 可导致细胞能量消耗增加,脂类合成下降。由此可见,辛热中药挥发油外用作用于NCOA2 可能为其药性显热的分子机制。
以生姜炮制为干姜、药性由微温转热为例[9],二者成分主要为倍半萜类与单萜类化合物,如表4所示,生姜炮制成干姜后倍半萜类化合物质量分数上升,单萜类化合物质量分数降低,与本研究中辛热中药挥发油中倍半萜类化合物质量分数高于辛温中药挥发油一致。如表5所示,干姜挥发油中与NCOA2 有对应关系的各成分总质量分数(68.03%)高于生姜挥发油中各成分总质量分数(48.22%),其中倍半萜类化合物与NCOA2 的对应率高于单萜类化合物,75.29%倍半萜类化合物与NCOA2 存在预测对应关系,20.55%单萜类化合物与NCOA2 存在预测对应关系,表明NCOA2 可能是生姜炮制后药性由微温转变为热的分子机制,而其中的倍半萜类化合物是其药性变热的主要功效成分。
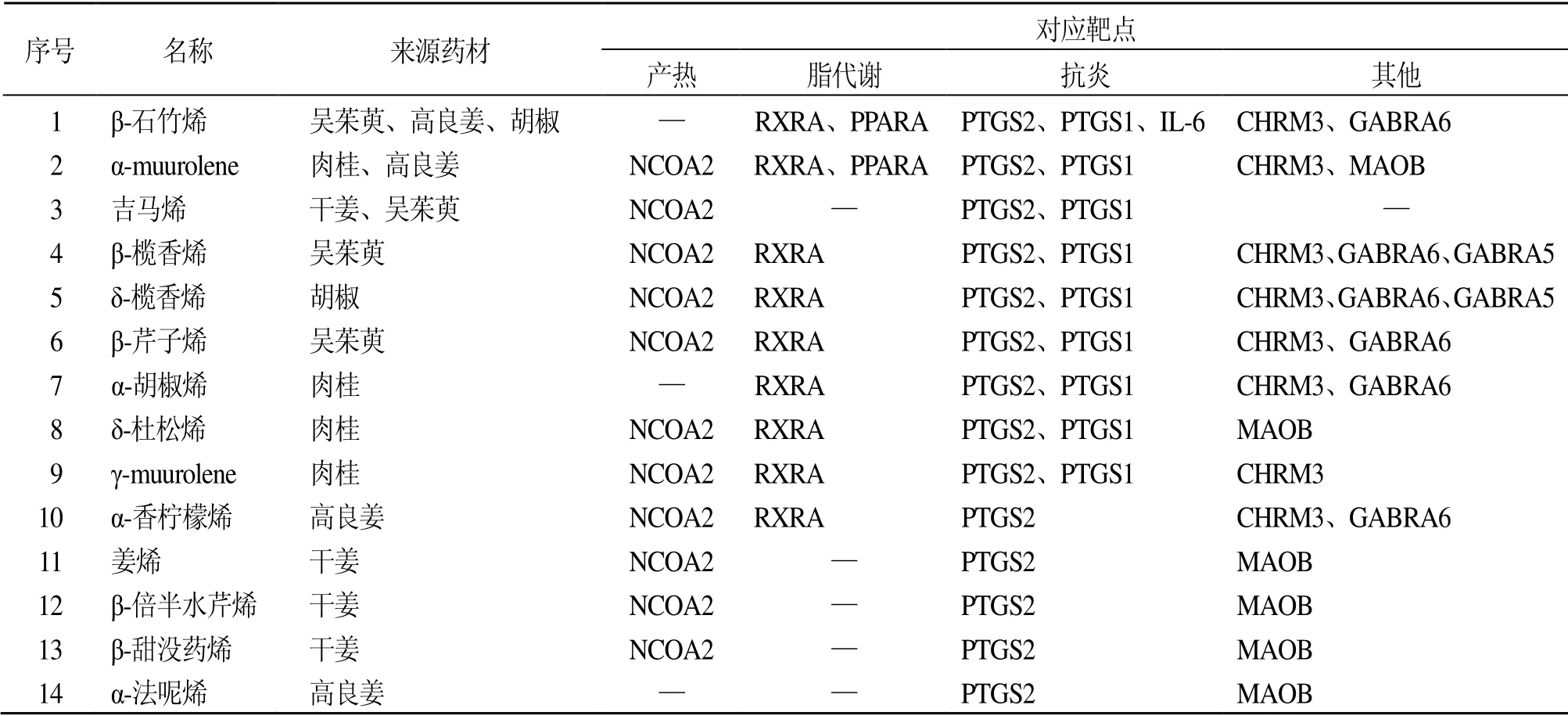
表3 5 种辛热中药挥发油中倍半萜类化合物及其对应靶点信息Table 3 Information of sesquiterpenoids and targets in essential oils of five “hot” pungent CMM
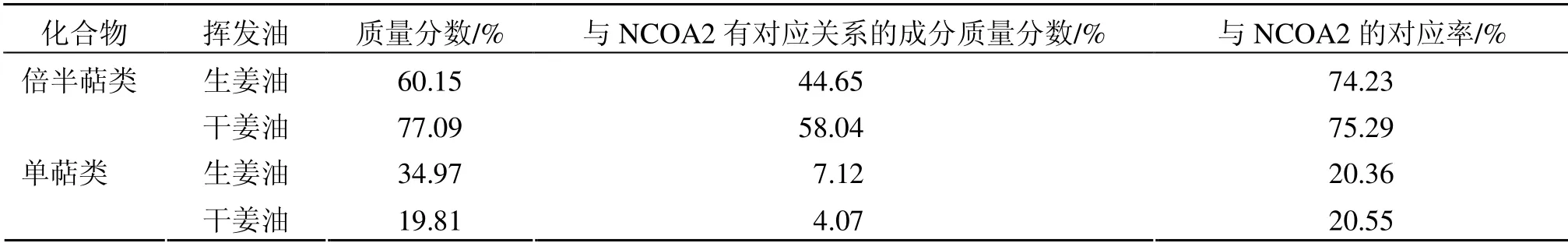
表4 生姜炮制前后挥发油中倍半萜和单萜成分的差异及与NCOA2 的对应关系Table 4 Difference of sesquiterpenoids and monoterpenoids in essential oil of Zingiberis Rhizoma before and after processing and corresponding relationship with NCOA2
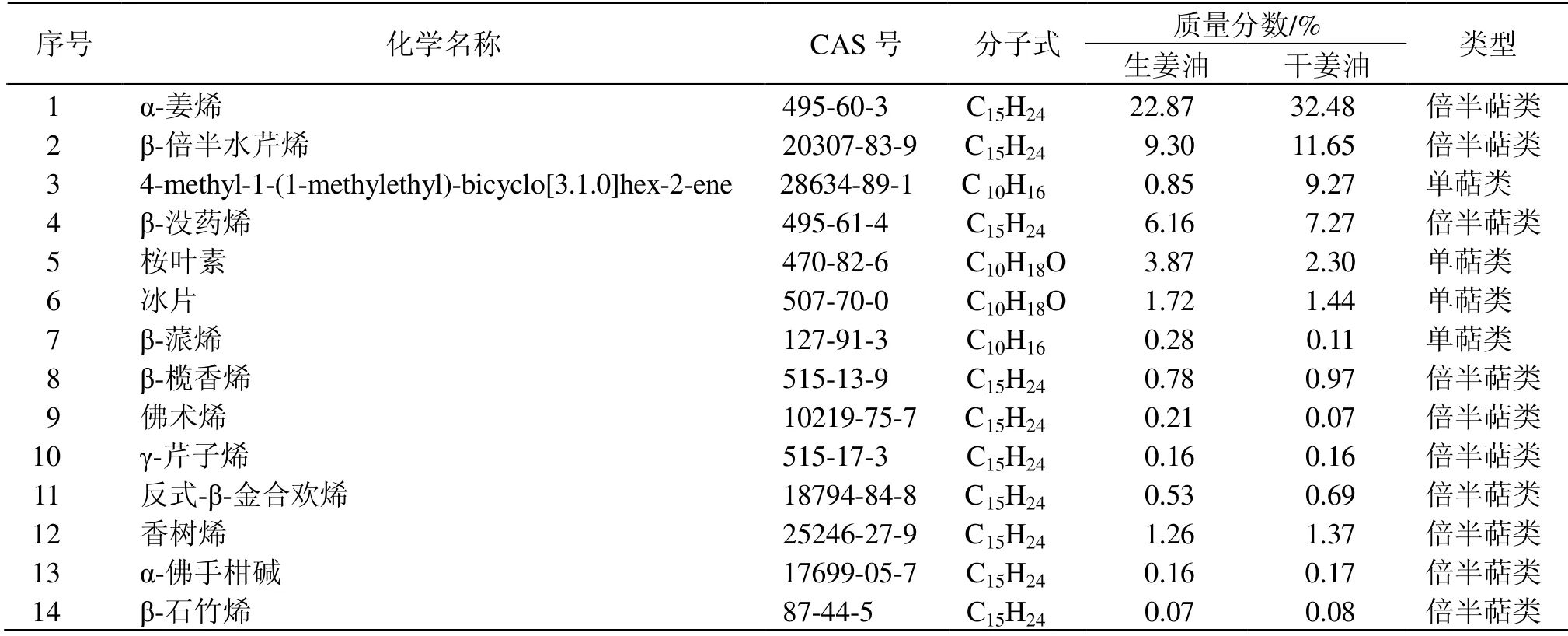
表5 生姜炮制前后挥发油中与NCOA2 有对应关系的化合物Table 5 Compounds corresponding to NCOA2 in essential oils of Zingiberis Rhizoma before and after processing
3.3.2 辛热中药挥发油作用于 PPARA-RXRANCOA2信号轴影响脂质代谢 PPAR可调控参与脂肪和糖代谢相关基因的表达,从而调节体内脂质和葡萄糖稳态[19-20]。PPARA 在细胞核内与RXR 形成异二聚体,与亚油酸、亚麻酸、花生四烯酸、二十碳五烯酸等多不饱和脂肪酸结合后被激活,PPARA构象改变,释放辅抑制因子,并结合辅活化因子(包括NCOA2),从而激活下游基因[21-22]。PPARA 调控脂肪酸转运、脂肪酸氧化、三酰甘油(triglycerides,TG)清除、脂蛋白生成和胆固醇稳态,其活性受RXRA 和NCOA2 影响,在脂代谢中发挥着重要作用。脂肪主要存在于皮下组织,表皮中含有丰富的必须脂肪酸如亚油酸、花生四烯酸等,因此,辛热中药挥发油可能通过作用于 PPARA-RXRANCOA2 信号轴,改变脂肪酸分解代谢相关基因的转录速度,从而调控脂质代谢。
3.3.3 辛热中药挥发油作用于PTGS2、PTGS1 和IL-6 靶点发挥抗炎作用 研究发现,辛热中药挥发油中的倍半萜类化合物具有较好的抗炎作用,PTGS1 和PTGS2 是非甾体抗炎药的作用靶点[23]。花生四烯酸在PTGS 作用下,依次转变为前列腺素中间代谢产物前列腺素G2和前列腺素H2,然后经前列腺素合成酶生成各种有生物活性的前列腺素。IL-6 是巨噬细胞分泌的急性促炎细胞因子,可通过作用于JAK-STAT 信号通路发挥作用;血清中IL-6水平与脂肪量呈正相关,常被用作肥胖炎症的标志物。研究表明,前列腺素可促进IL-6 的合成,选择性PTGS2 阻断剂可显著降低IL-6 的表达。辛热中药挥发油可能通过作用于PTGS2、PTGS1 和IL-6靶点发挥抗炎作用。
4 讨论
中药“四气”反映药物对机体阴阳盛衰、寒热变化的作用倾向,物质成分是其药性的基础[10,24-25],药物本身蕴涵不同形式或不同量值的能量或热量物质,内生致热或相关物质作用于机体后能产生一系列生理或病理反应,这些反应大多伴随能量转移和热变化[26]。研究表明,萜类和挥发油类化合物是辛热中药中出现频次最高的化合物,提示萜类和挥发油类化合物是中药药性显热的潜在物质基础[25]。本研究结果表明,辛热中药挥发油外用主要涉及产热相关的NCOA2 靶点及脂代谢相关的PPARA、RXRA、NCOA2 靶点及抗炎相关的PTGS1、PTGS2、IL-6 靶点。本研究揭示了倍半萜类化合物是辛热中药挥发油区别于辛温中药挥发油的关键物质基础,同时透皮促渗能力更强[2-3],外用可发挥“膏药热者易效”的作用,为辛热中药挥发油的药性研究、药理活性及分子机制提供理论依据。
4.1 辛热中药挥发油作用于机体药性显热的分子机制
《中国药典》中高良姜、干姜、胡椒、吴茱萸、肉桂5 种辛热中药均具“散寒”功效,同时辅以“温胃”“温肺”“温中”“温经”“回阳”“助阳”“补火”等描述。干姜对正常动物体温无影响,但其挥发油能抑制啤酒酵母引起的大鼠体温升高[27-28]。基于代谢组学研究发现,干姜油对干酵母和内毒素诱导的热病证候模型均具有良好的解热作用[29]。家兔iv 吴茱萸乙醇提取物可使其体温上升[30]。然而辛热挥发油作用于机体导致能量、热量代谢变化的机制尚不明确,本研究中倍半萜类化合物与产热关键靶点NCOA2 的高频对应关系为辛热中药挥发油作用于机体药性显热的分子机制提供依据。
4.2 辛热中药挥发油影响脂质代谢的分子机制
研究表明,多种辛热中药及其挥发油能够调节脂代谢,具有调血脂、抗脂质过氧化等药理作用。肉桂可改善糖脂代谢[31],肉桂挥发油能够减少肝细胞脂肪沉积[32],并能有效改善胰岛素抵抗小鼠糖脂代谢,其作用与降低血清中瘦素、抵抗素水平并增加胰岛素敏感性有关[33]。肉桂醇提物中的脂溶性部位能明显降低糖尿病小鼠的血糖和血脂水平[34]。吴茱萸提取物和吴茱萸碱可明显降低血清中游离脂肪酸、TG 水平,增强肾周脂肪降解作用,达到辣椒素样减肥作用[35]。高良姜水提物通过抑制胰脂酶的活性来抑制小肠对脂肪的吸收,从而降低血清中TG、总胆固醇(total cholesterol,TC)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平[36]。高良姜总黄酮通过降低肥胖大鼠血清中瘦素、神经肽Y 水平,从而影响胆固醇代谢,降低肥胖大鼠血清TC、TG 和LDL-C 水平[37]。高良姜乙醇提取物能够通过抑制肝脏和脂肪组织CCAAT 增强子结合蛋白 α(CCAAT/enhancer binding protein α,C/EBPα)、脂肪酸合成酶、胆固醇调节元件结合蛋白-1 ( sterol regulatory element-binding protein-1,SREBP-1)和PPARA 蛋白表达,从而降低脂肪含量[38]。本研究结果显示,PPARA-RXRA-NCOA2 信号轴可能为中药挥发油影响细胞脂质代谢的关键通路。
4.3 辛热中药挥发油发挥抗炎作用的分子机制
研究表明,多种芳香精油均具有抗炎活性[39]。肉桂能抑制炎症因子的释放,调节炎症相关通路,具有免疫调节和抗炎作用;肉桂醛和邻-甲氧基肉桂醛是肉桂的主要抗炎活性成分,也是肉桂挥发油中质量分数较高的成分[40];肉桂醛可以缓解脂多糖诱导的全身炎症反应综合征小鼠的症状[41];反式肉桂醛为肉桂叶挥发油中的抗炎活性成分,倍半萜类化合物T-杜松醇和α-杜松醇为混合型挥发油中的抗炎活性成分[42]。干姜的醚提取物、水提取物、醇提取物均具有明显的抗炎作用[43-44];干姜及其挥发油可使幼年小鼠胸腺萎缩,使成年大鼠肾上腺中维生素C 水平显著降低,与可的松作用类似,表明干姜醚提物可能通过促进肾上腺皮质激素释放发挥抗炎作用[45];干姜的镇痛、抗炎成分主要为脂溶性姜酚类化合物[44]和倍半萜成分姜烯[15],其中6-姜酚可以抑制炎症细胞内磷酸二酯酶4(phosphodiesterase 4,PDE4)表达起到抗炎作用[46]。吴茱萸挥发油具抗炎、镇痛的作用[47],吴茱萸挥发油对小鼠耳肿胀模型的炎症反应[48]与醋酸所致的小鼠扭体反应[49]均具有抑制作用;柠檬苦素具有抗肿瘤、抗炎、镇痛、抗菌、神经保护、护肝等药理作用[50]。在二甲苯致小鼠耳肿胀实验、醋酸提高小鼠腹腔毛细血管通透性实验和角叉菜胶致大鼠足跖肿胀实验中,高良姜水提物表现出明显的抗炎作用,高良姜醚提物活性较低[51],高良姜挥发油具有较好的抗炎及镇痛作用;高良姜氯仿提取物能抑制前列腺素合成酶和磷脂酶A2 活性,阻碍花生四烯酸代谢成前列腺素,发挥镇痛、抗炎作用[52]。胡椒油对二甲苯所致的小鼠耳肿胀有显著的抑制作用,能够明显延长热板实验痛阈值[53]。本研究结果显示,辛热中药挥发油可能通过PTGS1、PTGS2 和IL-6 等炎症靶点发挥抗炎作用。
本研究发现,辛热中药挥发油中倍半萜类化合物对药性的解释与其对脂质代谢、抗炎的影响密不可分,热、脂、炎症之间具有一定的联系,如前列腺素E2是重要的炎性介质,也是体内重要的脂质活性分子,可调节脂肪代谢,是目前研究最多的中枢性体温正调节介质之一。肖小河等[54]的中药寒热药性“效应-物质-靶标”假说指出,药性是中药的特征组分作用于机体的共性靶标而产生生物效应的高度概括,即中药药性的传统功效包括生物效应、物质基础和网络靶标3 要素,共同构成一个统一的有机整体。本研究中,β-石竹烯、α-muurolene、吉马烯、β-榄香烯、δ-榄香烯、β-芹子烯、α-胡椒烯等倍半萜类化合物为辛热中药挥发油的特征组分,也是区别于辛温中药挥发油的关键物质基础,其对PPARA-RXRA-NCOA2 信号轴与PTGS2、PTGS1、IL-6 等炎性因子的潜在作用为辛热中药挥发油的共性靶标,从而产生产热、减脂、抗炎作用。通过本研究,一方面可以阐明“热”性药性特征在外用途径下的科学内涵,阐释辛热中药“散寒”的科学内涵;另一方面能够开发辛热中药挥发油减脂、抗炎的功效,阐释辛热中药“止痛”的科学内涵,从而为中药挥发油资源的充分利用提供新的思路。中药挥发油促透剂区别于一般的促透剂,是由于其本身具有不同的药性及药效,如果根据被促透药物的功效及治疗目的,再结合挥发油的作用进行合理筛选,则会在使用时起到促透及协同治疗的双重功效,达到“药辅合一”的作用。
利益冲突所有作者均声明不存在利益冲突
