淡黄裂孔菌和硫色小木层孔菌发酵液化学成分的研究
2021-03-09字洪芳
王 双,字洪芳
(大理大学药学院,云南大理 671000)
淡黄裂孔菌Schizopora flavipora(Berk.& M.A.Curtis ex Cooke)Ryvarden(syn. Poria flavipora)和硫色小木层孔菌Phellinidium sulphurascens(Pilát)Y.C.Dai(syn. Coniferiporia sulphurascens)均为严重的森林病原菌,常生长在针叶树上,可引起木材的白色腐朽及森林大面积死亡[1-3]。淡黄裂孔菌和硫色小木层孔菌均为锈革孔菌目真菌,前者隶属于裂孔菌科、裂孔菌属[4],后者隶属于锈革孔菌科、小木层孔属[5]。
目前对2 种真菌化学成分的研究较少,硫色小木层孔菌中主要含有血苋烷型倍半萜[6]。本课题组在寻找高等真菌中活性成分的过程中[7-8],对这2种白色腐朽真菌的发酵液进行化学成分初探,从淡黄裂孔菌中分离得到了2 个氧杂蒽酮类化合物,其中化合物1 为新化合物。从硫色小木层孔菌中分离得到了异地花菌素和2 个血苋烷型倍半萜化合物。
在深入研究云南高等真菌的代谢产物过程中,为寻找更多的结构新颖和具良好活性的先导化合物,OSMAC 是一种有效的策略[9]。OSMAC 策略强调通过改变培养基成分、培养条件和添加酶抑制剂等干扰因素来刺激微生物,激活不同的合成基因簇,挖掘其产生不同次级代谢产物的能力,从而获得骨架新颖、活性高的新化合物。本研究在OSMAC 策略指导下对淡黄裂孔菌和硫色小木层孔菌2 个较稀有高等真菌进行次级代谢产物初步探索,从中分别得到了氧杂蒽酮类、地花菌素类和血苋烷型倍半萜类,氧杂蒽酮类化合物可与不同的靶标作用而具有广泛的生物活性,曾被药物化学家称为“特权结构”[10];地花菌素类化合物则因其抗癌活性、抗HIV 活性而备受关注[11-12];部分血苋烷型倍半萜化合物则具抗真菌作用[13]或对植物病原菌的孢子萌发有显著抑制活性[14]。根据OSMAC策略原理,此次初步研究结果提示这2 种高等真菌具有潜在的合成基因簇、值得更深入地挖掘。在后期研究中可通过扩大发酵液培养规模、改变培养基成分和培养条件等措施而获得更多活性分子。
1 材料
Bruker DRX-500 和AM-400 型核磁共振谱仪(TMS 为内标,德国Bruker 公司);液相四级杆飞行时间质谱仪(美国领先仿生有限公司);Agilent 1200 HPLC、Agilent Zorbox SB-C18柱(4.6 mm×150 mm,5 μm)(美国安捷伦公司);制备柱Zorbax SB-C18(21.2 mm × 150 mm,5 μm);Sephadex LH-20 凝胶(瑞典Amersham Biosciences公司);RP-18 反相硅胶Chromatorex(40~75 μm,日本Fuji 公司);正相硅胶(80~100、200~300目)、GF254TLC 板(青岛海洋化工厂)。
显色方法为荧光灯254、365 nm 波长下观察荧光,碘蒸气显色,10% 浓硫酸香草醛处理后加热显色。
淡黄裂孔菌的子实体于2008 年采自湖北省神农架,硫色小木层孔菌的子实体于2009 年采自吉林省安图县长白山自然保护区,两者均由中国科学院昆明植物研究所杨祝良研究员鉴定为正品。
2 培养与发酵
2 种真菌的发酵均采用斜面转三角瓶液体培养的方法。培养基为葡萄糖20 g、去皮土豆200 g、MgSO41.5 g、KH2PO43 g、VB110 mg,加水混合搅拌至1 000 mL。500 mL 三角瓶装300 mL 液体培养基,接种量为10%,25 ℃下150 r/min 摇床上培养25 d。
3 提取与分离
淡黄裂孔菌发酵液(20 L)滤除菌丝体后浓缩至5 L,用乙酸乙酯萃取3 次,合并提取液蒸干得浸膏15.5 g。然后,经正相硅胶柱色谱(200~300目)、石油醚-丙酮(9 ∶1~1 ∶1)梯度洗脱,按香草醛浓硫酸等显色结果合并得到6 个组分(A~G)。其中组分C 经Sephadex LH-20 氯仿-甲醇(1 ∶1)、正相硅胶色谱柱石油醚-乙酸乙酯(9 ∶1~3 ∶1)梯度洗脱,再经制备HPLC 乙腈-水(30%~60%)梯度洗脱得到化合物1(2.3 mg)、2(2.4 mg)。
硫色小木层孔菌发酵液(21 L)滤除菌丝体后浓缩至5 L,用乙酸乙酯萃取3 次,合并提取液蒸干得浸膏42.5 g。然后,经正相硅胶柱色谱(200~300 目)、石油醚-丙酮(9 ∶1~1 ∶1)梯度洗脱,按香草醛浓硫酸等显色结果合并得到6 个组分(A~G)。组分C 经Sephadex LH-20 氯仿-甲醇(1 ∶1)、正相硅胶氯仿-乙酸乙酯(20 ∶1~5 ∶1)梯度洗脱、常压反相硅胶柱甲醇-水(40%~90%)梯度洗脱、制备HPLC 乙腈-水(40%~70%)梯度洗脱得化合物4(3.2 mg)、5(2.4 mg);组分D石油醚-丙酮(4 ∶1)经硅胶柱氯仿-乙酸乙酯(20 ∶1~4 ∶1)、Sephadex LH-20 氯仿-甲醇(1 ∶1)和制备HPLC 乙腈-水(35%~65%)梯度洗脱得化合物3(4.1 mg)。
4 结构鉴定
化合物1:黄色粉末。通过高分辨质谱HRESI-MS m/z:279.063 3,分子式C15H12O4,不饱和度为10。从13C-NMR 谱中(表1)可见15 个碳信号,由DEPT 谱可知其中有2 个甲基(其中1个连氧)、5 个次甲基、8 个季碳(包括1 个共轭羰基);1H-NMR(500 MHz,DMSO-d6)进一步确定了甲氧基、甲基及羟基(9.88,1H,brs)的存在,除此之外只余5 个芳香氢信号,结合饱和度和碳谱信息,猜测结构母核可能为杂氧蒽酮[15]。从1HNMR 谱中δ 7.39(1H,d,J =2.0 Hz,H-8),7.36(1H,d,J =8.0 Hz,H-5),7.19(1H,dd,J =8.0,2.0 Hz,H-6)信号特别是峰形可知,该苯环为1,2,5 三取代,另外2 个氢信号6.89(1H,s H-4),6.76(1H,s,H-2)所在苯环为1,2,3,5 四取代,2 个氢为间位取代。根据HSQC 信号可知H-1′(3.85,3H,s)与C-1′(56.0,q)相连、H-3′(2.39,3H,s)与C-3′(21.9,q)相连、H-2(6.76,1H,s)与C-2(109.5,d)相连、H-4(6.89,1H,s)与C-4(108.8,d)相连、H-5(7.36,1H,d,J =8.0 Hz)与C-5(123.0,d)相连、H-6(7.19,1H,dd,J =8.0,2.0 Hz)与C-6(123.3,d)相连、H-8(7.39,1H,d,J =2.0 Hz)与C-8(109.0,d)相连。根据HMBC 谱信号,羟甲基H-1′与C-1(160.0,s)关联,甲基H-3′与C-3(146.5,s)、C-2(109.5,d)、C-4(108.8,d)关联,H-2 与C-1(160.0,s)、C-3、C-9a(107.0,s)、C-3′(21.9,q)、C-4 关联,H-4 与 C-4a(157.4,s)、C-3、C-3′、C-2 关联,可知化合物1的1 位被羟甲基取代、3 位为甲基取代。根据HMBC 谱信号,H-5 与C-4b(147.9,s)、C-6、C-7(153.7,s)、C-8a(118.7,s)关联,H-6 与C-5、C-7、C-4b、C-8 关联,H-8 与C-7、C-8a、C-6、C-9(174.3,s)关联,可知化合物1 的7 位被羟基取代。此外,化合物1 与已知化合物1,7-dihydroxymethylxanthone[16-17]区别尽在甲基取代,至此化合物1 的结构确定为1-methoxy-7-hydroxy-methylxanthone,为新化合物。
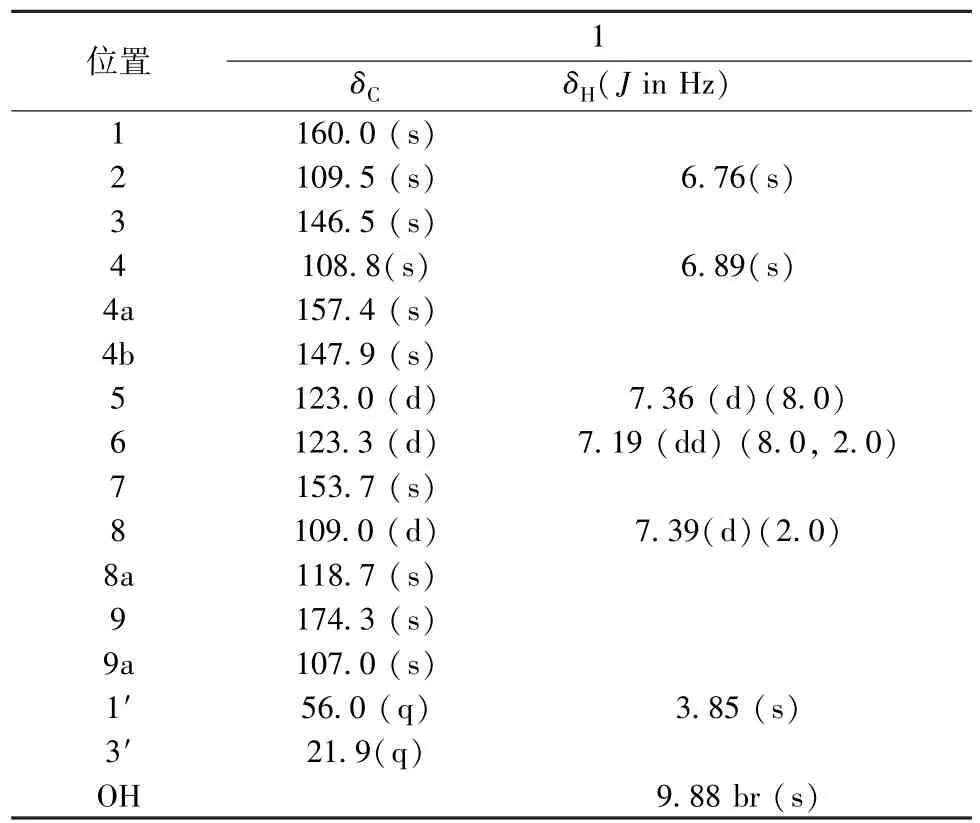
表1 化合物1 的NMR 数据(DMSO-d6)Tab.1 NMR spectral data of compound 1(DMSO-d6)
化合物2:黄色粉末,ESI-MS m/z:265.0[M+Na]+,分子式C14H10O4。1H-NMR(500 MHz,DMSO-d6) δ:7.51(1H,d,J =2.0 Hz,H-8),7.41(1H,d,J =8.0 Hz,H-5),7.33(1H,dd,J =8.0,2.0 Hz,H-6),6.86(1H,d,J =2.0 Hz,H-4),6.62(1H,d,J =2.0 Hz,H-2),2.37(3H,s,H-3′);13C-NMR(500 MHz,DMSO-d6) δ:181.4(s,C-9),160.9(s,C-1),156.1(s,C-4a),154.4(s,C-7),149.6(s,C-4b),149.3(s,C-3),125.7(d,C-6),120.8(d,C-5),119.7(s,C-8a),110.8(d,C-2),108.1(d,C-8),107.8(d,C-4),106.2(s,C-9a),22.4(q,C-3′)。以上数据与文献[16-17]报道一致,故鉴定为1,7-dihydroxymethyl-xanthone。

图1 化合物1 结构及其HMBC 相关图Fig.1 Structures compounds 1 and its key HMBC correlations
化合物3:黄色油状物;分子式C22H32O2;ESI-MS m/z:351.2 [M+Na]+。1H-NMR(400 MHz,CDCl3) δ:6.26(1H,d,J =2.3 Hz,H-1),6.21(1H,d,J =2.3 Hz,H-3),5.14(1H,t,J =6.7 Hz,H-2′),5.07(1H,m,H-6′),5.06(1H,m,H-10′),3.29(2H,d,J =6.7 Hz,H-1′),2.23(3H,s,H-8),2.09(2H,m,H-8′),2.04(2H,m,H-4′),2.03(2H,m,H-5′a,9′a),1.96(2H,m,H-5′b,H-9′b),1.79(3H,s,H-15′),1.67(3H,s,H-12′),1.59(3H,s,H-13′),1.58(3H,s,H-14′);13C-NMR(400 MHz,CDCl3) δ:155.4(s,C-4),154.2(s,C-6),138.4(s,C-3′),137.6(s,C-2),135.4(s,C-7′),131.2(s,C-11′),124.4(d,C-10′),123.6(d,C-6′),121.6(d,C-2′),110.4(s,C-5),109.0(d,C-1),101.0(d,C-3),39.6(t,C-4′),39.5(t,C-8′),26.6(t,C-5′),26.3(t,C-9′),25.6(q,C-12′),22.1(t,C-1′),21.0(q,C-8),17.6(q,C-13′),16.2(q,C-15′),16.0(q,C-14′)。以上数据与文献[18-19]报道一致,故鉴定为异地花菌素。
化合物4:白色粉末;分子式15H26O2;ESI-MS m/z:261.2 [M+Na]+。1H-NMR(500 MHz,CDCl3) δ:5.52(1H,brs,H-7),3.85(1H,dd,J =11.0,2.5 Hz,H-11a),3.74(1H,dd,J =10.8,7.2 Hz,H-11b),3.25(1H,dd,J =10.6,5.1 Hz,H-3),2.00(3H,m,H-1a,H-6),1.83(1H,m,H-9),1.64(2H,m,H-2),1.23(1H,m,H-1b),1.77(3H,s,H-12),1.18(1H,m,H-5),0.97(3H,s,H-15),0.85(3H,s,H-14),0.84(3H,s,H-13);13C-NMR(500 MHz,CDCl3) δ:132.8(s,C-8),123.8(d,C-7),79.0(d,C-3),60.7(t,C-11),57.0(d,C-9),49.3(t,C-5),38.6(s,C-4),37.8(t,C-1),35.8(s,C-10),28.0(q,C-15),27.2(t,C-2),23.2(t,C-6),15.3(q,C-14),14.9(q,C-13)。以上数据与文献[20-21]报道一致,故鉴定为7-drimene-3,11-diol。
化合物5:白色粉末;分子式C15H26O3,ESIMS m/z:277.2 [M+Na]+。1H-NMR(500 MHz,CDCl3) δ:5.79(1H,brs,H-7),4.26(1H,d,J =12.8 Hz,H-12a),3.97(1H,d,J =12.8 Hz,H-12b),3.84(1H,dd,J =11.0,2.5 Hz,H-11a),3.63(1H,dd,J =10.8,7.2 Hz,H-11b),3.20(1H,dd,J =10.7,5.2 Hz,H-3),2.04(4H,m,H-1a,H-6,H-9),1.63(2H,m,H-2),1.31(1H,m,H-1b),1.24(1H,m,H-5),0.98(3H,s,H-15),0.88(3H,s,H-14),0.84(3H,s,H-13);13C-NMR(500 MHz,CDCl3) δ:138.6(s,C-8),126.4(d,C-7),79.7(d,C-3),66.9(t,C-12),61.3(t,C-11),55.8(d,C-9),50.8(t,C-5),39.9(s,C-4),39.0(t,C-1),36.7(s,C-10),28.8(q,C-15),28.2(t,C-2),24.4(t,C-6),16.0(q,C-14),15.1(q,C-13)。以上数据与文献[21-22]报道一致,故鉴定为7-drimene-3,11,12-triol。
