虎杖苷通过调控Nrf2/HO-1 信号通路减轻大鼠肝脏缺血再灌注损伤
2021-03-09徐志广张朴花
徐志广,张朴花
(南华大学附属南华医院,湖南衡阳 421002)
肝脏缺血再灌注(hepatic ischemia-reperfusion,HIR)是肝脏切除或肝移植手术过程中不可避免的情况,其引起的损伤至今仍是一个重要的医学问题。已有研究表明[1],炎症和氧化应激参与缺血再灌注损伤的发病机制,因此采用抗炎和抗氧化药物治疗HIR 损伤或许是一种有效的治疗策略。虎杖苷是从虎杖根中提取的天然二苯乙烯类化合物,具有抗氧化、抗炎、改善微循环等多种药理活性[2]。研究证实[3],虎杖苷能通过发挥抗氧化和抗炎作用改善多器官的缺血再灌注损伤。然而,虎杖苷是否对HIR 诱导的肝损伤也有改善作用目前报道较少。核因子E2 相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)是一种氧化还原反应性转录因子,是细胞内稳态的主要调节因子,调控一系列抗氧化蛋白表达。此外,Nrf2 还被认为是防治肝病的关键治疗靶点[4]。因此,本研究拟通过干预Nrf2/HO-1 信号通路探讨虎杖苷对HIR诱导的肝损伤的保护作用并初步阐明其作用机制,以期为虎杖苷应用于临床改善HIR 损伤提供理论依据。
1 材料与方法
1.1 动物 无特定病原体(SPF)级雄性SD 大鼠40 只,鼠龄6~7 周,体质量220~250 g,购自湖南昭泰生物医药有限公司,动物许可证编号SYXK(湘)2017-0004。动物饲养条件为分笼饲养,饲养温度为20~23 ℃,相对湿度70%,光照周期12/12 h,自由饮水摄食。
1.2 试剂 虎杖苷(批号P1878,纯度>98%)购自南京春秋生物工程有限公司;Nrf2 抑制剂ML385(批号HY-100523,纯度99.55%)购自美国Med-ChemExpress 公司;大鼠血清谷丙转氨酶(批号SBJ-M0650,alanine aminotransferase,ALT)检测试剂盒和天冬氨酸转氨酶(批号SBJ-M0078,aspartate aminotransferase,AST)检测试剂盒均购自南京森贝伽生物科技有限公司;丙二醛(批号A003-1-1,malondialdehyde,MDA)水平检测试剂盒和超氧化物歧化酶(批号A001-3-2,superoxide dismutase,SOD)活性检测试剂盒均购自南京建成生物工程研究所;肿瘤坏死因子(批号E09-301,tumor necrosis factor-α,TNF-α)、白细胞介素1β(批号E10-01,interleukin-1β,IL-1β)和白细胞介素6(批号E07-1131,interleukin-6,IL-6)ELISA检测试剂盒均购自美国Ebioscience 公司;TUNEL细胞凋亡检测试剂盒(批号C1091)购自上海碧云天生物技术有限公司;兔抗Bcl-2 多克隆抗体(批号GR190314-1)、兔抗Bax 单克隆抗体(批号GR181216-2)、兔抗cleaved caspase-3 多克隆抗体(批号GR190404-1)、兔抗Nrf2 单克隆抗体(批号GR190211-2)、兔抗HO-1 多克隆抗体(批号GR181207-1)、兔抗β-actin 多克隆抗体抗体(批号GR190424-2)和兔抗lamin B1 单克隆抗体(批号GR190307-1)及辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG(批号GR190123-2)均购自英国Abcam 公司。
1.3 造模及分组 将SD 大鼠适应性饲养7 d 后,腹腔注射戊巴比妥(50 mg/kg)进行麻醉,然后进行中线剖腹术,再用血管夹夹持肝脏左侧门静脉支,造成70% 的肝脏缺血,观察到肝正中叶和左侧叶表面颜色由红变灰白,提示缺血成功。缺血45 min 后取夹,再灌注6 h,灌注时之前灰白的肝脏组织颜色变红。完成再灌注后,收集主动脉血液标本,并处死大鼠切除部分肝脏组织进行后续实验。采用随机数字法将40 只SD 大鼠分为5 组(每组8 只)为假手术组、模型组、低剂量虎杖苷组、高剂量虎杖苷组、高剂量虎杖苷联合Nrf2 抑制剂组。假手术组大鼠仅麻醉后开腹,不阻断肝脏血流,其余4 组均建立HIR 模型,并且低剂量虎杖苷组和高剂量虎杖苷组大鼠在造模前连续3 d 分别腹腔注射10、40 mg/kg 虎杖苷,每日1 次;高剂量虎杖苷联合Nrf2 抑制剂组大鼠在高剂量虎杖苷组给药处理方式的基础上再给予腹腔注射30 mg/kg ML385,每日1 次;假手术组和模型组大鼠分别给予等体积生理盐水。
1.4 血清指标检测 将血液样品于4 ℃下5 000×g离心5 min,取血清,采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)分别检测血清ALT 和AST 活性以及血清TNF-α、IL-1β和IL-6 水平。
1.5 肝组织氧化应激指标检测 取肝左叶组织约1 mm3大小,加入适量(1 ∶10)组织蛋白抽提液,冰浴条件下充分碾碎,于4 ℃下12 000×g 离心20 min,取上清液按照试剂盒说明书加入相应试剂,37 ℃孵育10 min,采用酶标仪测定各样品吸光度值,根据标准曲线分别计算肝组织中SOD 活性和MDA 水平。
1.6 肝组织HE 染色 取部分肝左叶组织并置于10%中性福尔马林缓冲液中固定24 h,将固定好的肝组织制成石蜡切片,经二甲苯脱蜡、梯度浓度乙醇复水,苏木精-伊红染色后,中性树胶封片,显微镜下观察组织病理学改变。病理评分方法[5]为在显微镜下选择10 个视野,观察细胞核固缩、空泡形成、细胞质染色消失、细胞核消失、红细胞淤积以及炎性细胞浸润情况,根据病理学改变所占视野百分比计分,0 记0 分,0~10%记1 分,10%~50%记2 分,50%~100%记3 分。对6 项病理改变评分总和进行统计分析。
1.7 肝组织TUNEL 染色 取石蜡切片,经二甲苯脱蜡,浓度梯度乙醇复水,加入蛋白酶K 于室温条件下孵育10 min,PBS 洗涤3 次,加入3% H2O2溶液室温孵育10 min,滴加生物素标记液于37 ℃避光孵育30 min,PBS 洗涤3 次,滴加二氨基联苯胺(diaminobenzidine,DAB)显色液,室温避光孵育15 min,苏木精复染,浓度梯度乙醇脱水,二甲苯透明,中性树脂封片,显微镜下可观察阳性细胞呈棕褐色。于高倍镜下每张切片选择5 个随机视野统计500 个细胞,以阳性细胞数目占统计的总细胞数目百分比表示细胞凋亡率。
1.8 Western Blot 检测相关蛋白表达 将肝组织剪成小块,加入RIPA 裂解液,冰上充分碾磨30 min,12 000×g 离心20 min,取上清液即为所提取蛋白溶液。另取部分肝组织,根据核蛋白提取试剂盒说明书提取组织细胞核蛋白,均采用BCA 法测定蛋白浓度。取30 μg 蛋白沸水浴变性后,进行10%SDS-聚丙烯酰胺凝胶电泳分离蛋白,并将蛋白转移到聚偏二氟乙烯膜上,加入5%的脱脂奶粉室温封闭1 h,1×TBST 洗涤3 次,加入一抗cleaved caspase-3(1 ∶1 000)、Bax(1 ∶1 000)、Bcl-2(1 ∶1 000)、Nrf-2(1 ∶500)、HO-1(1 ∶1 000),β-actin(1 ∶2 000)和lamin B1(1 ∶1 000),置于4 ℃孵育过夜。用1×TBST 洗涤3 次后加入HRP标记的二抗室温孵育1 h,1×TBST 清洗3 次,加入增强化学发光剂ECL 孵育1 min,曝光显影。采用Image J 测定蛋白条带灰度值,以目的蛋白条带灰度值与内参蛋白灰度值的比值表示目的蛋白相对表达量。
1.9 统计学分析 采用SPSS 22.0 分析软件统计分析数据,数据以()表示。多组间比较采用单因素方差分析法进行分析,组间两两比较采用LSD 检验进行分析。 P <0.05 表示差异有统计学意义。
2 结果
2.1 各组大鼠血清ALT、AST 活性及肝组织病理学变化 如表1 所示,与假手术组比较,模型组大鼠血清ALT 和AST 活性均升高(P<0.01);与模型组比较,高剂量虎杖苷组大鼠血清ALT 和AST活性均降低(P<0.01),而低剂量虎杖苷组无明显变化(P>0.05);与高剂量虎杖苷组比较,高剂量虎杖苷联合Nrf2 抑制剂组大鼠血清ALT 和AST 活性又升高(P<0.01)。HE 染色结果(图1)显示,假手术组大鼠肝组织细胞形态正常,无明显充血肿胀,未见炎性细胞浸润;模型组和低剂量虎杖苷组大鼠肝组织内可见大量细胞核固缩,细胞呈空泡样,局部充血肿胀,大量炎性细胞浸润以及肝细胞坏死;与假手术组比较,模型组病理评分升高(P<0.01);与模型组比较,高剂量虎杖苷组大鼠肝组织仅有少量细胞核固缩,局部充血肿胀得到明显缓解,且有少量炎性细胞浸润及细胞坏死,病理评分明显降低(P<0.01);与高剂量虎杖苷组比较,高剂量虎杖苷联合Nrf2 抑制剂组大鼠肝组织又出现大量细胞核固缩和细胞坏死,有大量炎症细胞浸润,病理评分明显升高(P<0.05)。
表1 各组大鼠ALT、AST 活性比较(,n=8)Tab.1 Comparison of ALT and AST activities in rats among various groups(,n=8)
表1 各组大鼠ALT、AST 活性比较(,n=8)Tab.1 Comparison of ALT and AST activities in rats among various groups(,n=8)
注:与假手术组比较,∗∗P<0.01;与模型组比较,##P<0.01;与高剂量虎杖苷组比较,△△P<0.01。
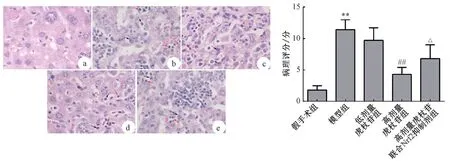
图1 各组大鼠肝组织病理观察(HE 染色,×400)Fig.1 Pathological observation of liver tissues of rats in various groups(HE staining,×400)
2.2 各组大鼠血清炎症因子及肝组织氧化应激水平变化 如表2~3 所示,与假手术组比较,模型组大鼠血清TNF-α、IL-1β 和IL-6 水平以及肝组织MDA 水平均增加(P<0.01),而肝组织SOD 活性降低(P<0.01);与模型组比较,高剂量虎杖苷组大鼠血清TNF-α、IL-1β 和IL-6 水平以及肝组织MDA 水平均降低(P<0.01),肝组织SOD 活性增加(P<0.01),而低剂量虎杖苷组则无明显变化(P>0.05);与高剂量虎杖苷组比较,高剂量虎杖苷联合Nrf2 抑制剂组大鼠血清TNF-α、IL-1β 和IL-6 水平以及肝组织MDA 水平增加(P <0.01),而肝组织SOD 活性降低(P<0.01)。
2.3 各组大鼠肝组织细胞凋亡水平 TUNEL 染色(图2)显示,与假手术组比较,模型组大鼠肝组织细胞凋亡率增加(P<0.01);与模型组比较,高剂量虎杖苷组大鼠肝组织细胞凋亡率降低(P <0.01),而低剂量虎杖苷组无明显变化(P >0.05);与高剂量虎杖苷比较,高剂量虎杖苷联合Nrf2 抑制剂组肝组织细胞凋亡率增加(P<0.01)。Western blot(图3)显示,与假手术组比较,模型组大鼠肝组织Bax、cleaved caspase-3 蛋白表达升高(P<0.01),而Bcl-2 蛋白表达降低(P<0.01);与模型组比较,高剂量虎杖苷组大鼠肝组织Bax、cleaved caspase-3 蛋白表达降低(P<0.01),Bcl-2蛋白表达增加(P<0.01),而低剂量虎杖苷组无明显变化(P>0.05);与高剂量虎杖苷组比较,高剂量虎杖苷联合Nrf2 抑制剂组大鼠肝组织Bax、cleaved caspase-3 蛋白表达增加(P <0.01),而Bcl-2 蛋白表达降低(P<0.01)。
表2 各组大鼠血清炎症因子水平比较(,n=8)Tab.2 Comparison of serum levels of inflammatory factors in rats among various groups(,n=8)

表2 各组大鼠血清炎症因子水平比较(,n=8)Tab.2 Comparison of serum levels of inflammatory factors in rats among various groups(,n=8)
注:与假手术组比较,∗∗P<0.01;与模型组比较,##P<0.01;与高剂量虎杖苷组比较,△△P<0.01。
表3 各组大鼠肝组织氧化应激因子活性水平比较(,n=8)Tab.3 Comparison of levels of liver oxidative stress factors in rats among various groups(,n=8)

表3 各组大鼠肝组织氧化应激因子活性水平比较(,n=8)Tab.3 Comparison of levels of liver oxidative stress factors in rats among various groups(,n=8)
注:与假手术组比较,∗∗P<0.01;与模型组比较,##P<0.01;与高剂量虎杖苷组比较,△△P<0.01。

图2 各组大鼠肝组织细胞凋亡观察(TUNEL 染色,×400)Fig.2 Observation of apoptosis of rat liver tissue cells in various groups(TUNEL staining,×400)
2.4 各组大鼠肝组织Nrf2、HO-1 蛋白表达 如图4 所示,与假手术组比较,模型组大鼠肝组织Nrf2、HO-1 蛋白表达升高(P <0.01);与模型组比较,高剂量虎杖苷组大鼠肝组织Nrf2、HO-1 蛋白表达升高(P<0.01),而低剂量虎杖苷组无明显变化(P>0.05);与高剂量虎杖苷组比较,高剂量虎杖苷联合Nrf2 抑制剂组大鼠肝组织Nrf2、HO-1蛋白表达降低(P<0.05,P<0.01)。
3 讨论
HIR 是影响肝移植和肝切除术后肝功能的一个主要因素[6]。HIR 的发病机制涉及多种因素,包括氧化应激、线粒体损伤、趋化因子的产生等[7]。本研究通过阻断肝血流45 min,再灌注6 h,引起HIR 损伤,结果表现为血清ALT 和AST 活性升高,肝损伤范围从肝窦淤血肿胀到肝细胞坏死。这些结果与先前的研究结果一致[8-9]。表明成功构建了大鼠HIR 模型。
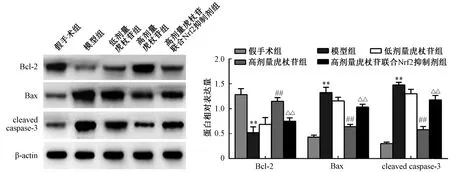
图3 虎杖苷对Bcl-2、Bax、cleaved caspase-3 蛋白表达的影响Fig.3 Effects of polydatin on protein expressions of Bcl-2,Bax and cleaved caspase-3
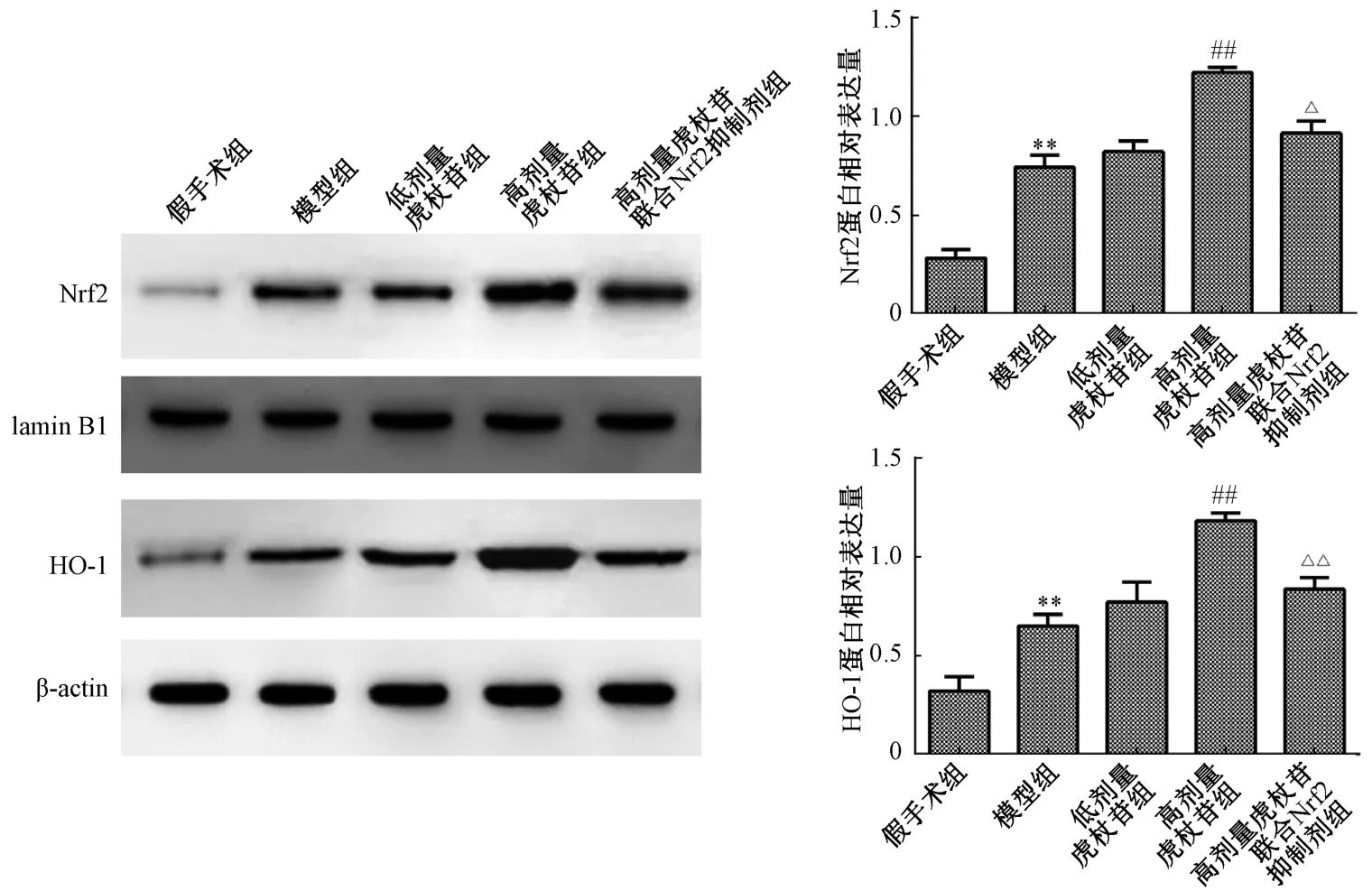
图4 虎杖苷对HIR 大鼠Nrf2/HO-1 信号通路激活的影响Fig.4 Effects of polydatin on activation of Nrf2/HO-1 signaling pathway in HIR injury
虎杖苷作为从中药虎杖根中分离出来的有效活性成分,具有抗氧化和抗炎活性[10]。已有研究提出虎杖苷对肝损伤具有保护作用,通过抑制氧化应激和炎症反应,防治非酒精性脂肪性肝炎和肝纤维化[11-12]。另外,虎杖苷还能通过抑制细胞凋亡改善对乙酰氨基酚药物诱导的肝毒性[13]。这些研究说明,虎杖苷通过抗氧化和抗炎对多种因素引起的肝损伤具有保护作用。另有研究证明虎杖苷对包括心脏,大脑和肾脏在内的多器官缺血再灌注损伤的治疗作用[3]。结合虎杖苷对肝损伤的保护作用,可以假设虎杖苷能改善HIR 诱导的肝损伤。
HIR 损伤主要由再灌注过程中产生的急性活性氧(ROS)诱导,急性ROS 引起氧化应激,导致肝损伤和细胞凋亡。MDA 是脂质过氧化终产物,具有细胞毒性,其水平可以用来评价细胞质膜的受损程度。SOD 存在于所有正常细胞中,对ROS 自由基具有清除作用。在HIR 诱导的肝损伤中,抗氧化标志物SOD 活性明显降低。研究证明氧化应激可以通过坏死或凋亡杀死细胞[14]。本研究中,虎杖苷能降低HIR 大鼠MDA 的水平,增加SOD 活性,间接验证了虎杖苷的抗氧化作用。同时,虎杖苷还能降低炎症因子的表达,抑制细胞凋亡。
Nrf2 是一种多器官保护因子。正常生理条件下,在细胞质中Nrf2 与KEAP1 结合形成复合物,当发生氧化损伤,Nrf2 激活,导致复合物解离,Nrf2 转运到细胞核中并与抗氧化反应原件结合,编码多种抗氧化基因[15]。HO 酶系统在细胞应激过程中发挥关键作用,通过血红素间接发挥抗氧化和抗炎作用。在本研究中,HIR 大鼠肝组织Nrf2 的表达活性增加,这是HIR 引起的氧化应激的适应性反应。在给与高剂量虎杖苷治疗的HIR 大鼠中,加入Nrf2 抑制剂ML385 能明显减弱虎杖苷对HIR大鼠肝损伤的治疗作用,从侧面验证了Nrf2 对HIR 具有保护作用[16]。在HIR 诱导的大鼠中,HO-1 水平的升高伴随着显著的肝损伤,这意味着应激诱导的HO-1 升高不足以保护肝脏免受IR 引起的肝损伤[17]。在本研究中,虎杖苷能增加Nrf2和HO-1 蛋白表达,且加入Nrf2 抑制剂ML385 能降低Nrf2 和HO-1 蛋白表达,说明虎杖苷对HIR 损伤的保护作用可能与Nrf2/HO-1 信号通路的激活有关。
综上所述,虎杖苷通过激活Nrf2/HO-1 信号通路,抑制肝炎症及氧化损伤,有效缓解HIR 诱导的肝损伤。
