垂盆草总黄酮对APAP 诱导小鼠肝损伤的保护作用
2021-03-09蒋志涛潘金火柳春娣
蒋志涛,王 雪,韩 怡,潘金火,柳春娣∗
(1.南京中医药大学附属张家港医院药学部,江苏省研究生工作站,江苏张家港 215600;2.南京中医药大学药学院,江苏南京 210023)
肝脏是人体最大的脏器,对人体的生理功能调节有重大作用,药物滥用、嗜酒以及长期暴露于有毒环境等都会对肝脏造成损伤[1-2]。药物性肝损伤(drug-induced liver injury,DILI)是指药物或其代谢产物引起的肝功能异常或肝脏对药物及代谢产物的超敏反应所致的疾病[3]。药物性肝损伤是常见的严重的药物不良反应之一,重者可致肝硬化、肝癌、急性肝衰竭甚至死亡,其发病率逐年上升,往往是多种机制先后或共同作用的结果,迄今仍缺乏简便、客观、特异的诊断指标和特效治疗手段[4]。大量研究表明,天然药物和中药在治疗肝损伤方面显示出可靠的疗效和较少的不良反应[5]。
垂盆草为景天科景天属植物垂盆草Sedum sarmentosum Bunge 的干燥全草,最早在清代赵学敏的《本草纲目拾遗》 中有相关记载,收载于历版《中国药典》,具有极高的药用价值[6]。垂盆草总黄酮是垂盆草的主要活性部位之一,具有保肝降酶、抗肿瘤、抗氧化等功效[7]。相关研究表明,垂盆草总黄酮对于肝纤维化的治疗具有明确疗效,但垂盆草总黄酮抗药物性肝损伤的药理作用尚未见报道。因此本实验通过建立对乙酰氨基酚诱导的小鼠药物性肝损伤模型,研究垂盆草总黄酮对药物性肝损伤小鼠肝脏的保护作用。
1 材料
1.1 仪器 TD6001 电子天平(天津市天马仪器厂);FA1004 电子分析天平(上海舜宇恒平科学仪器有限公司);SPECTRAMAX190 酶标仪[美谷分子仪器(上海)有限公司];HH-2 数显恒温水浴锅(江苏常州国华电器有限公司);ZD-9556 水平摇床(太仓市华利达实验设备有限公司);DHG-9023A 型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);HX11L-120 立式压力蒸汽灭菌器(上海华线医用核子仪器有限公司);LE438-2M PH 计[梅特勒-托利多仪器(上海)有限公司];85-2 磁力搅拌器(江苏省金坛市荣华仪器制造有限公司);DYY-6C 型电泳仪电源(北京市六一仪器厂);XHF-D 高速分散器(宁波新芝生物科技股份有限公司);Allegra X-30R 冷冻离心机(美国贝克曼库尔特有限公司);3D HISTECH Pannoramic 250 扫描仪(匈牙利Hungary 公司);5300 凝胶成像系统(上海天能科技有限公司);ATC 3000 RTPCR 仪(枫岭国际有限公司);Nano-100 微量分光光度计(杭州奥盛仪器有限公司)。
1.2 试剂 谷草转氨酶(AST)批号为20171220、谷丙转氨酶(ALT)批号为20171219、乳酸脱氢酶(LDH)批号为20171229、微量还原型谷胱甘肽(GSH)批号为20180116、碱性磷酸酶(ALP)批号为20180105、总胆红素(TBIL)批号为20180104、过氧化氢酶(CAT)批号为20180105、总超氧化物歧化酶(SOD)批号为20180104、谷胱甘肽过氧化物酶(GSH-PX)批号为20180103、丙二醛(MDA)批号为20180104、白介素6(IL-6,Cat.#SU-B20818)、白介素1β(IL-1β,Cat.#SU-B20174)、肿瘤坏死因子α(TNF-α,Cat.#SU-B20852)试剂盒,以上均购自南京建成生物工程研究所;联苯双酯滴丸(北京协和药厂,批号170609);对乙酰氨基酚(acetaminophen,APAP)原料药(武汉贝尔卡生物医药有限公司,批号205254);兔抗鼠Nrf2、HO-1 多克隆抗体及GAPDH 一抗购自美国Abcam 公司,批号分别为GR208500-1、GR374701-4、GR148385-1;山羊抗兔二抗和GAPDH 二抗购自美国proteintech 公司,批号分别为00029255、00 054396;PCR 预混合MIX [天根生化科技(北京)有限公司,批号N2728];氯仿(成都市科龙化工试剂厂,批号2016110501);异丙醇(成都市科龙化工试剂厂,批号2016122201);Thermo Scientific Revert Aid First cDNA Synthesis Kit [赛默飞世尔科技(中国)有限公司,批号00306196];SYBR® Premix Ex TaqTM(Tli RNaseH Plus)(大连宝万生物科技有限公司,批号A650 t-1)。垂盆草药材购于安徽省万生中药饮片有限公司,批号161101,经张家港市中医医院药学部余辉主任中药师鉴定为景天科植物垂盆草Sedum sarmentosum Bunge 的干燥全草。垂盆草总黄酮粉末(自制,由张家港市中医医院制剂室制备,批号20180106。制备方法为取适量垂盆草药材,加8 倍量的80%乙醇回流提取2 次,将提取液减压浓缩后经石油醚脱脂,调节药液浓度以及pH,再经大孔树脂和聚酰胺纯化得到。采用紫外分光光度计进行测定,计算得到垂盆草总黄酮的纯度约为60%);通用型组织固定液(武汉谷歌生物科技有限公司,批号172012)。
1.3 动物 SPF 级雄性ICR 小鼠48 只,体质量18~22 g,购于南京市江宁区青龙山动物繁殖场,实验动物生产许可证号SCXK(苏)2017-0001;饲养于南京中医药大学实验动物中心,实验动物使用许可证号SYXK(苏)2018-0049。所有小鼠均在室温21~26 ℃,湿度45%~70%的环境中饲养,自由饮水与进食。
2 方法
2.1 药液制备 称取垂盆草总黄酮粉末,加0.5% CMC-Na 溶液配制成质量浓度分别为15、30、60 mg/mL 的垂盆草总黄酮混悬液。将联苯双酯滴丸研磨成粉末,溶于0.5% CMC-Na 溶液,配制20 mg/mL的溶液。将APAP 溶于生理盐水,于60 ℃水浴锅加热溶解配成30 mg/mL 的溶液备用。
2.2 分组及给药 ICR 小鼠适应性饲养7 d 后随机分为6 组,每组8 只,分别为正常组、模型组、阳性药物组(联苯双酯200 mg/kg)、垂盆草总黄酮低剂量组(150 mg/kg)、垂盆草总黄酮中剂量组(300 mg/kg)、垂盆草总黄酮高剂量组(600 mg/kg)。正常组和模型组灌胃10 mL/kg 的0.5% CMC-Na 溶液,其余各组灌胃等容量的相应药物,每天1 次,连续灌胃7 d,末次灌胃1 h 后,除正常组腹腔注射10 mL/kg 的生理盐水外,其余各组均腹腔注射300 mg/kg 的APAP 溶液建立小鼠药物性肝损伤模型,造模后,各组小鼠均禁食不禁水。
2.3 标本采集 APAP 造模24 h 后,将小鼠摘眼球取血,室温静置1~2 h,3 000 r/min,4 ℃,离心10 min,制备血清,保存于-80 ℃冰箱中。处死小鼠,取出肝脏进行称定质量、观察,计算肝脏指数,同时依照不同需要将样本保存于相应的环境下,取肝右叶同一部位肝组织置于4%多聚甲醛中固定,用于肝组织病理检测;用于组织匀浆、实时荧光定量PCR(RT-PCR)、蛋白质印迹(WB)法检测的标本保存于-80 ℃冰箱中。
2.4 指标检测
2.4.1 肝脏指数 称定小鼠体质量及肝脏质量,计算肝脏指数,肝脏指数=(肝脏质量/体质量)×100%。
2.4.2 血清ALT、AST、ALP、TBIL、LDH 水平严格按照试剂盒说明书操作步骤检测。
2.4.3 肝组织匀浆指标
2.4.3.1 MDA、SOD、GSH、CAT、GSH-PX 水平严格按照试剂盒操作说明书处理样本、进行预实验和样本稀释,利用BCA 蛋白测试盒测定10%肝匀浆蛋白浓度,根据试剂盒操作步骤进行实验,并根据BCA 蛋白试剂盒所测蛋白浓度计算MDA、GSH、CAT、SOD、GSH-PX 水平。
2.4.3.2 IL-1β、IL-6、TNF-α 水平 按照相应ELISA 试剂盒说明书操作步骤处理肝组织样本,测定组织中IL-1β、IL-6、TNF-α 水平。
2.4.4 肝组织病理 取4% 多聚甲醛溶液固定的肝组织,依次脱水,浸蜡、石蜡包埋、切片、HE染色,用扫描仪扫描后观察肝组织结构。
2.4.5 Real-Time PCR 检测肝组织Nrf2、 HO-1 mRNA 表达 取50 mg 肝组织,采用Trizol 法提取肝组织的RNA,使用Thermo Scientific Revert Aid First cDNA Synthesis Kit-逆转试剂盒,按照说明书进行反转录,随后按照RR420 A-takara SYBR®Premix Ex TaqTM(Tli RNaseH Plus)试剂盒说明书进行实验,结果采用2-ΔΔCt进行计算。
2.4.6 Western blot 检测 Nrf2、HO-1 蛋白表达 精密称取一小块肝组织,加入预冷的玻璃研磨器中,按照样本质量∶裂解液体积=100 mg ∶1 mL的比例加入预冷的含有PMSF 及磷酸酶抑制剂的裂解液,充分研磨提取总蛋白,用BCA 法定量。检测浓度之后各组取等量蛋白提取液,进行SDSPAGE 凝胶电泳实验对蛋白进行分离,电泳完成后,按照预染蛋白Marker 所显示的位置,切取目的蛋白,使用天能标准湿式转膜装置在冰浴中将电泳产物转移至聚偏二氟乙烯(PVDF)膜上,取膜并用脱脂奶粉封闭后,将PVDF 膜在一抗中4 ℃孵育过夜,洗膜后加入相应二抗37 ℃孵育1 h,将孵育二抗并清洗完毕的PVDF 膜置于凝胶成像系统内,ECL 发光,运行凝胶成像系统进行曝光。
2.5 统计学分析 实验数据用SPSS 22.0 软件进行统计分析,数据以()表示,组间比较采用单因素方差分析(One-Way ANOVA),两两比较采用t 检验,以P <0.05 为差异具有统计学意义。Western blot 检测结果用Image J 软件进行分析,计算目的蛋白条带和GAPDH 的灰度值比值,计算出相对值后导入Graphpad 软件进一步统计分析[8-9]。
3 结果
3.1 垂盆草总黄酮对肝脏指数的影响 如表1 所示,与正常组比较,模型组小鼠给予300 mg/kg APAP 造模后小鼠肝脏指数增加(P<0.01)。与模型组比较,垂盆草总黄酮高、中、低剂量组和阳性药物组均可使肝脏指数下降(P <0.05,P <0.01)。
表1 垂盆草总黄酮对APAP 致急性肝损伤小鼠肝脏指数的影响(,n=8)Tab.1 Effects of S.sarmentosum total flavonoids on liver indices of mice with APAP-induced acute liver injury(,n=8)
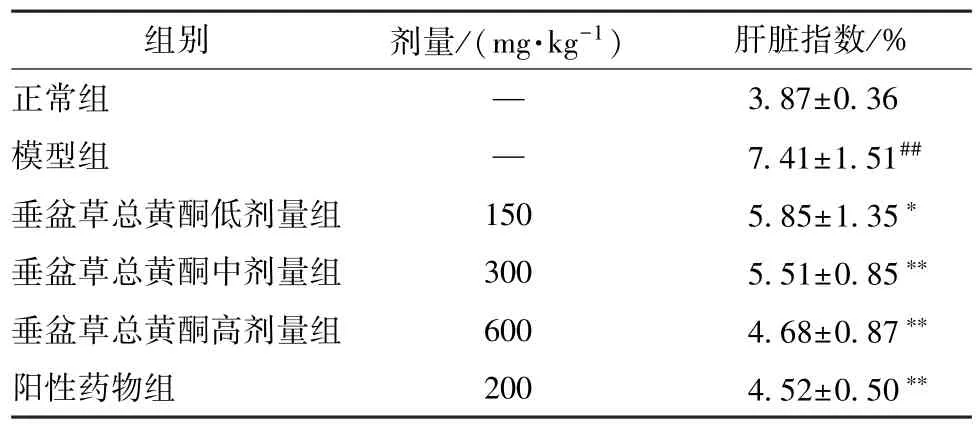
表1 垂盆草总黄酮对APAP 致急性肝损伤小鼠肝脏指数的影响(,n=8)Tab.1 Effects of S.sarmentosum total flavonoids on liver indices of mice with APAP-induced acute liver injury(,n=8)
注:与正常组比较,## P <0.01;与模型组比较,∗P <0.05,∗∗P<0.01。
3.2 垂盆草总黄酮对血清ALT、AST、ALP、LDH、TBIL 水平的影响 如表2 所示,与正常组比较,模型组在APAP 造模24 h 后血清中ALT、AST、ALP、LDH、TBIL 水平增加(P<0.01),表明小鼠药物性肝损伤模型复制成功。与模型组比较,垂盆草总黄酮高、中、低剂量组和阳性药物组能降低ALT、AST、ALP、TBIL 水平(P <0.05,P<0.01);与模型组比较,垂盆草总黄酮高、中剂量组和阳性药物组均能降低LDH 水平(P<0.05,P<0.01),垂盆草总黄酮低剂量组的LDH 水平也降低,但差异无统计学意义(P>0.05)。
表2 垂盆草总黄酮对APAP 诱导肝损伤小鼠血清ALT、AST、ALP、LDH、TBIL 水平的影响(,n=8)Tab.2 Effects of S.sarmentosum total flavonoids on serum ALT,AST,ALP,LDH and TBIL levels in mice with APAP-induced acute liver injury(,n=8)

表2 垂盆草总黄酮对APAP 诱导肝损伤小鼠血清ALT、AST、ALP、LDH、TBIL 水平的影响(,n=8)Tab.2 Effects of S.sarmentosum total flavonoids on serum ALT,AST,ALP,LDH and TBIL levels in mice with APAP-induced acute liver injury(,n=8)
注:与正常组比较,##P<0.01;与模型组比较,∗P<0.05,∗∗P<0.01。
3.3 肝组织匀浆
3.3.1 MDA、SOD、GSH、CAT、GSH-PX 水平 如表3 所示,与正常组比较,模型组小鼠给予APAP 造模24 h 后,小鼠肝组织MDA 水平增加(P<0.01);与模型组比较,垂盆草总黄酮高、中、低剂量组和阳性药物组的MDA 水平降低(P <0.05,P<0.01)。与正常组比较,模型组小鼠肝组织SOD、GSH、GSH-PX 和CAT 水平降低(P <0.01);与模型组比较,垂盆草总黄酮高、中、低剂量组和阳性药物组小鼠肝组织SOD、GSH、GSH-PX 和CAT 水平升高(P<0.05,P<0.01)。
3.3.2 IL-1β、IL-6、TNF-α 水平 如表4 所示,与正常组比较,模型组小鼠肝组织IL-1β、IL-6、TNF-α 水平升高(P<0.01);与模型组比较,垂盆草总黄酮高、中、低剂量组和阳性药物组小鼠肝组织IL-1β、TNF-α 水平降低(P<0.05,P<0.01);与模型组比较,垂盆草总黄酮高、中剂量组和阳性药物组小鼠肝组织IL-6 水平降低(P<0.01),垂盆草总黄酮低剂量组IL-6 水平与模型组比较差异无统计学意义(P>0.05)。
表3 垂盆草总黄酮对APAP 诱导肝损伤小鼠肝组织MDA、SOD、CAT、GSH、GSH-PX 水平的影响(,n=8)Tab.3 Effects of S.sarmentosum total flavonoids on MDA,SOD,CAT,GSH and GSH-PX levels in liver tissue of mice with APAP-induced acute liver injury(,n=8)

表3 垂盆草总黄酮对APAP 诱导肝损伤小鼠肝组织MDA、SOD、CAT、GSH、GSH-PX 水平的影响(,n=8)Tab.3 Effects of S.sarmentosum total flavonoids on MDA,SOD,CAT,GSH and GSH-PX levels in liver tissue of mice with APAP-induced acute liver injury(,n=8)
注:与正常组比较,##P<0.01;与模型组比较,∗P<0.05,∗∗P<0.01。
表4 垂盆草总黄酮对APAP 诱导肝损伤小鼠肝组织IL-1β、IL-6、TNF-α 水平的影响(,n=8)Tab.4 Effects of S.sarmentosum total flavonoids on IL-1β,IL-6 and TNF-α levels in liver tissue of mice with APAP-induced acute liver injury(,n=8)

表4 垂盆草总黄酮对APAP 诱导肝损伤小鼠肝组织IL-1β、IL-6、TNF-α 水平的影响(,n=8)Tab.4 Effects of S.sarmentosum total flavonoids on IL-1β,IL-6 and TNF-α levels in liver tissue of mice with APAP-induced acute liver injury(,n=8)
注:与正常组比较,##P<0.01;与模型组比较,∗P<0.05,∗∗P<0.01。
3.4 肝组织病理检测 如图1 所示,正常组小鼠肝小叶结构清晰,肝板排列整齐,肝细胞胞质丰富、形态结构正常,肝细胞未见明显的变性、坏死,未见炎细胞浸润。模型组肝细胞结构紊乱,组织中多见肝细胞水肿,胞质疏松淡染,可见炎症细胞浸润和肝细胞局灶性坏死,核固缩深染,胞质中可见较小的圆形空泡;相比于模型组,阳性药物组和垂盆草总黄酮高、中、低剂量给药组肝脏细胞组织都有所恢复,肝脏结构较清楚,少量细胞点状坏死,肝细胞水肿明显减轻,仍见少量炎症细胞浸润。垂盆草总黄酮高剂量与联苯双酯组比较,无明显差异,说明垂盆草总黄酮能显著改善小鼠肝细胞变性和坏死。

图1 垂盆草总黄酮对APAP 所致药物性肝损伤小鼠肝脏组织学的影响(×20)Fig.1 Effects of S.sarmentosum total flavonoids on liver histology of mice with APAP-induced acute liver injury(×20)
3.5 垂盆草总黄酮对小鼠肝组织Nrf2、 HO-1 mRNA 表达的影响 如图2 所示,与正常组比较,模型组小鼠肝组织Nrf2、 HO-1mRNA 表达下降(P<0.01);与模型组比较,阳性药物组和垂盆草总黄酮高、中、低剂量组Nrf2、 HO-1 mRNA 水平均增加(P<0.05,P<0.01)。

图2 垂盆草总黄酮对APAP 诱导药物性肝损伤小鼠Nrf2、 HO-1 mRNA 的影响(,n=8)Fig.2 Effects of S.sarmentosum total flavonoids on the expressions of Nrf2 and HO-1 mRNA in mice with APAP-induced liver injury(,n=8)
3.6 垂盆草总黄酮对小鼠肝组织Nrf2、HO-1 蛋白表达的影响 如图3 所示,与正常组比较,APAP模型组小鼠肝组织Nrf2、HO-1 蛋白表达降低(P<0.01);与模型组比较,阳性药物组和垂盆草总黄酮高、中、低剂量组均能使Nrf2、HO-1 蛋白表达增加(P<0.01)。
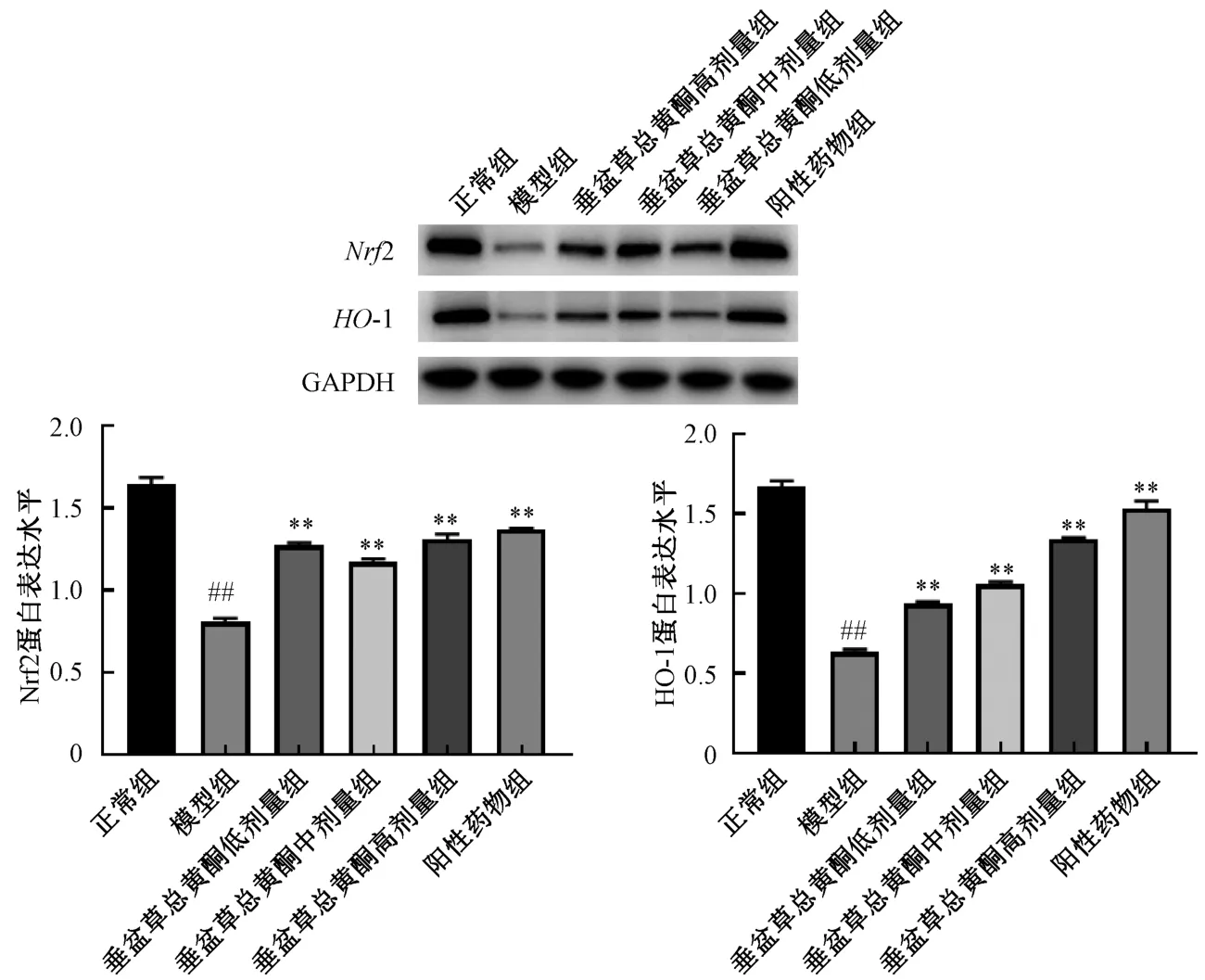
图3 垂盆草总黄酮对APAP 诱导药物性肝损伤小鼠Nrf2、HO-1 蛋白表达的影响(,n=8)Fig.3 Effects of S.sarmentosum total flavonoids on the expressions of Nrf2 and HO-1 protein in mice with APAP-induced liver injury(,n=8)
4 讨论
APAP 是临床使用广泛的解热镇痛药,是导致药物性肝损伤的常见药物[10]。APAP 诱导的小鼠药物性肝损伤模型造模时间短,易复制,稳定性好,是筛选保肝药物的理想模型[5]。在相关文献报道中,多数腹腔注射300 mg/kg APAP 造药物性肝损伤模型,所以在前期预实验中对APAP 的造模剂量进行了考察。分别考察了200、300、400 mg/kg APAP 腹腔注射的造模效果。实验中发现,200 mg/kg APAP 腹腔注射后,小鼠血清中ALT、AST 增加不明显,多数小鼠未造成肝损伤;400 mg/kgAPAP 腹腔注射后,有少量小鼠死亡;300 mg/kg APAP 腹腔注射后,小鼠血清中ALT、AST 水平增加,肝组织结构被破坏,小鼠无死亡。因此正式实验时选择腹腔注射300 mg/kg APAP 进行造模。
垂盆草总黄酮是垂盆草的有效部位之一,具有保肝降酶的作用。本研究发现,小鼠分别灌胃不同剂量的垂盆草总黄酮可以降低APAP 引起的小鼠血清中ALT、AST、ALP、LDH、TBIL 水平的增加,降低肝脏指数,显著改善肝组织病变,这表明垂盆草总黄酮对APAP 导致的药物性肝损伤具有显著保护作用。此外垂盆草总黄酮预处理能增加SOD 活性、GSH 水平以及CAT 水平,且降低肝组织MDA、IL-1β、IL-6、TNF-α 水平。MDA 是氧化损伤的一个特殊标志物,其水平的多少可直接反应脂质过氧化的程度,间接反应自由基对细胞的损伤程度[11]。SOD 能够清除细胞内高浓度的超氧阴离子自由基,GSH 是体内重要的抗氧化剂和自由基清除剂,可把细胞内有害物转化为无害物并排出[12]。IL-1β、IL-6、TNF-α 等炎症因子在急性组织损伤的炎症过程中扮演着重要角色[13]。综上,该研究表明垂盆草总黄酮对APAP 肝损伤的保护作用与抑制肝组织的氧化损伤和炎症反应有关。
核因子E2 相关因子2(Nrf2)是参与调节机体天然抗氧化应激防御系统的主要调控因子[14]。HO-1 是机体和细胞内重要的抗氧化应激酶,其表达受Nrf2 的调控[15]。Nrf2/HO-1 通路在药物介导的肝损伤中发挥重要作用,是机体最重要的抗氧化应激机制之一。本研究表明,APAP 诱导药物性肝损伤后,肝组织Nrf2、HO-1 表达水平被显著抑制,垂盆草总黄酮预防性给药组,肝组织Nrf2、HO-1蛋白表达增加,表明Nrf2/HO-1 通路被激活以对抗APAP 产生的肝细胞毒性。
综上所述,垂盆草总黄酮对APAP 所致药物性肝损伤具有一定的保护作用,其机制可能是抑制肝组织的氧化损伤和炎症反应,从而起到保护肝脏的作用,详细机制还需进一步研究。
