运用高通量测序技术分析人参不同栽培模式根际土壤微生物多样性1)
2021-03-09卢宝慧高成林赵玥刘晨阳杨鹤
卢宝慧 高成林 赵玥 刘晨阳 杨鹤
(吉林农业大学,长春,130118) (人参新品种选育与开发国家地方联合工程研究中心(吉林农业大学))
唐玲玲 许永华
(吉林省电力医院) (人参新品种选育与开发国家地方联合工程研究中心(吉林农业大学))
人参(PanaxginsengC. A. Mey.)为五加科多年生草本植物,按照其生长环境可为分为栽培人参和野山参,栽培人参可以分为林下护育人参、采伐基地栽培人参和农田栽培人参。野山参经过开放式采挖已濒临灭绝,而林下护育作为仿生栽培模式,该模式栽培的人参与野山参外形相似,有效成分相近[1],品质优于其他两种栽培模式人参。采伐迹地栽培人参是利用采伐后不久而尚未长起新林的土地栽培的人参,这种方式栽培的人参病害较少,参根的质量较好,产量也偏高。由于该模式需要伐林后栽培,可利用的土地资源较少。因此,农田栽培人参是我国目前主要的栽培模式。农田模式主要是对农田土壤改良后进行人参栽培。农田栽参土壤改良方法是近年来的研究重点[2-5]。但是,由于各人参栽培地区的土壤性质不同,加上人参的连作障碍的影响[6],尤其是老参地土壤,土壤改良效果并不理想。土壤微生物是土壤生态系统中最活跃的成分[7],可通过微生物活动改善土壤理化性质、调节土壤营养[8-11]。同时,土壤微生物直接参与物质的循环代谢,间接影响植物生长发育。植物根际微生物多样性在缓解干旱和盐碱胁迫对植物生理的影响起着重要作用[12-13]。本研究尝试采用高通量测序技术,对林下护育、采伐迹地栽培和农田栽培的人参根际土壤中细菌和真菌的多样性进行研究,分析不同栽培模式的人参根际土壤微生物群落结构和分布差异,找到林下护育和采伐迹地栽培模式的优势微生物种群分布,为农田栽参土壤微生物群落定向改良提供理论支撑。
1 材料和方法
1.1 样品采集
2018年6月,对集安市3种人参栽培模式(林下护育、采伐迹地栽培和农田栽培)进行土样采集。集安地区主要为红松(Pinuskoraiensis)、柞树(Quercusmongolica)、杨树(PopulusL.)为主的针阔混交林,林龄15~30 a。林下护育模式,采用仿生手段,参籽漫撒林间,人参生长期间不进行人工干预。采伐迹地栽培模式,林木采伐后将树根刨出,深翻后构建参床,移栽人参,参床上搭拱棚,覆遮阳网和蓝色参膜,人参生长期间随季节喷施多抗霉素、多菌灵等杀菌剂,若有虫害或烂根,将腐烂人参起出后,参床表面小面积淋撒生石灰消毒。农田栽培人参,前茬为玉米,停耕后深翻,利用威百亩进行土壤熏蒸消毒,待土壤中消杀成分挥发或分解完毕后起参床,进行人参播种或移栽,田间处理方式同采伐迹地栽培模式。
林下护育模式采样点(JA.1):海拔为589 m,地理坐标为(41°7′51″N,126°5′36″E)。
采伐迹地栽培模式采样点(JA.2):海拔为567 m,地理坐标为(41°8′30″N,125°47′25″E)。
农田栽培模式采样点(JA.3):海拔为553 m,地理坐标为(40°53′57″N,125°13′56″E)。
各采样点的土壤为棕壤,土壤中性或微酸性,土壤矿物风化度不高,盐基接近饱和;气候条件为半大陆海洋季风气候,年降水量在400~800 mm,无霜期150 d左右。样品采集时,避免降水天气,土壤处于自然干燥状态。在每个地点用取土器采集人参耕层根际土壤各5份,过10目筛。除去石头、虫体、草枝等杂物后,多点土壤样品充分混合,采用四分法留取土样。处理后的样品立刻用液氮处理,随即使用干冰保存,运输至实验室,-80 ℃冷冻保存,用于土壤微生物多样性分析。
1.2 试验方法与数据处理
实验材料委托北京诺禾致源科技股份有限公司进行高通量测序。采用Usearch(V7.1)软件进行数据处理,物种比对注释使用RDP classifier软件,保留置信区间大于0.8的注释结果。利用Mothur软件在各分类水平上进行群落结构的统计分析。使用Qiime软件(Version 1.9.1)计算可观测物种数(Observed-otus)、Chao1指数、ACE指数、香农-威纳(Shannon)指数、辛普森(Simpson)指数),用以进行样本复杂度分析,即阿尔法(Alpha)多样性分析使用R软件(Version 2.15.3)绘制稀释曲线和等级聚类(Rank abundance)曲线。计算样本间距离并使用不加权类平均法(UPGMA)构建样本聚类树,以分析样本间差异,即贝塔(Beta)多样性分析。样本间距离是衡量样本间的相异系数,其值越小,表示这两个样本在物种多样性方面存在的差异越小。使用IBM SPSS Statistics 24.0软件,在P<0.05水平上分析数据差异性。
试验中PCR扩增通用引物为:
(1)细菌V3+V4区域引物包括上游引物5′-CCTAYGGGRBGCASCAG-3′和下游引物5′-GGACTACNNGGGTATCTAAT-3′;
(2)真菌ITS2区域引物包括上游引物5′-GCATCGATGAAGAACGCAGC-3′和下游引物5′-TCCTCCGCTTATTGATATGC-3′。
2 结果与分析
2.1 人参根际土壤OTU聚类分析及稀释曲线
为研究各样本的物种组成,对所有样本的有效序列以97%的一致性进行OTUs聚类,然后对OTUs的代表序列进行物种注释,每个分类单元即为一个OTU。由表1可知,3种栽培模式(林下护育、采伐迹地栽培和农田栽培)土壤样品经高通量测序后,分别得到总DNA的16S rRNA 83 418、74 552、56 105条优质序列,经质控、拼接后得到有效序列78 333、70 790、53 549条。平均长度分别为422、417和416 bp,与16S rRNA V3+V4区序列长度大致吻合,97%的相似水平下聚类分析得到1 965个OTUs。真菌ITS rDNA分别得到优质序列61 525、62 766、85 791条,有效序列58 541、60 653、81 932条。平均长度分别为303、306、303 bp,97%的相似水平下聚类分析得到468个OTUs。
由图1、图2可知,OTU数目随着测序数量的增加而增加,曲线呈逐渐上升后趋于平缓的趋势。在测序序列>30 000时,细菌、真菌曲线均进入饱和状态,即测序量足以覆盖土壤样品的细菌、真菌类群。本研究测序数据量合理,可具体反映样品中微生物群落的种类和结构等信息。
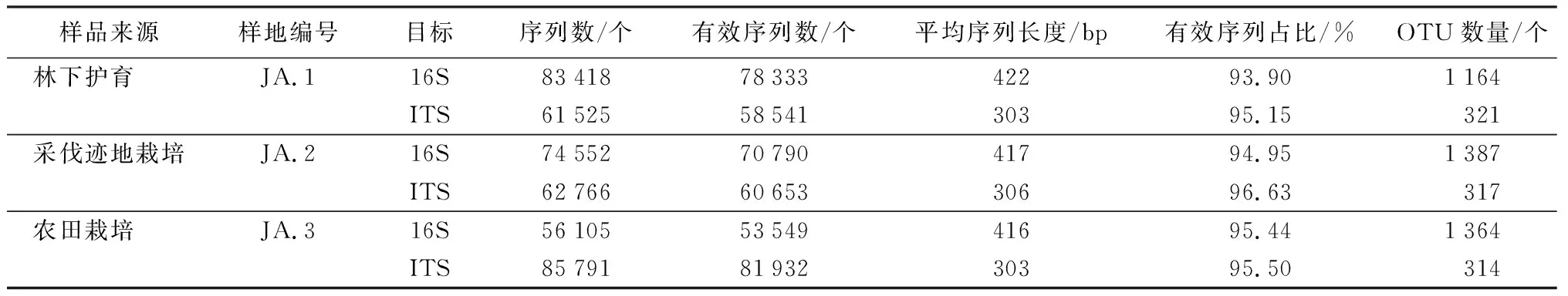
表1 人参根际土壤样品测序的tags信息及OTU统计分析

图1 人参根际土壤样品细菌测序的稀释曲线
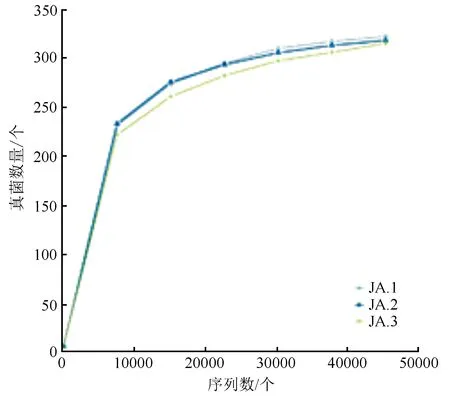
图2 人参根际土壤样品真菌测序的稀释曲线
2.2 人参根际土壤中细菌、真菌群落在纲水平上的分布情况
由表2可知,人参根际土壤中细菌主要分布于以下10个纲:γ-变形菌纲(Gammaproteobacteria)、α-变形菌纲(Alphaproteobacteria)、酸性细菌纲(Acidobacteriia)、芽单胞菌纲(unidentified_Gemmatimonadetes)、芽孢杆菌纲(Bacilli)、放线菌纲(unidentified_Actinobacteria)、拟杆菌纲(Bacteroidia)、嗜热油菌纲(Thermoleophilia)、酸杆菌纲(unidentified_Acidobacteria)、酸微菌纲(Acidimicrobiia),其中γ-变形菌纲细菌最为丰富,在3个土样中相对丰度分别为0.45、0.15、0.17,其次是α-变形菌纲,在3个土样中相对丰度分别为0.15、0.24、0.25。采伐迹地栽培和农田栽培人参土样中主要细菌类群比较接近,与林下护育人参土样差异较大。尤其是酸性细菌纲、芽单胞菌纲和芽孢杆菌纲。在林下护育人参土样中,酸性细菌纲和芽单胞菌纲几乎未能检测到,而在采伐迹地栽培人参土样和农田栽培人参土样则含量较高。芽孢杆菌纲在林下护育人参土样中的相对丰度高达0.09,在农田栽培人参土样中的相对丰度只有0.02,在采伐迹地栽培人参土样中几乎检测不到。

表2 人参根际土壤样品细菌群落分布表
由表3可知,真菌主要分布于以下10个纲:粪壳菌纲(Sordariomycetes)、座囊菌纲(Dothideomycetes)、伞菌纲(Agaricomycetes)、锤舌菌纲(Leotiomycetes)、散囊菌纲(Eurotiomycetes)、Pezizomycotina_cls_Incertae_sedis1、毛霉纲(Mucoromycetes)、盘菌纲(Pezizomycetes)、银耳纲(Tremellomycetes)、被孢霉纲(Mortierellomycetes)。不同栽培方式人参根际土样中真菌菌群差异较小,粪壳菌纲为优势真菌菌群,在3种人参土样中分别占65.49%、68.47%和48.58%,其次为座囊菌纲,分别占14.81%、3.84%和11.88%。其余真菌菌群在3个土样中相对丰度大于1的只有锤舌菌纲,分别为2.70%、2.25%和1.87%。此外采伐迹地栽培人参根际土壤中伞菌纲占4.89%,而其他两种栽培模式中伞菌纲相对丰度不足0.5%;散囊菌纲在林下护育和农田栽培模式下分别有2.14%和1.80%,在采伐迹地栽培模式中不足1%。

表3 人参根际土壤样品真菌群落分布表
2.3 人参根际土壤微生物群落结构属水平上的相对分布
由图3可知,细菌群落中假单胞杆菌属(Pseudomonas)、类芽孢杆菌(Paenibacillus)、芽孢杆菌属(Bacillus)等在林下护育模式土壤中有较高丰度。不动杆菌属(Acinetobacter)、鞘脂单胞菌属(Sphingomonas)和苔藓杆菌属(Bryobacter)等在采伐迹地栽培模式土壤中有较高丰度。芽单胞菌属(Gemmatimonas)、溶杆菌属(Lysobacter)、黄色土源菌属(Flavisolibacter)等在农田栽培模式土壤中相对丰度大于其他菌属。此外,林下护育模式和采伐迹地栽培模式中链霉菌属(Streptomyces)和伯克氏菌属(unidentified_Burkholderiaceae)相对丰度较高,而农田栽培模式土壤中却极少。

图3 人参根际土壤样品细菌群落聚类热图
由图4可知,真菌群落中相对丰度较高的真菌营养方式多为腐生,且粪生菌在各栽培模式中占均有较大比重。而不同栽培模式中优势真菌菌属种类数目略有不同,如林下护育模式土壤中葡萄孢属(Botrytis)、毛壳菌属(Chaetomium);采伐迹地栽培模式土壤中茎点霉属(Phoma)、木霉属(Trichoderma);农田栽培模式土壤中镰孢菌属(Fusarium)、柱孢霉属(Cylindrocarpon)、分枝孢子霉属(Cladosporium)、毁丝霉属(Myceliophthora)等,以上菌属相对丰度均大于同种栽培模式下其他种类菌属。

图4 人参根际土壤样品真菌群落聚类热图
2.4 人参根际土壤微生物多样性分析
2.4.1 阿尔法(Alpha)多样性分析
由表4可知,3种栽培模式土样的细菌和真菌群落多样性均具有较高丰富度。土样中细菌多样性Chao1指数平均值由大到小的顺序为农田栽培、采伐迹地栽培、林下护育;香浓指数由大到小的顺序为采伐迹地栽培、农田栽培、林下护育。说明细菌丰富度由大到小的顺序为农田栽培、采伐迹地栽培、林下护育;细菌多样性由大到小的顺序采伐迹地栽培、农田栽培、林下护育。

表4 人参根际土壤样品根际土壤群落多样性指数
由表5可知真菌群落多样性Chao1指数由大到小的顺序为农田栽培、林下护育、采伐迹地栽培;香浓指数由大到小的顺序为林下护育、农田栽培、采伐迹地栽培。即真菌丰富度由大到小的顺序为农田栽培、林下护育、采伐迹地栽培;真菌多样性由大到小的顺序为林下护育、农田栽培、采伐迹地栽培。

表5 人参根际土壤样品根际土壤群落多样性指数
2.4.2 贝塔(Beta)多样性分析
基于距离算法得到的3种土样距离矩阵热图(图5、图6),结合人参根际土壤样品门水平树状聚类图(图7、图8)可知,采伐迹地栽培和农田栽参模式,人参根际土壤中细菌群落多样性有较高相似度;人参林下护育栽培和采伐迹地栽培模式,人参根际土壤真菌群落多样性具有较高的相似度。林下护育模式和农田栽培模式的细菌和真菌群落多样性相似度均处于较低的水平。

图5 人参根际土壤样品距离矩阵图(细菌)
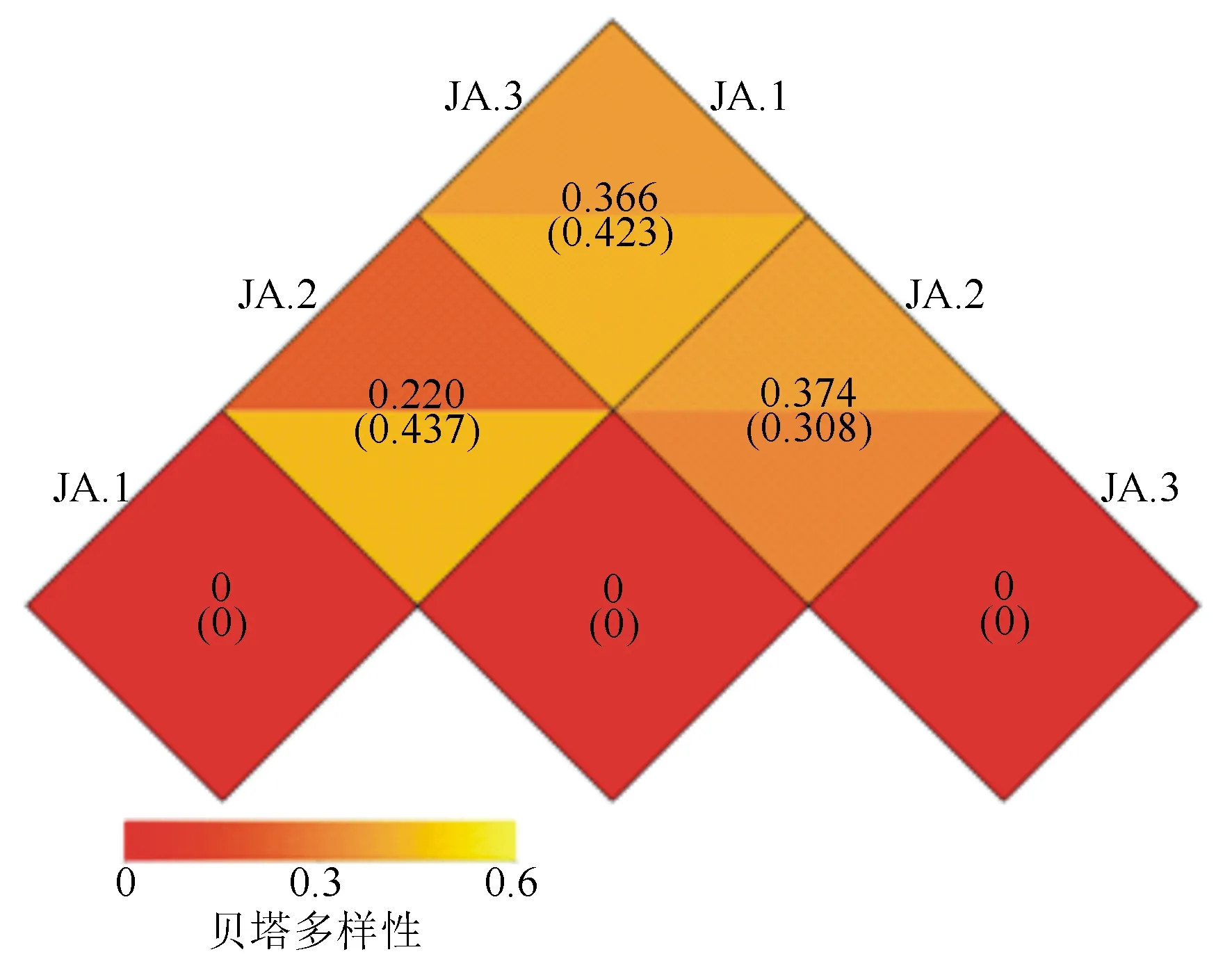
图6 人参根际土壤样品距离矩阵图(真菌)
3 结论与讨论
高通量测序技术已经广泛应用于根际土壤微生物的研究,与传统分子生物学方法相比,高通量测序技术能够更加全面的揭示土壤微生物群落结构的相关信息。本研究采用高通量测序技术进行微生物扩增子测序分析,通过对比分析,发现拟细菌微生物中的γ-变形菌纲、α-变形菌纲、酸性细菌纲,真菌微生物中的粪壳菌纲、座囊菌纲、伞菌纲在人参根围土壤微生物群落体系中占有很大比重,这与孙海等[14]的研究结果一致。
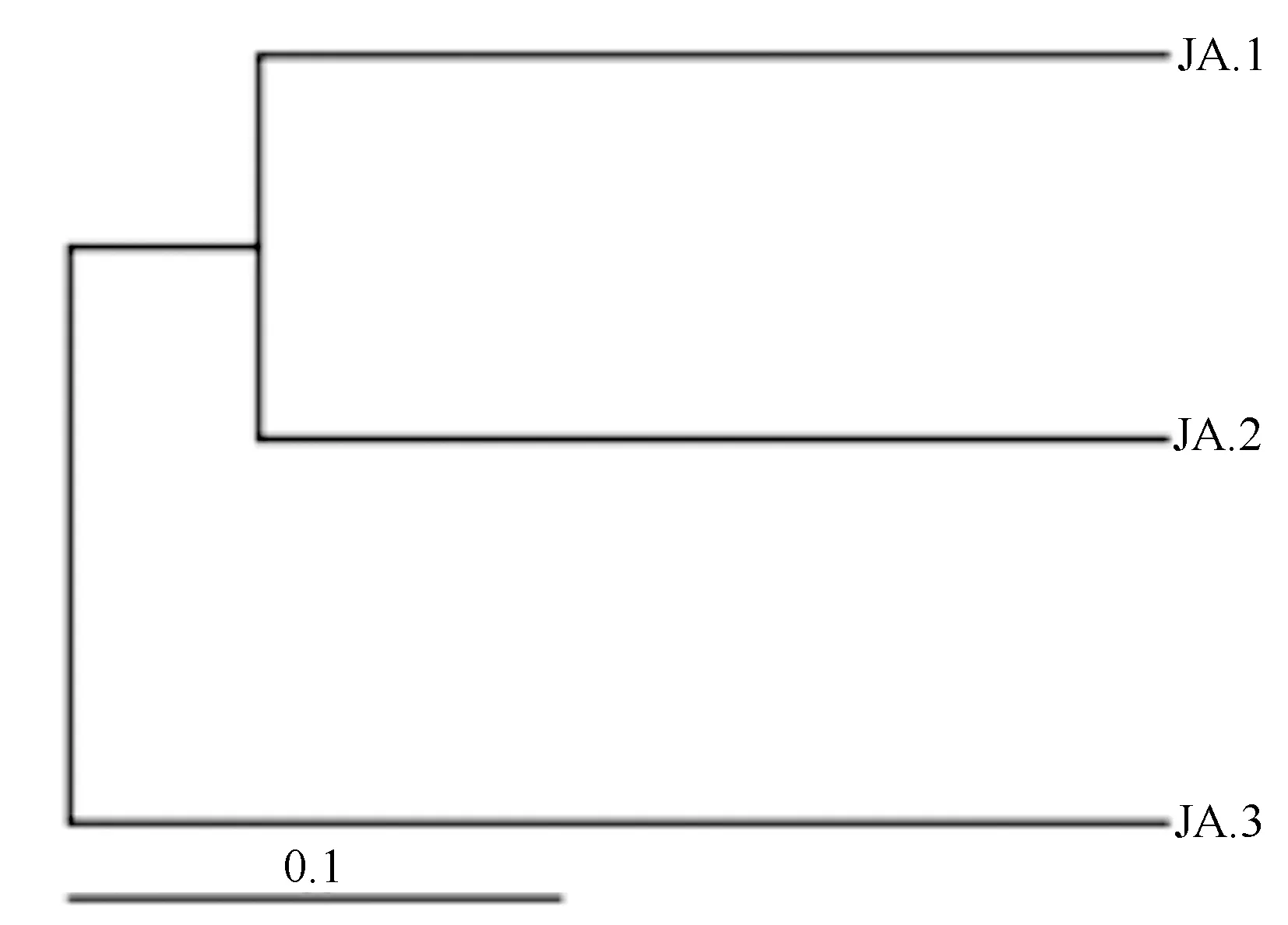
图7 人参根际土壤样品细菌门水平上样本树状聚类
图8 人参根际土壤样品真菌门水平上样本树状聚类
在林下护育、采伐迹地栽培和农田栽培3种栽培模式下,农田栽培人参根际土壤细菌多样性最丰富,而林下护育人参根际土壤中真菌多样性最丰富。林下护育模式中,细菌微生物种群丰富度和物种多样性均小于其他两种栽培模式,这与孙海等[14]、宋晓霞等[15]的研究结果有所不同,主要是采样环境不同。通过调查发现,集安市属于山地流水地貌区,土壤中粗骨质、障碍层次多,砂砾及砾石掺杂通体,土层浅,土质薄,土壤透气性好。林下护育模式属于仿生栽培模式,除对人参进行掐花处理外,生长环境人为干预极少,经过多年的自然筛选,大量有益微生物的扩繁、定植,在一定程度上限制了其群落多样性的增长;林下护育模式微生物群落结构朝着有利于人参生长的方向发展,趋于稳定。与张亚玉等[16]在林下参根区土壤微生物群落结构的研究中结论类似。而采伐迹地栽培模式和农田栽培模式栽培时经过人为干预[17],尤其农田栽培模式,栽培人参前进行土壤改良,人为添加了大量的微生物菌剂和生物肥料,使原生微生物群落被破坏,新生的微生物群落结构稳定性差,各种微生物处于无限制的爆发繁殖阶段,这也是农田栽培模式土壤中大量的粪生真菌的原因。不同栽培模式人参根际土壤细菌和真菌多样性的差异是否存在广泛性还有待进一步研究。
根际土壤中的病原微生物是导致植物发生土传病害的主要来源[18],不同栽培模式中病原微生物及拮抗微生物均有所不同。通过比较发现,林下护育模式中,人参灰霉病的致病病原菌葡萄孢属的丰度较高,其他致病微生物相对丰度则不明显,原因是林下护育栽培过程中没有过多的人为干预,没有药剂喷施。拮抗菌方面,毛壳菌属占有相当大的比例,另外,链霉菌属和伯克氏菌属均有较高的相对丰度。迟玉杰等[19]发现毛壳菌属含有较强的纤维素酶,能有效降解纤维素和有机质、对多种病原菌的生长均有一定的抑制作用。在采伐迹地栽培模式中发现较高丰度的茎点霉属和木霉属,茎点霉属可引起人参等药用植物叶斑病[20],而大多数木霉菌可产生多种对植物病原真菌、细菌及昆虫具有拮抗作用的生物活性物质[21]。除此之外,链霉菌属和伯克氏菌属相对丰度较高。而农田栽培模式,多种致病菌均有较高丰度(如镰孢菌属、柱孢霉属、分枝孢子霉属、柱孢菌属等),镰孢菌属可侵染多种植物,引起植物的根腐、茎腐、茎基腐、花腐和穗腐等多种病害[22],分枝孢子霉属空气中的优势真菌,能引起叶霉病、菌丝体病。农田栽培模式并未发现明显具有拮抗作用的真菌菌株。张鸿雁等[23]经过大量研究发现,链霉菌属对人参根系微生态有修复效应,有促生防病的作用。而伯克氏菌属除个别种与人类感染有关外,大多数用于防治多种植物真菌病害,主要用来防治腐霉病菌、立枯病菌和镰刀病菌等引起的土传病害[24-25]。毛欣欣等[26]发现伯克霍尔德氏菌具有矿物风化效应,可以从钾长石中释放硅、钾等元素,且对温度、pH值等有一定的耐受性,而硅、钾是人参生长的土壤化学环境特征[27]。目前并未发现在人参土壤改良中使用伯克氏菌属,在林下护育人参根际土壤中发现的伯克氏菌属,有望成为人参生物菌剂的备选生防资源。
