TRPV1 通过非焦虑依赖的机制参与肠易激综合征内脏高敏感的形成*
2021-03-09郑浩楠
郑浩楠 张 瑛 迟 雁△
(1 北京大学第一医院消化科,北京100034;2 北京大学神经科学研究所; 3 北京大学基础医学院神经生物学系;4 教育部/国家卫生健康委员会神经科学重点实验室,北京100191)
肠易激综合征 (irritable bowel syndrome, IBS) 是临床最常见的胃肠功能紊乱性疾病,以腹痛、腹胀或腹部不适伴有排便习惯及排便性状的改变为主要表现,同时缺乏明显的形态学改变及临床常规检查的异常[1,2]。难以缓解且反复发作的腹痛症状是IBS 病人的典型临床表现,其不仅严重影响病人的生活质量,同时也造成大量医疗资源的浪费。目前认为,脑-肠轴互动紊乱、内脏高敏感、肠道菌群紊乱、胃肠道动力异常、肠黏膜屏障受损、黏膜免疫与炎症、精神神经因素、遗传等机制共同参与IBS 的产生[3],其中内脏高敏感 (visceral hypersensitivity) 被认为是IBS 的核心病理生理学机制和生物学标记[4],但是关于其形成机制目前尚不清楚。探讨IBS 内脏高敏感的形成机制,对发掘新的IBS 腹痛的治疗靶点和临床治疗方案具有重要意义。
瞬时受体电位通道香草素亚型1 (transient receptor potential vanilloid, TRPV1) 是一种伤害性信息感受分子,可接受热 (> 43oC)、H+、辣椒素等多种形式的刺激,引起伤害性感受器的激活,传递伤害性信息[5,6]。TRPV1 高表达在外周感觉神经元及其神经末梢,在支配消化道的内脏感觉神经纤维中也有广泛的分布[7],并且有多项研究表明,TRPV1 可通过表达和功能的改变参与IBS 内脏高敏感的产生,其机制涉及TRPV1 与胆汁酸和肥大细胞表面及释放的多种分子的相互作用[8~10]。
临床上,IBS 病人的焦虑/抑郁水平显著高于一般人群[11],而且研究发现,机体在经历生理和心理应激后,不仅可产生焦虑/抑郁情绪,同时对内脏疼痛信号的感知也有所增强,即产生内脏高敏感[12~14]。有研究显示,TRPV1 受体可能参与焦虑/抑郁情绪的产生,除外周神经系统外,在多个脑区如海马、杏仁核、前额叶皮质等,均可检测到TRPV1 受体的表达,且在给予TRPV1 受体拮抗剂后,能明显缓解动物的焦虑/抑郁程度[15~17]。另外,有研究认为,TRPV1 受体可介导位于基底外侧杏仁核 (basolateral amygdala, BLA) 内突触传递功能的增强,这可能是内脏痛的中枢敏化机制之一[18]。因此TRPV1 受体介导的焦虑水平的改变,是否可以作为IBS 内脏敏感性升高的原因及其相关机制值得进一步探讨。本研究旨在探讨 TRPV1 是否可以通过影响焦虑水平从而进一步影响IBS 内脏高敏感的产生。研究将为明确TRPV1 参与IBS 内脏高敏感形成所涉及的途径提供新的证据,从而为临床IBS 难治性腹痛的治疗提供进一步的理论依据。
方 法
1.实验动物及分组
本实验所用动物均为雄性11 周龄,清洁级,体重为20~30 g 的野生型C57BL/6 小鼠和背景为C57BL/6的Trpv1-/-小鼠;饲养环境温度为 (20±1)oC,空气湿度为 (50±5)%,光照为12/12 h 的明暗光照循环。动物自由饮水摄食,每日更换饮水、饲料,定期更换垫料,保持小鼠生活环境通风及清洁卫生。野生型与Trpv1-/-小鼠分别随机分为溶剂注射组 (CTRL) 与IBS 模型组 (IBS),共4 组,每组8~10 只。
2. IBS 内脏高敏感模型的建立
各组小鼠在造模前24 h 自由饮水但禁食。使用0.1 ml 三硝基苯磺酸 (trinitrobenzene sulfonic acid, TNBS) (sigma, P2297) 灌肠液 (TNBS 130 μg/ml 溶于30%乙醇),缓慢注入IBS 模型组小鼠结肠。对照组小鼠使用同样方法,给予同等剂量的30%乙醇溶液灌肠。参照此前报道的方法进行[19]。
灌肠结束后,将所有小鼠放回原饲养笼,常规环境饲养,正常进食进水。随后为28 天的缓解期。缓解期结束进行内脏敏感性的检测,常规进行小鼠结肠炎症水平的评估。
3. IBS 模型内脏敏感性的评估
采用结直肠扩张 (colorectal distension, CRD)-腹壁撤回反射 (abdominal withdrawal reflex, AWR) 的方法检测内脏敏感性。
异氟烷(瑞沃德生命科技有限公司,中国)麻醉小鼠后,润滑球囊并小心缓慢插入小鼠结肠,至球囊距离肛缘1 cm,并将导管固定于小鼠尾部。将小鼠置于固定器中,保持小鼠只可前后运动但不能转身。待复苏至少40 min 后开始CRD 操作。快速向球囊内充气。将球囊内压力维持在20、40、60及80 mmHg,每个压力持续20 s,重复3 次,同一压力每次充气后为1 min 无压力的间歇期。不同压力之间为5 min 的间歇期。观察不同压力的CRD 下,小鼠腹壁撤回反射程度,并根据Al-Chaer 评分标准进行相应的评分(见表1)。为保证实验操作的严谨性,CRD-AWR 检测由两位不同实验人员依从盲法记录实验结果,每只小鼠的每个CRD 压力重复记录3 次并取平均值。

表1 Al-Chaer 评分标准Table 1 Al-Chaer AWR score
4.旷场实验 (open field test, OFT) 及高架十字迷宫 (elevated plus maze, EPM)
通过旷场实验和高架十字迷宫实验反映小鼠的焦虑样行为。
旷场实验:塑料制箱 (小鼠 50 cm×50 cm ×100 cm 长×宽×高) 置于安静的环境中,照明来自旷场上方白炽灯。实验开始前,将实验用小鼠置于实验环境中适应1 h 后开始实验。将小鼠放置在旷场中心开始测试,每只小鼠测试间隙,用酒精擦拭测试箱,防止上一只小鼠遗留的气味或脏物干扰实验结果。小鼠的行为由摄像头记录,中心区域(小鼠 25 cm×25 cm)停留的时间、进入中心区域次数及总运动距离由ANY-MAZE 软件进行分析。
高架十字迷宫:仪器由四个大小相同的塑料臂 (小鼠5 cm×35 cm)和一个中心平台(小鼠5 cm×5 cm)组成,其中两个相对的塑料臂为封闭臂,被40 cm 塑料墙封闭。实验开始前,将实验用小鼠置于实验环境中适应1 h 后开始实验。将小鼠至于迷宫中央,头朝开臂,每只小鼠测试间隙,用酒精擦拭测试仪器,防止上一只小鼠遗留的气味或脏物干扰实验结果。小鼠的行为由摄像头记录,开放臂停留时间比例、进入开放臂次数及总运动距离由ANY-MAZE 软件进行分析。

图1 野生型小鼠溶剂注射组(WT-CTRL)和IBS 模型组(WT-IBS),造模后第28 天,结肠H&E 染色图。结果显示,与溶剂注射组(WT-CTRL) 类似,IBS 模 型 组(WT-IBS) 在TNBS 注 射 后28 天,结肠组织均完整,无明显的充血和炎性细胞浸润。标尺 = 50 μmFig. 1 H&E (hematoxylin and eosin) staining images of colon tissues 28 d after solvent (WT-CTRL) (left) or TNBS (WT-IBS) (right) injection in wild-type mice. The images show that analogous to the solvent-injected mice, the colon tissues of TNBS-injected mice are intact and no obvious congestion and inflammatory cell infiltration were observed. Scale bar = 50 μm
5.统计学分析
结 果
1. TRPV1 参与IBS 内脏高敏感的形成
参照文献[19],选取了单次灌注0.1 ml TNBS 灌肠液(TNBS 130 μg/ml 溶于30%乙醇)的方法构建IBS 模型。野生型 (wild type, WT) 小鼠在TNBS 灌注后第28 天,结肠组织完整,无明显的充血和炎性细胞浸润(见图1),表明本研究所用的TNBS 剂量不会引起持续的炎症反应,28 天可认为炎症期结束。同时,通过CRD-AWR 法检测了IBS 造模后小鼠内脏敏感性的变化。结果显示,与溶剂注射组 (WT-CTRL) 相比,IBS 模型组小鼠 (WT-IBS) 在40 mmHg (P < 0.05) 和60 mmHg (P < 0.001) 的压力下,内脏敏感性升高,具有显著性差异(见图2)。以上结果表明,应用TNBS 单次灌肠的方法在野生型小鼠成功构建了IBS内脏高敏感模型。
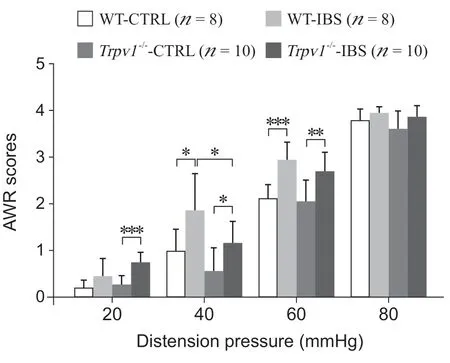
图2 WT 小鼠与Trpv1-/-小鼠结肠灌注 TNBS 前后 CRDAWR 评分比较非参数检验Mann-Whitney 法,*P < 0.05,**P < 0.01,***P < 0.001Fig. 2 Comparison of the CRD-AWR scores of WT and Trpv1-/- mice after intro-colonic injection of solvent (CTRL) or TNBS (IBS)Mann-Whitney Non-parametric tests, *P < 0.05, **P < 0.01,***P < 0.001.
为进一步验证TRPV1 受体参与IBS 模型内脏高敏感性的形成,本研究使用Trpv1-/-小鼠构建了IBS模型。在TNBS 单次灌肠后第28 天CRD-AWR 法检测显示,Trpv1-/-造模小鼠(Trpv1-/--IBS)与Trpv1-/-溶剂注射组(Trpv1-/--CTRL) 相比,其在20 mmHg (P < 0.001)、40 mmHg (P < 0.05) 和 60 mmHg (P < 0.01) 的压力下均表现出内脏敏感性增加,具有显著性差异(见图2)。同时,与野生型IBS模型组 (WT-IBS) 小鼠相比,Trpv1-/-IBS 模型组 (Trpv1-/--IBS) 小鼠在40 mmHg 的压力下,表现出内脏高敏感性的缓解,差异具有显著性(P < 0.05,见图2)。以上结果表明,TRPV1 受体可参与IBS 内脏高敏感性的形成,但内脏高敏感并非仅通过TRPV1 受体这一单一途径形成,其他机制也参与其中。
2. TRPV1 参与焦虑情绪的产生
接下来进行了旷场实验与高架十字迷宫检测,观察IBS 模型小鼠焦虑水平的改变情况。
旷场实验结果显示,与野生型小鼠相比,Trpv1-/-小鼠不管在基础状态还是IBS 造模后,均显示中心区停留时间延长,具有显著性差异(P < 0.05,见图3A),但两种基因型小鼠均未显示IBS 造模前后,中心区停留时间的变化。类似的,Trpv1-/-小鼠在IBS 造模后 (Trpv1-/--IBS) 与野生型小鼠IBS 造模后 (WT-IBS) 比较显示,其进入中心区次数有增加的趋势(P = 0.056,见图3B)。总运动距离的比较显示,野生型小鼠溶剂注射组和IBS 模型组、Trpv1-/-溶剂注射组和IBS 模型组,各组小鼠之间均无显著性差异(见图3C),提示各组小鼠的运动能力无差别。
高架十字迷宫结果显示,各组小鼠进入开放臂的时间比例(见图4A)、开放臂进入次数(见图4B)及总运动距离(见图4C)均无显著性差异。

图3 旷场实验结果显示,在基础状态和IBS 造模后,与野生型小鼠相比,Trpv1-/-小鼠中央区停留时间延长(A);进入中央区次数有增加的趋势(B);总运动距离无显著性变化(C) (two-way ANOVA with Tukey's post-test)Fig. 3 Open field test showed that compared with the wild type mice,both under the basal condition and in the IBS model,Trpv1-/- mice spent more time in central (A); showed an increased tendency in the entries in central (B); and showed no significant change in the total distance travelled (C) (two-way ANOVA with Tukey's post-test).

图4 高架十字迷宫实验显示,在基础状态和IBS 造模后,与WT 小鼠比较,Trpv1-/-小鼠的开放臂停留时间(A);开放臂进入次数(B)和总运动距离(C)均无显著性变化(two-way ANOVA with Tukey's post-test)Fig. 4 Elevated plus maze assay showed that compared with the wild type mice,both under the basal condition and in the IBS model, there is no significant difference in the time spent in the open arms (A); Entries in the open arms (B) and total distance travelled (C) between WT and Trpv1-/- mice (two-way ANOVA with Tukey's post-test).
讨 论
IBS 内脏高敏感模型的构建方法种类繁多,如束缚应激、母婴分离-避水应激、葡聚糖硫酸钠 (dextran sulfate sodium, DSS) 灌肠、乙酸灌肠等。在众多方法中,结肠内灌注TNBS 是应用最为广泛的造模方法。TNBS 是一种化学半抗原,能够与组织蛋白结合并刺激Th1 细胞介导的免疫反应。该方法能够较好地模拟IBS 病人的内脏高敏感、结肠动力紊乱、黏膜通透性及分泌改变等病理特征。本研究结果也证实,应用该方法建立的野生型小鼠IBS模型28 天未显示结肠炎症的病理改变,同时使用CRD-AWR 法检测到,IBS 模型组小鼠在40 mmHg和60 mmHg 压力下内脏敏感性升高,表明TNBS单次灌肠方法建立的IBS 模型是探究内脏高敏感性的可靠模型。
近些年的多项研究证实TRPV1 受体与内脏高敏感的形成相关[20]。Akbar 等发现IBS 病人的乙状结肠黏膜中TRPV1 表达上调[21]。另一项研究显示,在结肠炎康复期,Trpv1-/-小鼠并未表现出和野生鼠类似的疼痛相关行为学改变或结肠扩张的内脏动力学改变[22]。在本研究中,使用Trpv1-/-小鼠也成功构建了IBS 模型,提示IBS 内脏高敏感的形成并非TRPV1 相关的单一通路所致,其产生是多种因素共同作用的结果。但与野生型IBS 模型组小鼠相比,敲除Trpv1 基因能够显著降低TNBS 灌注引起的内脏高敏感性,提示TRPV1 受体是参与IBS 内脏高敏感产生的重要分子之一。
临床上,IBS 病人往往合并焦虑或抑郁状态[11]。心理或生理应激除诱发机体出现焦虑/抑郁情绪,亦可导致机体对内脏痛觉的感知增加[14]。研究表明,TRPV1 受体与焦虑情绪的产生有关。除已在多个脑区检测到TRPV1 受体的表达外[23],研究发现,给予大鼠腹腔注射capsazepine,能够减少其焦虑样行为的产生[24], 将capsazepine 微量注射入大鼠腹内侧前额叶皮层 (vmPFC) 后可发挥其抗焦虑作用[25]。
本研究探讨了TRPV1 是否可以通过影响焦虑水平而参与内脏敏感性的形成。研究发现,Trpv1基因敲除小鼠出现基础焦虑水平的显著降低,但与对照组相比,IBS 模型组并未显示有焦虑水平的升高。Salameh 等[26]的研究发现:连续3 周,给予0.25 ml 的不同浓度 (15, 30, 45 mg TNBS) 的TNBS-50%乙醇溶液灌肠,诱导的结肠炎模型小鼠,其在缓解期的焦虑水平升高。本研究与之结果不同的原因,我们考虑与TNBS 的灌肠剂量有关。虽然TNBS 灌肠作为经典的感染后IBS (post-infection IBS, PI-IBS)内脏高敏感动物模型已经得到了广泛的认可,但其缺点在于现存的使用TNBS 造模的动物实验中,始终无统一的灌肠剂量与灌肠位置及模型评估时间。灌肠位置与剂量的不同,能够引起不同程度的Th1型细胞介导的免疫反应,造成不同程度的炎症反应。因此我们认为本研究所用的TNBS 造模剂量不足以引起小鼠焦虑水平的改变。另一方面,研究表明TRPV1 受体参与焦虑/抑郁情绪的产生。本研究分别借助野生型和Trpv1 敲除的小鼠构建了IBS 模型,均检测到内脏敏感性的升高且Trpv1 基因敲除可缓解IBS 导致的内脏高敏感,但是与各自的溶剂注射组相比,并未检测到焦虑水平的改变。由于TNBS造模后,Trpv1-/-小鼠在不改变其焦虑水平的情况下,仍然表现出内脏高敏感缓解的现象,提示TRPV1受体参与焦虑和内脏敏感性的形成可能为两条不同的通路,不存在相关性。因此认为在TNBS 诱导的IBS 模型中,TRPV1 受体可能通过非焦虑依赖的机制参与内脏高敏感形成。
在本研究中,没能在高架十字迷宫实验中发现Trpv1-/-小鼠焦虑水平的改变。针对这种旷场实验和高架十字迷宫实验结果不一致的现象,我们认为可能的原因是在于旷场实验后再次进行高架十字迷宫实验,小鼠对这种刺激已经产生适应,所以并未在高架十字迷宫实验中产生明显差异。类似的情况在此前的一项关于TNBS 诱导的结肠炎缓解期焦虑水平的研究中也有报道[26]。因此,接下来会进一步扩大实验样本量,确认该实验结果。
综上所述,TRPV1 参与IBS 内脏高敏感的形成,也影响焦虑状态的形成。但在TNBS 模型中其影响内脏高敏感形成的过程可能主要是通过非焦虑依赖的机制参与。今后若需进一步探寻TRPV1 受体通过焦虑影响内脏敏感性的产生,可以尝试增加TNBS 灌肠剂量或使用其他化学诱导法如葡聚糖硫酸钠(dextran sulfate sodium, DSS)灌肠、乙酸灌肠的造模方法,比较WT 鼠与Trpv1-/-鼠构建IBS 模型后的差异。在观察到内脏敏感性与焦虑水平有所改变的基础上,继续比较灌肠给药和脑室注射TRPV1 拮抗剂后内脏敏感性水平改变的差异,以期能更准确的说明中枢和外周TRPV1 受体在此中发挥的作用。
