山奈酚通过mTORC1信号促进牵张力下小鼠骨髓间充质细胞成骨分化机制研究
2021-03-09崔琳娜蒋校文黄华庆陈金勇
崔琳娜, 蒋校文, 黄华庆, 陈金勇
1.郴州市第一人民医院口腔科 南华大学转化医学研究所,湖南 郴州(423000); 2.南方医科大学口腔医学院,广东 广州(510515)
牵张成骨作为口腔颌面外科及整形外科治疗先天、后天畸形缺损等的重要整复手段在临床上具有明显优势,目前其治疗周期长、并发症相对较多等不足限制其临床广泛应用[1-2]。学者们使用了生长因子、细胞治疗、基因治疗等多种治疗手段试图促进成骨缩短治疗周期,但均停留在实验层面,上述治疗手段不仅价格昂贵,且受到伦理、安全等因素限制,短时间难以在临床广泛推广。近来研究发现,山奈酚(kaempferol,Kae)不仅具有抗氧化、抗炎、抗癌等作用,而且能够防治骨质疏松、促进成骨。本研究以多单元细胞拉伸装置为平台,对Kae 处理后的小鼠骨髓间充质细胞(bone marrow mesenchymal cells,BMMCs)施加周期性单轴牵张力,同时通过工具药抑制内源性哺乳动物雷帕霉素靶蛋白复合物1(mammalian target of rapamycin complex 1,mTORC1)信号通路的表达,旨在观察Kae 促进细胞张应力下成骨分化过程中该信号通路的作用,为改善牵张成骨效果提供实验基础。
1 材料和方法
1.1 材料
3 月龄雄性小鼠(南华大学转化研究所动物实验中心,SYXK <湘>2020-0002)。
多单元细胞拉伸装置(四川大学);分光光度仪(Roch,瑞士);流式细胞仪(Thermo,美国)。Percoll 分离液(Phamacia,美国);10%胎牛血清(Hyclone,美国);LG-DMEM 培养液(Gibico,美国);二甲 基 亚 砜(Dimethylsulfoxide,DMSO)(Thermo,美国);茜素红S 染色液(索莱宝,中国);细胞碱性磷酸酶(alkalinephosphate,ALP)试剂盒(建成,中国);骨钙素(osteocalcin,OCN)试剂盒(RD,美国);BCA蛋白定量试剂盒(Thermo,美国);Trizol 试剂盒(Gibico,美国);反转录试剂盒(Takara,大连)。pmTOR 一抗(Abcam,英国);p-S6K 一抗(Cell Signaling,美国);p-4E/BP1 一抗(Cell Signaling,美国),Osterix 一抗(Abcam,英国);Runx2 一抗(SantaCruz,英国),GAPDH 一抗(SantaCruz,英国),羊抗兔二抗(中杉,中国)。
1.2 方法
1.2.1 小鼠BMMCs 的分离、培养及加力 无菌条件分离3 月龄雄性小鼠双侧股骨和胫骨,冲出骨髓组织,利用密度梯度离心法提取BMMCs。离心后去除脂肪组织吹打成细胞悬液,加Percoll 分离液后离心吸取交界面细胞层,清洗后加入10%胎牛血清及双抗的LG-DMEM 培养液,吹匀后接种于培养瓶内,2~3 d 后更换培养基,当细胞融合达70%~80%时胰酶消化传代,选用第3 代细胞进行下一步实验,每个检测指标收集8 个样本行检测。按照原有方法[3]制备硅胶膜,将2×104个细胞悬液接种于硅胶膜后在37 ℃体积分数5% CO2培养箱培养24 h 后补加含10%胎牛血清的培养基10 mL培养24 h,更换无血清培养液同步化12 h 后利用多单元细胞拉伸装置(四川大学)施加10%形变量的单轴动态牵张力2 h(频率为0.2 Hz,工作原理示意图见图1)。
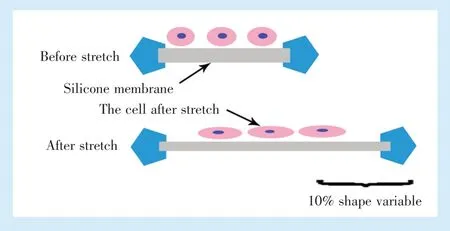
Figure 1 Schematic diagram of BMMCs before and after stretching图1 BMMCs 细胞牵张受力示意图
1.2.2 筛选合适浓度Kae 对无血清同步化后的细胞加力单元加入1、5、10、50、100 μmol/L,Kae(以DMSO 为溶剂)后行2 h 动态牵张,牵张结束后进行细胞毒性试验、细胞计数和茜素红染色。
1.2.2.1 细胞毒性试验 牵张结束后加入200 μL MTT 溶液(5 mg/mL),4 h 后吸除培养基,加入5 mL DMSO,放在摇床上低速振荡10 min 后使用分光光度仪检测各加力单元490 nm 波长下的OD 值并计算抑制率。
1.2.2.2 细胞计数 牵张结束后1、4、8 h,胰酶消化并悬浮细胞后利用细胞计数板在倒置显微镜下计算细胞个数。
1.2.2.3 茜素红染色 牵张结束后继续在细胞培养箱中培养,2~3 d 换液,7 d 后去除培养液,PBS清洗后取出硅胶膜,修剪后置入方形培养皿中加4%多聚甲醛固定30 min,弃液后再次清洗加入茜素红S 染色液反应5 min,弃除染液清洗至不变色后拍照。
1.2.3 细胞分组 设立四组细胞加力,A 组:对照组;B 组:mTORC1 信 号 通 路 抑 制 组;C 组:Kae处 理 组;D 组:Kae 处 理 后 抑 制mTORC1 信 号 通路组。加力前,C 组和D 组加入10 μmol/L Kae,A 组和B 组在加力前加入等体积DMSO;加力后,B 组和D 组立即加入mTOR 信号抑制剂pp242(100 nnol/L),A 组和C 组加入等体积PBS,4 h 后进行后续检测。
1.2.4 化学比色法检测ALP 活性 胰酶消化收集细胞后,与3 mL 带血清培养基混匀,离心清洗后反复冻融3 次,离心后收集上清液50 μL 加入试剂盒中基质液和缓冲液各500 μL,37 ℃水浴15 min后加入显色剂1.5 mL,立即检测其520 nm 波长下吸光度值,根据公式(y=1 000x/17.9)计算出ALP活性。
1.2.5 ELISA 法检测OCN 含量 将加力单元内培养液1 mL 离心后收集上清,在酶标包被板中入待测样本10 μL,再加样本稀释液40 μL,混匀后37 ℃温育30 min,弃液洗板甩干,加入工作液50 μL,37 ℃温育30 min 后弃液洗板甩干后再加入显色剂50 μL 混匀,37 ℃避光显色15 min 后加终止液50 μL 终止反应后检测其450 nm 波长下吸光度值,通过标准品测量后的标准曲线的直线回归方程(y=3.732x+0.929)方程计算出培养液内骨钙素相对浓度。
1.2.6 流式细胞仪检测细胞内钙离子相对含量收集洗涤细胞后加入Fluo-4,AM 工作液至终浓度为5 μmol/L,置于细胞培养箱孵育30 min,去除Fluo-4,AM 工作液,用PBS 洗涤细胞后重悬细胞,制成1 × 105个/mL 的溶液再置于细胞培养箱孵育10 min 后立即在流式细胞仪下进行荧光钙离子检测(激发波长506nm,发射波长526nm),获得细胞内钙离子的相对含量(平均荧光强度)。
1.2.7 Western Blot 检测mTORC1 信号通路主要分子及成骨转录因子 收集硅胶膜上的细胞裂解后得到总蛋白,以牛血清为标准品,利用BCA 蛋白定量试剂盒建立标准曲线,计算总蛋白浓度,取总蛋白20 μg 行SDS-PAGE 电泳,转PVDF 膜,脱脂奶粉封闭后一抗孵育过夜后二抗37 ℃孵育1 h,置于自动成像仪暗匣中加显影液,计算机扫描收集图像,检 测GAPDH、p-mTOR、p-S6K、4E/BP1、Osterix、Runx2 蛋白表达水平,GAPDH 作为内参。
1.2.8 qRT-PCR 检测mTORC1 信号通路主要分子及成骨转录因子mRNA 水平 收集硅胶膜上的细胞按Trizol 试剂盒流程提取细胞中总RNA,通过异丙醇沉淀法浓缩RNA,进一步对总RNA 行过柱纯化。qRT-PCR 测定mTORC1 信号通路及成骨转录因子mRNA,以GAPDH 为内参。采用反转录试剂盒在BioRad 1000TM上反转录成cDNA。再以第一链cDNA 为模板,采用SYBR Green I 染料进行qRTPCR 反应。PCR 扩增条件为:95 ℃30 s;95 ℃5 s,57 ℃30 s,共40 个循环。
1.3 统计学方法

表1 引物序列Table 1 Sequences of primers for qRT-PCR
2 结 果
2.1 通过MTT 试验、细胞计数、茜素红染色筛选出10 μmol/L Kae
通过MTT 细胞试验发现牵张结束后4 h,浓度为1、5、10、50、100 μmol/L 的Kae 对应的细胞抑制率(图2a)分别为(3.11 ± 0.88)%、(6.87% ± 1.40)%、(10.17±1.34)%、(26.63±5.46)%和(42.61±5.44)%,除5 μmol/L 与10 μmol/L 的组间差异无统计学意义(P=0.073);其余各组间差异均具有统计学意义(P<0.05)。
牵张结束后1、4、8 h,可以发现浓度为50、100 μmol/L 的Kae 组细胞增殖能力(图2b)明显受到抑制,而浓度为1、5、10 μmol/L 的Kae 组细胞增殖能力基本一致。
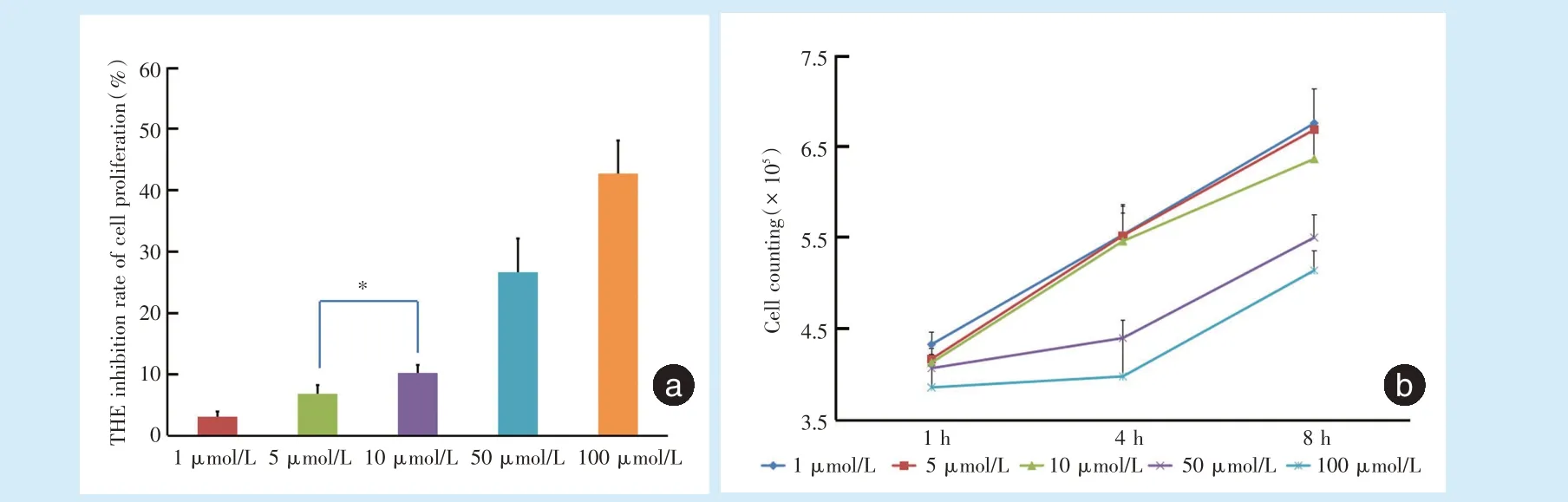
Figure 2 Inhibition of cell proliferation and cell counting 4 h after stretching under various concentrations of Kae图2 加入不同浓度Kae 进行细胞加力后4 h 细胞抑制率和细胞计数
牵张结束后7 d 发现10 μmol/L 的Kae 组茜素红染色(图3)最为明显,5 μmol/L 的Kae 组染色其次,其余各组染色不明显。
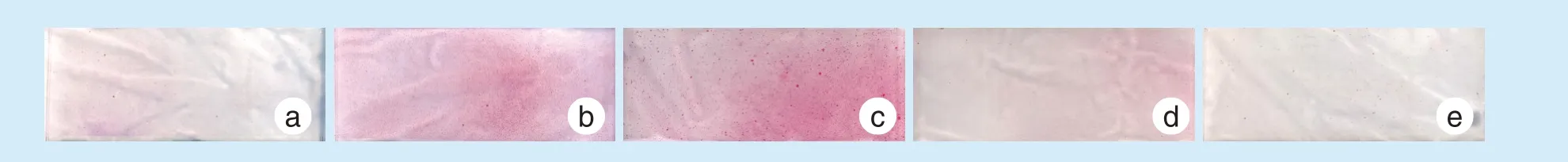
Figure 3 Alizarin staining images 7 days after stretching under various concentrations of Kae图3 加入不同浓度Kae 牵张后7 d 茜素红染色结果
2.2 牵张后4 h 4 组ALP、OCN、细胞内钙离子相对含量表达
牵张后4 h A 组、B 组、C 组、D 组ALP 分别为:(82.56 ± 7.61)U/mg、(65.78 ± 14.51)U/mg、(153.04± 18.72)U/mg、(88.73 ± 9.09)U/mg,除A 组与D 组间差异无统计学意义(P=0.359),其余各组间差异均具有统计学意义(P<0.05)(图4a)。
A 组、B 组、C 组、D 组OCN 表达分别为(0.78 ±0.15)U、(0.54 ± 0.10)U、(1.64 ± 0.25)U、(0.99 ±0.07)U,各组间差异均具有统计学意义(P<0.05)(图4b)。
牵张结束后A 组、B 组、C 组、D 组细胞内钙离子相对含量为96.63 ± 5.97、94.23 ± 4.61、78.23 ±5.08、90.84 ± 4.33,除A 组与B 组(P=0.35)、B 组与D 组(P=0.189)间差异无统计学意义,其余各组间差异具有统计学意义(P<0.05)(图4c)。
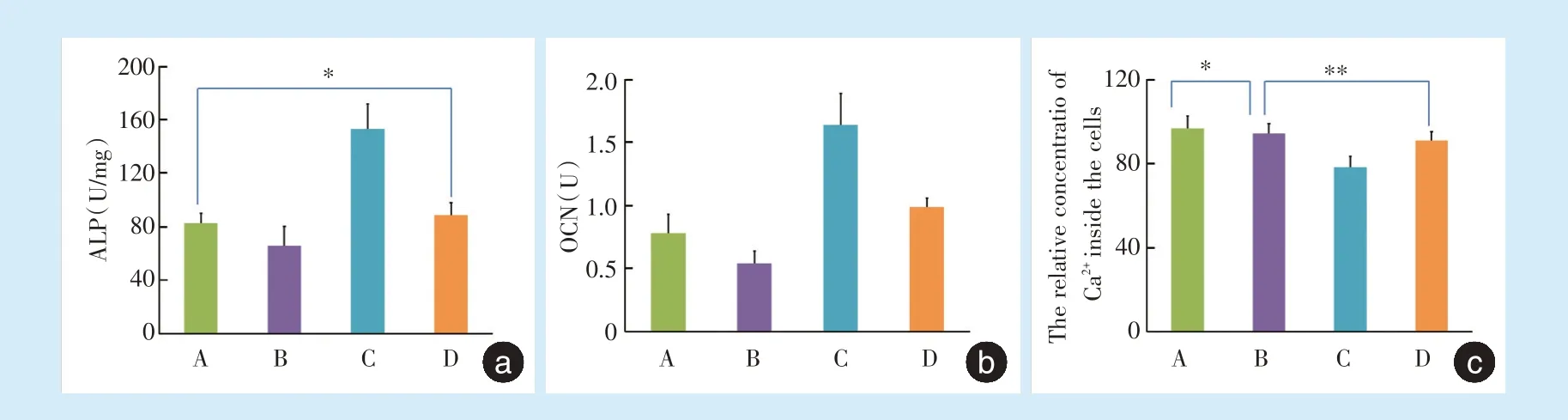
Figure 4 Levels of ALP,OCN and relative concentration of intracellular calcium in four groups 4 hours after application of dynamic tensile force图4 牵张后4 h 4 组ALP、OCN 及细胞内钙离子相对含量表达
2.3 牵张后4 h mTORC1 通路主要分子及成骨转录因子表达变化
2.3.1 qRT-PCR 结果 与对照组A 组相比:B 组mTOR、S6K mRNA 水平明显受到抑制,4E/BP1 mRNA 水平无明显变化,Runx2 及Osterix mRNA 水平明显下调;C 组mTOR、S6KmRNA 水平均上调,4E/BP1 mRNA 水平下调,Runx2 及Osterix mRNA 水平上调。与C 组相比:D 组中被Kae 上调的mTOR、S6KmRNA、Runx2 及Osterix mRNA 水平被pp242 明显抑制,被Kae 下调的4E/BP1 mRNA 水平被pp242明显上调(图5a~e)。
2.3.2 Western Blot 结果 除B 组Runx2 蛋白表达与A 组无明显差别外,各组p-mTOR 蛋白、p-S6K蛋白、p-4E/BP1 蛋白、Osterix 蛋白、Runx2 蛋白表达呈现与其mRNA 表达水平一致的变化趋势(图5f)。
3 讨 论
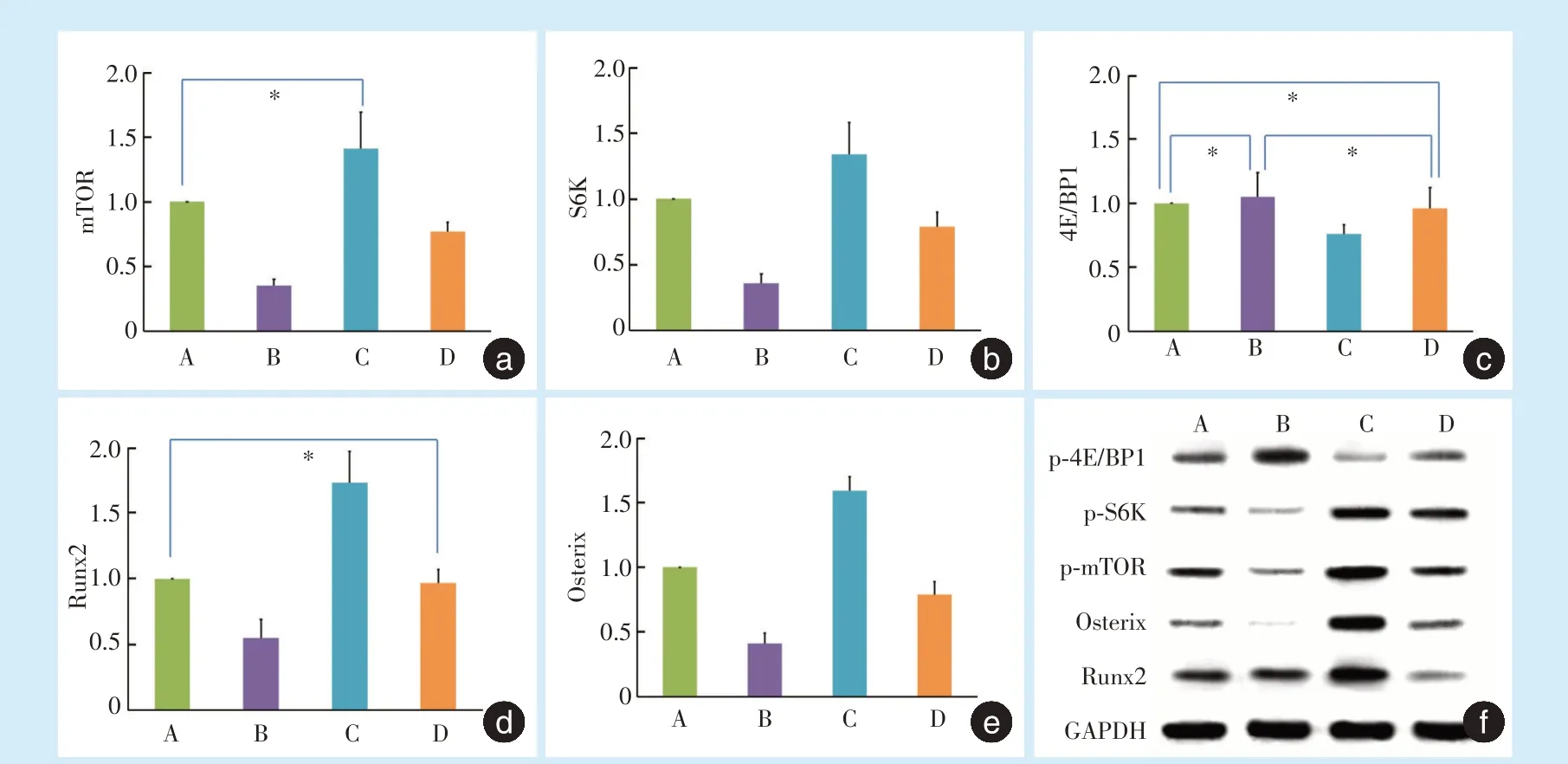
Figure 5 The mRNA levels of the major signaling molecules of the mTORC1 signaling pathway and osteogenic transcription factors in BMMCs 4 hours after appplication of dynamic tensile force图5 牵张后4 h mTORC1 通路主要分子及成骨转录因子mRNA 和蛋白表达情况
Kae 是一种最先从姜科植物山奈中分离得到的黄酮醇类化合物,其大量存在于水果、蔬菜、豆类和茶叶及中草药如沙棘、银杏叶中。研究发现其具有广泛的成骨活性。Kae 能够在体外实验中促进成骨细胞增殖和分化,提高成骨细胞内ALP活性[4-5],这种促进ALP 活性是通过细胞外调节激酶和雌激素受体途径来实现[6-7]。在卵巢切除动物模型中也发现Kae 通过促进成骨细胞生成,抑制骨髓脂肪细胞的形成[8-9]。本实验通过MTT 细胞毒性试验发现随着Kae 浓度的逐渐增高,细胞抑制率逐渐上升,细胞增殖能力下降。而茜素红染色提示在Kae 浓度为10 μmol/L 条件下的成骨效果最佳,说明在10%形变量的牵张力下10 μmol/L 的Kae 能够最有效促进成骨效果,且细胞增殖能力未受到明显抑制。
mTOR 是一种保守的丝/苏氨酸蛋白质激酶,在细胞多种生理活动的调控中处于核心地位,其中研究较多的mTORC1 由mTOR、Raptor 和mLST8组成,能接受生长因子、应激等刺激并对雷帕霉素(rapamycin)敏感[10-11]。S6K 和4E/BP1 是mTORC1发挥其功能的主要下游效应分子。研究发现激活mTORC1 信号促进S6K 磷酸化,但抑制4E/BP1 磷酸化[12]。本研究加入pp242 后,mTOR 和下游S6K 的mRNA 水平及磷酸化蛋白表达均受到抑制,而4E/BP1 表达没有受到明显影响,说明mTROC1 信号通路受到抑制。
Runx2 是成骨细胞分化过程中的重要转录因子,是激活和促进骨髓间充质细胞向成骨细胞分化调节及促进成骨细胞成熟的关键。Osterix 是一种成骨特异性因子,只在发育的骨组织中特异性表达。Chiou 等[13]发现Kae 能够显著促进MC3T3-E1 成骨细胞ALP 活性,上调骨钙素、骨桥蛋白和Ⅰ型胶原mRNA 表达,诱导骨结节形成,而这种成骨作用与其增加Runx2 的核移位有关。Kim 等[14]也在MC3T3-E1 成骨细胞中发现Kae 通过激活Runx2和Osterix 基因表达促进成骨。本研究中,C 组(Kae处理组)结果提示,Kae 能够有效促进ALP、OCN 的蛋白表达以及成骨转录因子Runx2 和Osterix 的基因及蛋白表达,与以上研究结果一致。而且,在加入mTOR 抑制剂pp242[11]后,mTORC1 信号通路主要分子mTOR 及S6K 的基因表达及蛋白磷酸化水平均被抑制,另外ALP、OCN、Runx2 和Osterix 的表达也明显受到抑制,提示Kae 通过mTORC1 信号通路促进张应力下细胞成骨分化,而且Runx2、Osterix 两种骨特异性转录因子可能处于mTOR 信号通路下游。
Kae 是一种线粒体钙离子单通道激活剂,能够降低心肌细胞线粒体钙离子[15]。在细胞自噬实验中发现,mTOR 信号被抑制后,内质网-线粒体钙离子转运能力明显被抑制[16]。本研究中,Kae 处理后mTROC1 信号通路被激活,而且细胞内钙离子浓度明显下降,但当内源性mTOR 信号被抑制后这种钙外流现象被消弱,提示Kae 通过mTOR 通路加速细胞内钙离子的外流释放从而促进细胞外基质钙化是其促进张应力下细胞成骨分化的机制之一。
本研究结果提示,Kae 提高了牵张力下BMMCs 成骨活性,增加Runx2 和Osterix 以及mTOR 通路下游调节因子p-4E/BP1 和p-S6K 的表达水平,而pp242 干预则逆转了Kae 对骨形成的积极促进作用。本研究表明,Kae 通过mTORC1 信号通路促进单轴牵张力作用下的小鼠BMMCs 成骨分化过程。
【Author contributions】Cui LL,Huang HQ,Chen JY performed the experiments,analyzed the data and wrote the article. Jiang XW designed the study and revised the article. All authors read and approved the final manuscript as submitted.
