口腔黏膜下纤维性变的病因、致病机理、诊断与治疗
2021-03-09翦新春高兴
翦新春, 高兴
中南大学湘雅医院口腔颌面外科,湖南 长沙(410008)
口腔黏膜下纤维性变(oral submucous fibrosis,OSF)是口腔黏膜下结缔组织内广泛的胶原纤维沉积,上皮固有层或其下结缔组织内的局部炎症和肌纤维坏死改变所致的一种慢性黏膜疾病。OSF的发病随区域而不同,而且与饮食习惯及文化密切相关[1-3]。OSF 在印度的发病率最高,但这种病也多见于东南亚许多国家[4],在中国的OSF 患者均有咀嚼槟榔的习惯。流行病学研究显示,咀嚼槟榔是导致OSF 的最重要的致病因素[5],世界卫生组织2004 年在法国里昂召开会议,确定了槟榔咀嚼物为1 级致癌物,吸烤烟和饮白酒可加重OSF 的风险。OSF 被广泛认为是一种口腔癌前病变,其癌变发生率为7%~30%[6]。为了更好促进口腔科医生对OSF 的病因、致病机理的认识和提高诊断及治疗水平、减少口腔癌的发生,本文对在OSF 病因、致病机理、诊断及治疗方面已经取得的相关研究进展作一介绍,供同行参考。
1 OSF 的病因、临床分期及病理特征
咀嚼槟榔是导致OSF 的最重要的病因。有学者根据OSF 的临床表现、组织病理学或导致的开口功能障碍进行了分类及分期,某些分类已被临床医师用来诊断和治疗该病[7]。在临床分期中,早期OSF 有口腔黏膜炎、水疱;中期OSF 口腔黏膜有大理石样改变,可触及纤维条索;晚期OSF 除有中期OSF 口腔黏膜的大理石样改变,可触及纤维条索之外,往往还伴有白斑和红斑的存在。根据OSF导致的开口功能障碍分类,在Ⅰ~Ⅳ期/阶段,上下中切牙之间的最大开口度从大于35 mm 到小于5 mm 不等。笔者认为:决定OSF 分期或分级主要由口腔黏膜下胶原纤维形成的量和张口度的大小决定。极早期:双颊部或软腭黏膜有散在性的苍白区,双颊部黏膜下区域纤维条索不明显,张口度无变小;早期:双颊部或软腭黏膜散在性的苍白区增大,双颊部黏膜下区域纤维条索增多,张口度为25~37 mm;中期:双颊部和软腭黏膜苍白区增多,双颊部黏膜下区域纤维条索增粗,张口度为15~24 mm;晚期:双颊部和软腭黏膜苍白,双颊部黏膜下纤维增粗,呈板状区,张口度为0~14 mm。
OSF 的组织病理改变包括口腔黏膜上皮细胞和上皮钉突的形态改变及上皮下致密胶原条索的沉积。在OSF 的不同阶段,上皮的改变从萎缩到增生和(或)异常增生。OSF 最常见的症状是溃疡、口腔干燥、烧灼感。以上这些改变干扰患者的日常生活,导致并发症。组织损伤之后,细胞外基质形成,黏膜上皮细胞及肌纤维细胞增殖以修复创面。然而,细胞外基质的广泛集结,如胶原纤维的集结可导致病理性的组织纤维化,即OSF 的形成。
2 OSF 的致病机理
OSF 的发生主要是黏膜下维持胶原纤维内环境稳定性的改变所致。研究证实,OSF 是胶原内环境调节紊乱的结果,即胶原纤维的合成增加、分解减少[8]。槟榔导致了成纤维细胞新陈代谢的改变,槟榔含有槟榔碱、黄酮类和铜[9],这些化学物质对口腔黏膜组织中细胞外基质的内环境有干扰。咀嚼槟榔同时又抽烤烟和饮酒者,OSF 的病变程度加重[5]。
2.1 口腔黏膜下结缔组织内胶原纤维的合成增加
槟榔含有四种生物碱,它们分别是槟榔碱、槟榔次碱、四氢烟酸和四氢烟酸甲酯,这些生物碱刺激成纤维细胞合成胶原。OSF 结缔组织中分别有约85%的Ⅰ型胶原和约15%的Ⅲ型胶原,在OSF 的上皮下组织中,Ⅰ型胶原链α1∶α2 是3∶1,在正常的口腔黏膜下组织中为2∶1[9]。槟榔中加入煅石灰(碳酸钙)促进槟榔碱转变为槟榔次碱,槟榔次碱可促进成纤维细胞的增殖及胶原纤维的形成。
2.2 口腔黏膜下结缔组织内胶原纤维的降解减少
胶原的稳定性增加、细胞基质动力学的不足及巨噬细胞功能的抑制导致胶原降解减少。
槟榔碱促进胶原酶DNA 双螺旋间绞链的形成,这种绞链形成使胶原的降解减少[10]。槟榔碱以剂量依赖方式上调OSF 中的胱蛋白C。胱蛋白C 抑制半胱氨酸蛋白酶以稳定OSF 中的胶原纤维;另外,胱蛋白C 抑制吞噬细胞对胶原纤维的吞噬作用,使得OSF 患者的吞噬细胞功能明显不足,这种不足加速了OSF 的形成[5]。已有研究证实,用槟榔碱处理过的OSF 成纤维细胞,其胶原的吞噬溶解作用下降[9]。鞣酸和儿茶酚样的黄酮也是槟榔的主要成分,而且与生物碱协同导致OSF。黄酮通过抑制胶原酶对胶原纤维的溶解来稳定胶原[11]。槟榔的添加剂诱导引起黏膜局部炎症,这种炎症激活了T 淋巴细胞和巨噬细胞而使转化生长因子-β(transforming growth factor-β,TGF-β)增加。TGF-β可通过激活基质金属蛋白酶抑制因子(tissue inhibitor of metalloproteinase,TIMP)基因和血浆纤维蛋白溶酶原激活物(plasminogen activator inhibitor,PAI)而阻止胶原的降解[11],并减少蛋白酶的溶解水平,如减少由成纤维细胞分泌的基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)和MMP-9[12]。槟榔碱可上调成纤维细胞TIMP-1 的转录和翻译水平[10]。在OSF 中,增加TIMP-1 的水平可导致细胞外基质平衡失调[12],槟榔成分中的游离铜离子促进OSF 中赖氨酸氧化酶的活性[13],以上这些均可促进胶原纤维的降解减少。
2.3 OSF 组织中细胞因子的调控改变
咀嚼槟榔时,粗糙的槟榔纤维损伤口腔黏膜,导致口腔黏膜上皮细胞的炎症和激活巨噬细胞分泌细胞因子。TGF-β是与OSF 进程相关的主要细胞因子,可调节肌成纤维细胞中α-SMA 和I 型胶原的表达[14-15]。槟榔碱也可上调其它细胞因子,如白细胞介素-1、白细胞介素-6、肿瘤坏死因子-α、血小板衍生生长因子(platelet derived growth factor,PDGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,b-FGF)和角化细胞生长因子1(keratinocyte growth factor 1,KGF-1);下调γ干扰素(interferon-γ,IFN-γ)而促进胶原合成。细胞因子的改变引起邻近损伤部位的成纤维细胞增殖和胶原的合成,因此形成OSF[16]。
3 OSF 的癌变
OSF 的口腔黏膜长期伴随着的慢性、持续性损伤导致创面愈合过程失败。OSF 的癌变(图1)是复杂的,它涉及乏氧、细胞周期、血管生成、上皮间质转化、基因调控等[17-18](图2)。
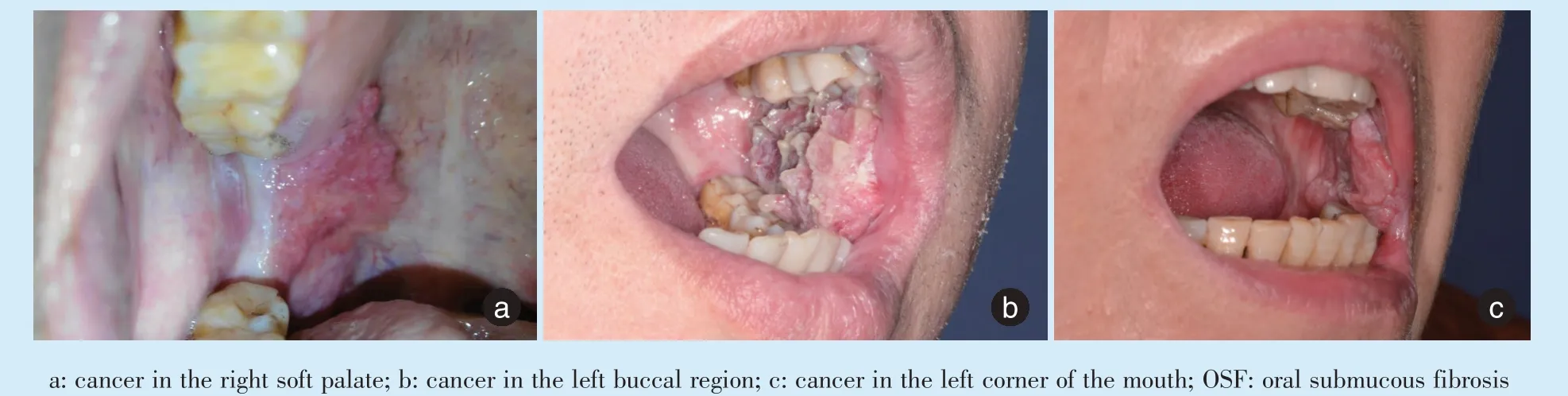
Figure 1 The transformation of OSF into oral cancer图1 口腔黏膜下纤维性变癌变为口腔癌
3.1 缺氧
缺氧是导致咀嚼槟榔者形成OSF 及其癌变的重要微环境因素[18-19]。低氧诱导因子-1α(hypoxiainducible factor-1α,HIF-1α)是对缺氧细胞反应的关键调节剂,而且在包括OSF 在内的各种纤维化性疾病中有较强的上调。HIF-1α也参与纤维增生相关的各种生长因子的上调,如血管内皮生长因子(vascular endothelial growth factor,VEGF)、TGFβ、成纤维细胞生长因子(fibroblast growth factor,FGF)、PDGF 和 上 皮 生 长 因 子 受 体(epidermal growth factor receptor,EGFR)。高压氧治疗增加氧张力,给供氧不足的组织供氧,可以作为纤维组织增生缺氧者的一种辅助治疗手段[20]。
3.2 OSF 癌变过程中细胞周期的基因调控

Figure 2 Possible events in the malignant transformation of oral submucous fibrosis图2 口腔黏膜下纤维性变癌变的可能事件解析
增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)指数与癌变潜能密切相关。PCNA 在OSF 上皮中的表达比正常口腔黏膜上皮要高,在异常增生性OSF 组与非异常增生组之间的表达差异有统计学意义[18]。细胞周期蛋白B1(Cyclin B1)、p34(CDC2)在G2/M 周期影响有丝分裂,在致癌作用中起着关键性的作用。相较于正常黏膜,以上分子在OSF 中上调,以上分子在OSF 与口腔鳞状细胞癌之间的表达差异具有统计学意义[21-23]。p63 与p53 一致,而且调节细胞的增殖与分化,可作为癌变的一种替代标记物[24-25]。
3.3 血管生成
许多血管生成相关的分子,如诱导型氧化氮合成酶(inducible nitric oxide synthase,iNOS)、b-FGF、TGF-β、PDGF 和HIF-1α,在OSF 中呈现高表达,而且促进其下结缔组织中的血管生成。血管生成的增加是缺氧导致进行性纤维化黏膜的一个适应性的反应。然而,一旦癌变发生,血管生成将促进肿瘤的生长[26]。槟榔碱的毒性可以降低OSF黏膜组织中的血管生成。连续组织形态学分析证实了在纤维性变后期黏膜下组织中血管生成降低。而当上皮有异常增生时,在上皮固有层中血管生成增加[27]。
3.4 OSF 癌变中上皮间质转换
在结缔组织纤维化的过程中,上皮细胞因受到槟榔中有害化学物质的长期、持久刺激,导致了口腔黏膜上皮细胞癌变过程的始发,促进了上皮间质转换[28]。上皮间质转化与OSF 的癌变有关,而且也参与咀嚼槟榔相关的OSF 的形成[29]。
4 OSF 的诊断
由于OSF 可癌变,为了帮助临床诊断和治疗计划的制订,活组织检查是必须的。在组织学分类上,成纤维细胞、胶原纤维、炎症细胞和血管的数量及分布被用来评估OSF 是最早期、早期、中期或晚期。近年来,有些学者主张将生物标记物如蛋白、mRNAs 和非编码RNAs 用来确定OSF 的分期及分类。虽然这些生物信息分析在与外科手术活检相比有减少侵袭性损伤的优点,但就目前而论,这些生物标记物的特异性有限,仍然不能取代经典的组织检查技术。
4.1 苏木素-伊红染色和特珠染色
苏木素-伊红染色(hematoxylin and eosin,HE)通常被用作对免疫组织化学染色的控制。HE 染色能把细胞核和细胞浆分别染成蓝紫色和粉红色而能清楚地显示基本组织的形态学特征。病理医师通过在特珠病例中的HE 染色和其它特珠染色及免疫组织化学染色做出诊断。上皮的改变、钉突的形态、上皮下致密胶原纤维带的沉积和炎症细胞被病理医师用来作为诊断OSF 的标准。也可以把Masson 染色和Van-Gieson 染色效果与苏木素-伊红染色进行比较。Mallory染色在判断复层鳞状上皮厚角化层、上皮下水肿、上皮下玻璃样变、骨骼肌束降解和玻璃样变区的重要改变最为有效[29]。
4.2 OSF组织中编码基因和蛋白生物标记物的检测
缺氧、细胞周期、血管生成和上皮间质转换的分子通路和分子与OSF 的病理改变密切相关。大多数OSF 病例黏膜上皮的基层和基层的上部存在PCNA 的阳性表达,在77%的病例中,在上皮浅层有PCNA 的阳性表达[30]。有学者使用蛋白质组学2维电泳(proteomic two-dimensional electrophoresis,2-DE)的方法检测OSF 组织中的亲环蛋白A(cyclophilin A,CYPA)生物学标记物来诊断OSF,亲环蛋白A 参与癌的形成、促进细胞增殖及通过胱天蛋白的灭活抑制细胞凋亡,胱天蛋白是OSF 的一个治疗靶点[31]。核受体激活剂7(nuclear receptor coactivator 7,NCOA7)是早期诊断OSF 癌变的潜在生物标记物,NCOA7 蛋白调节细胞周期和细胞的增殖,可通过细胞系、动物模型和口腔癌组织及邻近非癌性OSF 组织配对,使用激光辅助基质吸收离子图像质谱测定(matrix-assisted laser desorption ionization imaging mass spectrometry,MALDIIMS)分析技术,来确定NCOA7 是否存在[32]。槟榔碱以剂量依赖方式诱导HIF-1α蛋白的表达。HIF-1α在咀嚼槟榔者的成纤维细胞、上皮细胞和炎症细胞中有明显的上调。被激活的HIF-1α刺激PAI-1 表达及诱导OSF 的细胞外基质的集结。
4.3 OSF 组织中非编码基因生物标记物的检测
某些微小RNA(microRNAs)在冰冻或石蜡包埋组织中是稳定的,而且,低拷贝的微小RNA 能通过qRT-PCR 进行分析。miR-200b 和miR-200c 在OSF 组织中下调。槟榔碱减少miR-200c 在颊黏膜成纤维细胞中的表达。miR-200c 和miR-200b 分别通过靶标ZEB1 和ZEB2 上调E-钙粘蛋白。ZEB1 结合α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)启动子,诱导纤维形成时肌成纤维细胞内α-平滑肌肌动蛋白的高表达[33-35]。长链非编码RNA(long noncoding RNAs,lncRNA)LINC00974 在OSF组织或肌成纤维细胞中的表达异常上调,抑制LINC00974 可抑制肌成纤维细胞的活性,而过度表达LINC00974 则增加了肌成纤维细胞的活性;此外,在LINC00974 抑制的肌成纤维细胞中,TGF-β分泌和磷酸化Smad2 表达也受到抑制;槟榔碱通过LINC00974 介导的TGF-β信号传导激活促进肌成纤维细胞分化[36]。
5 治 疗
OSF 主要治疗方法有两类,即保守治疗与外科治疗。保守治疗包括物理治疗、药物治疗。
5.1 物理治疗
高压氧治疗可用于OSF 的物理治疗。高压氧治疗通过减少白细胞介素-1β和肿瘤坏死因子-α的产生,促进成纤维细胞的凋亡和抑制成纤维细胞的活性,加速所有组织的氧合作用,阻止如E-SOD、GPx、过氧化氢酶、二乙基对硝基苯磷酸酯和氧化血红素酶-1 的活性,有抗炎、抗氧化的特性,因而对OSF 产生治疗效果[37],但此法对双颊及软腭黏膜下纤维条索及张口度的改善效果仍需要更多临床数据的支持。
5.2 药物治疗
OSF 药物治疗的主要目的是抗炎和促进细胞外基质的降解。糖皮质激素阻止炎症介质和炎症反应,同时也阻止成纤维细胞的增殖和胶原纤维的集结。地塞米松、甲基氢化泼尼松和倍他米松是人工合成的具有糖皮质激素效果的药物,口服或在病变内注射以上药物可改善张口度和减轻烧灼感[38-40]。透明质酸酶和糜蛋白酶是蛋白溶解酶,与皮质类固醇合用,可使透明质酸和胶原等细胞外基质降解,在颊黏膜病变内注射加入0.5 mL 盐酸利多卡因的透明质酸酶1 500 IU,每周1 次,以缓解患者的口腔黏膜烧灼感和增加张口度。
己酮可可碱(pentoxifylline)是一种黄酮衍生物,主要用于治疗肌痛,可竞争性抑制硝酸二酯酶脂多糖刺激人体单核细胞以抑制TNF-α 的产生,阻止白细胞毒素的合成以减少炎症反应。己酮可可碱改善OSF 患者的张口度,减轻口腔黏膜的烧灼感,同时也改善吞咽和语言功能[38]。秋水仙碱早在公元1500 年就被用于治疗关节肿胀,在1961年被批准作药物使用。其药物机理是通过抑制中性白细胞和白细胞介素-1β的活性减轻炎症和缓解炎症反应,秋水仙碱对OSF的治疗效果是在2013年被首次报告的[41-42]。OSF 患者每次口服0.5 mg,每日2 次。
天然复合药物是从生物有机体中提取的纯化学物质,大多数天然复合药物是从传统中草药和食物中提炼出以用来治疗疾病的。
从传统中草药和食物中提炼的复合物包括:丁烯基酞内酯(butylidenephthalide)、甘草素(glabridin)、积雪草酸(asiatic acid)、丹参酮(tanshinone)和丹酚酸B(salvianolic acid B)。丁烯基酞内酯是从当归(angelica sinensis)或川芎(ligusticum chuanxiong)中提炼获取的。这些天然药物有保护神经、扩张血管、抗癌、抑制肝纤维化及炎症的作用[43-45]。甘草素来自于甘草的根,含有抗氧化和抗炎特性的异黄酮类或天然酚复合物。同时,这种药物也抑制α-SMA、TGF-β的功能和Ⅰ型胶原的合成[44]。积雪草酸是从中草药积雪草(centellaasiatica)中提炼而来,可改善纤维化,也能抑制人体黏膜内成纤维细胞中的TGF-β1 功能和阻止Ⅰ型胶原2 及Ⅲ型胶原纤维1 的合成[46-47]。丹参酮是从中药丹参中提取的,这种物质由二氢丹参酮Ⅰ、丹参酮Ⅰ和丹参酮ⅡA组成。此药有抗炎和抗氧化活性。丹参酮在OSF 中与被下调的p53 通路互相作用,体外实验显示,丹参酮抑制胶原的生物合成,增加胶原的降解[48-49]。丹酚酸B 也是从丹参(salvia miltiorrhiza)提取得到的,丹酚酸B 具有抗纤维化活性[50];丹参酮与皮质类固醇联合应用能改善张口度及口腔黏膜烧灼痛[50-51]。
具有潜在抗OSF 效用的其它天然复合物包括:没食子儿茶素(epigallocatechin-3-gallate,EGCG)、芦荟碱(aloe vera)、姜黄素(curcumin)、番茄红素和蜂蜜。没食子儿茶素是茶叶中最丰富的儿茶素,它是一种抗氧化剂,可阻止细胞的活性氧自由基[52],体外实验显示,没食子儿茶素抑制一些纤维形成基因如早期生长应答因子-1、TGF-β 的功能[53-54]。芦荟碱是由百合科植物中提取的物质,其含有各种矿物质和维生素类,而且具有抗炎活性。芦荟碱减少人体巨噬细胞内炎症因子的形成[55],在口腔医学中有着广泛应用[56]。Meta 分析结果显示,芦荟碱在OSF 治疗的前2 个月缓解烧灼感[57]。姜黄素来自于姜黄的根茎,是一种最常被用作为饮食的辅助佐料和食物添加料的自然酚类化合物。姜黄素有抗炎、抗氧化和抗癌作用,同时,也能抑制结缔组织生长因子、iNOS 的功能和减少成纤维细胞活性[58-59]。姜黄素能有效缓解OSF 口腔黏膜的烧灼感和改善张口度[60]。番茄红素是在西红柿和西瓜中发现的类胡萝卜素,它能减少脂质、蛋白质和DNA 的氧化损害。番茄红素的摄入可以减轻体内的氧化应力。临床研究证实,口服摄入番茄红素可改善开口度和缓解患者的烧灼感[61-62]。蜂蜜因其抗炎、抗氧化及抗菌特性而被用来帮助伤口愈合,蜂蜜抑制脂质氧化酶、白细胞介素-1、白细胞介素-10、COX-2 的表达及NF-κB 的信号通路,科学家们应用蜂蜜治疗如口臭、OSF、化疗性口炎、放射性口炎等口腔疾病[63-66]。把蜂蜜与姜黄素联合应用对OSF 的烧灼感有明显的缓解作用[67-68]。
关于对OSF 的治疗,笔者对早期和中期颊黏膜下纤维性变的患者,主要采用糖皮质激素曲安奈德与天然复合药物丹参酮联合行黏膜下局部注射。局部注射的曲安奈德为50 mg,加利多卡因2 mL,每侧颊黏膜下注射2 mL。先注射曲安奈德后,再每侧注射丹参酮液2 mL。每周1 次,10 次为1 疗程。1 个疗程完成后,休息30 d 后复诊,根据患者的张口度,决定第二疗程和第三疗程是否进行。当患者的开口度达到大于30 mm 以上时,局部注射治疗终止,这种方法的治疗总有效率可达93%[51]。
对于张口度小于10 mm 以下者,也可以采用手术治疗的方法。手术治疗主要是切除双侧颊部纤维组织后,可以采用局部植皮、生物膜、双侧鼻唇沟皮瓣及远位瓣转移修复治疗。这些治疗方法近期效果可靠,但远期效果的权威报告有限,仍然需要大量临床病例的远期观察总结报告的支持[69]。
6 展 望
OSF 从1951 年被发现至今已有69 年之久,但由于槟榔致OSF 和致癌的动物模型未复制成功,故对其致病及致癌的过程及机理仍未完全清楚,有待于系统深入的研究;对于诊断与治疗OSF 特异性的生物标记物仍未有确定,已被发现的生物标记物对OSF 的诊断与治疗的特异性有限,仍需要进一步的研究。目前已有的治疗方法,其临床治疗效果有待肯定和大数据的证实。这些科学问题的解决,将对保证患者生命的延长及生活质量的提高有着十分重要的意义。
【Author contributions】Jian Xinchun and Gao Xing wrote and revised the article. All authors read and approved the final manuscript as submitted.
