负载型Pt/CeO2催化剂上N2O的生成机理
2021-03-08楼锦泽李成业盛丽萍马朝霞杨杭生
楼锦泽,俞 剑,李成业,盛丽萍,马朝霞,杨杭生,王 勇
(浙江大学材料与工程学院,浙江 杭州 310027)
1 前 言
氧化亚氮(N2O),别名笑气,一方面是一种温室气体,其温室效应约是CO2的300倍[1-2],在平流层还生成·NO自由基并与O3发生反应,从而破坏臭氧层[3]。另一方面,N2O在医药,食品,化学工业和军事工业等领域同样有着重要的应用前景。例如,N2O可用作吸入式麻醉剂,在牙医领域,尤其是无痛麻醉领域得到广泛应用;也可用作食品工业中的喷雾剂,用来催化氧化苯制备苯酚。它还可用作半导体工业中的洗涤剂,火箭燃料的添加剂,等等。因此,近年来高效合成N2O仍受到关注。
大气中N2O最大的释放源是农业和森林自然土壤环境[4],占50%以上,通过反硝化和硝化的微生物过程产生,然而在土壤中产生的N2O只是作为中间产物难以富集。在工业上,生产N2O最重要的方法是硝酸铵(NH4NO3)分解,如式(1)所示[5]。然而,硝酸铵的热分解是高度放热反应,在高温下持续进行容易发生爆炸。而且硝酸铵主要由氨气和硝酸制取,其中硝酸是比氨气更为宝贵的原料,因为它本身是通过Ostwald法由氨气氧化制备的,所以式(1)本身虽然是一个简单反应,但从能量的角度分析,属于高能耗。Yates等[6]利用NH3直接氧化生成了N2O,其中NH3先是附着在V2O5催化剂上,然后N-H键断裂,N-O键结合,两个NO作为中间产物结合产生N2O,如式(2)所示,只是N2O选择性不高。据Wang等[7]报导,N2O也可以来自NO的歧化反应,如式(3)所示,然而这种方式产生的N2O微乎其微。随后的研究还发现,可以利用H2催化还原NO产生N2O,如式(4)所示,由于催化剂制备工艺较为复杂,也不常用。
NH4NO3→N2O+2H2O
(1)
NH3→NO→N2O
(2)
4NO→2N2O+O2
(3)
2NO+H2→N2O+H2O
(4)
N2O还是选择性催化还原(SCR)脱硝过程的副产物。从脱硝过程N2O的生成机理来看,Ettireddy等[8]使用含15N(15NO和15NH3)和18O(18O2)的组分在稳态条件下进行瞬态同位素标记,系统研究了Mn/TiO2催化剂上NO低温SCR的反应机理,结果发现所生成的N2O中的两个N原子,一个源于NH3,另一个源于NO,类似于N2的生成。
二氧化铈(CeO2)作为最重要的稀土氧化物之一,一直是催化领域深入研究的焦点。无论是纯CeO2,还是作为载体负载贵金属,都已广泛应用于各种领域,例如三效催化剂(TWCs),燃料电池,太阳能电池,氧传感器,抛光材料和紫外线阻隔材料,等等[9-14]。这是因为CeO2具有独特的氧化还原性能,强大的氧离子储存能力(OSC),以及Ce3+和Ce4+之间快速的转化能力。另外,CeO2的性质随着形态、尺寸、形状和表面积而显著变化[15-16],尤其是作为贵金属催化剂的载体,可以形成Me-O-Ce键,使贵金属高度分散并防止烧结,因此非常适合做贵金属催化剂的载体[18-21]。
基于目前还没有廉价高效的N2O制备途径,本研究受到SCR脱硝[8, 17]过程中会产生N2O的启发,制备了Pt/CeO2催化剂,研究利用氨气、NO、和氧气催化制备N2O的可行性,如式(5)所示。系统优化了Pt负载量以及反应条件对N2O产率的影响,并探讨了N2O生成机理。本实验的研究结果不仅为催化剂的设计和反应条件的优化提供了新的思路,还为工业化生产N2O提供了一种可行的方案。
4NH3+4NO+3O2→4N2O+6H2O
(5)
2 实 验
2.1 CeO2的制备
使用Ce(NO3)3·6H2O作为前驱体[14],将3.472 g的Ce(NO3)3·6H2O和38.4 g的NaOH分别溶解于20 mL和140 mL去离子水中。然后,将这两种溶液混合并搅拌30 min直至出现乳状浆液。将该混合物放入200 mL水热釜中180 ℃加热24 h。然后冷却至室温并将CeO2白色沉淀物离心分离,用去离子水和乙醇洗涤三次,最后在60 ℃下空气中干燥过夜,得到块状CeO2,用玛瑙研钵碾碎成为粉末备用。
2.2 CeO2上Pt的负载
将适量制备好的CeO2粉末和Pt(C5H7O2)2粉末在玛瑙研钵中研磨30 min得到混合粉末并置于马弗炉中,在300 ℃下煅烧4 h,然后在管式炉300 mTorr的压力下,通入H2∶N2=1∶9的混合气氛还原4 h,冷却后得到Pt/CeO2催化剂[18-20]。
2.3 催化剂表征
催化剂的实际Pt负载量由电感耦合等离子体等离子体/光学发射能谱法(ICP-OES,AGILENT 730)测定。催化剂的微观形貌利用透射电子显微镜观察(TEM,Tecnai G2 F20 S-TWIN FEI,200 kV加速电压)。晶体结构由SHIMADZU XRD-6000 X射线衍射仪(XRD)测定,光源为CuKα辐射(λ=0.15406 nm),2θ=10~90°,运行功率为3 kW。催化剂表面元素分布和价态利用Axis Supra型X射线光电子能谱(XPS)仪测试并分析,光源为AlKα(1486.6 eV),结合能通过位于284.6 eV的C1s峰进行标定。
H2程序升温还原 (H2-TPR)和NH3程序升温脱附 (NH3-TPD)利用Micromeritics AUTO Chem II 2920测试,实验时催化剂的用量为50 mg,H2和NH3的浓度利用配有热导检测器(TCD) 的气相色谱仪测试。H2-TPR测试时,将样品预处理放置在N2气氛下,以10 ℃/min的温度增量从20 ℃升至300 ℃,实验在5 vol.% H2混Ar气氛中进行,流速为 40 mL/min,加热速率为10 ℃/min。NH3-TPD实验时首先将样品放置在N2气氛下预处理, 300 ℃保温1 h后冷却至100 ℃。将预处理的样品暴露于4 vol.%的NH3(Ar)混合气氛中,流速为30 mL/min,保持3 h达到吸附平衡,然后以10 ℃/min的加热速率从100 ℃加热至600 ℃,获得NH3脱附的温度依赖性。
NOX程序升温脱附(NOX-TPD)实验时催化剂的用量为1000 mg。使用Testo AG testo 350记录NO和NO2信号。将样品放置在400 ℃下,1070 mg/Nm3NO和5 vol.%O2的气氛中2 h,冷却至100 ℃,然后进行N2吹扫。一旦NO信号返回到基线水平,开始程序升温,以10 ℃/min的加热速率从100 ℃加热至500 ℃。
N2O催化制备实验在固定床流动反应器内进行。将1 g的Pt/CeO2催化剂粉末样品涂覆在5块3 cm×10 cm的铝板上,置于间隔5 mm的反应槽中。反应条件:1070 mg/Nm3NO,300 mg/Nm3NH3,5 vol.% O2,载气为N2,总流速为500 mL/min,空速为36000 h-1。NO和NO2浓度使用NO-NO2-NOX分析仪(Testo AG testo 350)测量;N2O浓度利用N2O检测仪(Viasensor G200)测定;N2O选择性通过式(6)计算:
(6)
3 结果与讨论
3.1 结构分析
不同Pt负载量的Pt/CeO2样品的XRD图谱如图1所示,所有衍射峰都可归属于CeO2的面心立方相结构(萤石结构,JCPDS 34-0394,空间群Fm-3m)。样品的衍射峰尖锐,表明CeO2具有较好的结晶性。另外,没有观察到Pt的特征衍射峰,表明Pt的负载量较低并且高度分散在CeO2表面上。这是由于在煅烧过程中,样品中生成了Pt-O-Ce键,使Pt纳米颗粒高度分散并锚定在CeO2载体上[21]。
通过ICP-OES检测了Pt/CeO2样品的实际Pt负载量,详细数据如表1所示。从表中可以发现,实际负载量接近每个样品的理论值,证实了本实验采用的样品制备方法成功地在CeO2表面上负载了高度分散的Pt颗粒。
催化剂样品的微结构利用TEM观察分析。图2显示了不同Pt负载量的Pt/CeO2催化剂的典型TEM图像,以及Pt颗粒的粒径分布。其中,平均粒径通过Nano Measure计数多个Pt纳米粒子得到并列在表1中。如图2所示,随着Pt负载量的增加,Pt纳米颗粒尺寸不断增大,统计显示平均尺寸分别为0.86,1.0,1.46,2.34和3.33 nm。即增加Pt的负载量可以增大Pt纳米颗粒的尺寸,该结果与Zhang等[22]的报导一致。
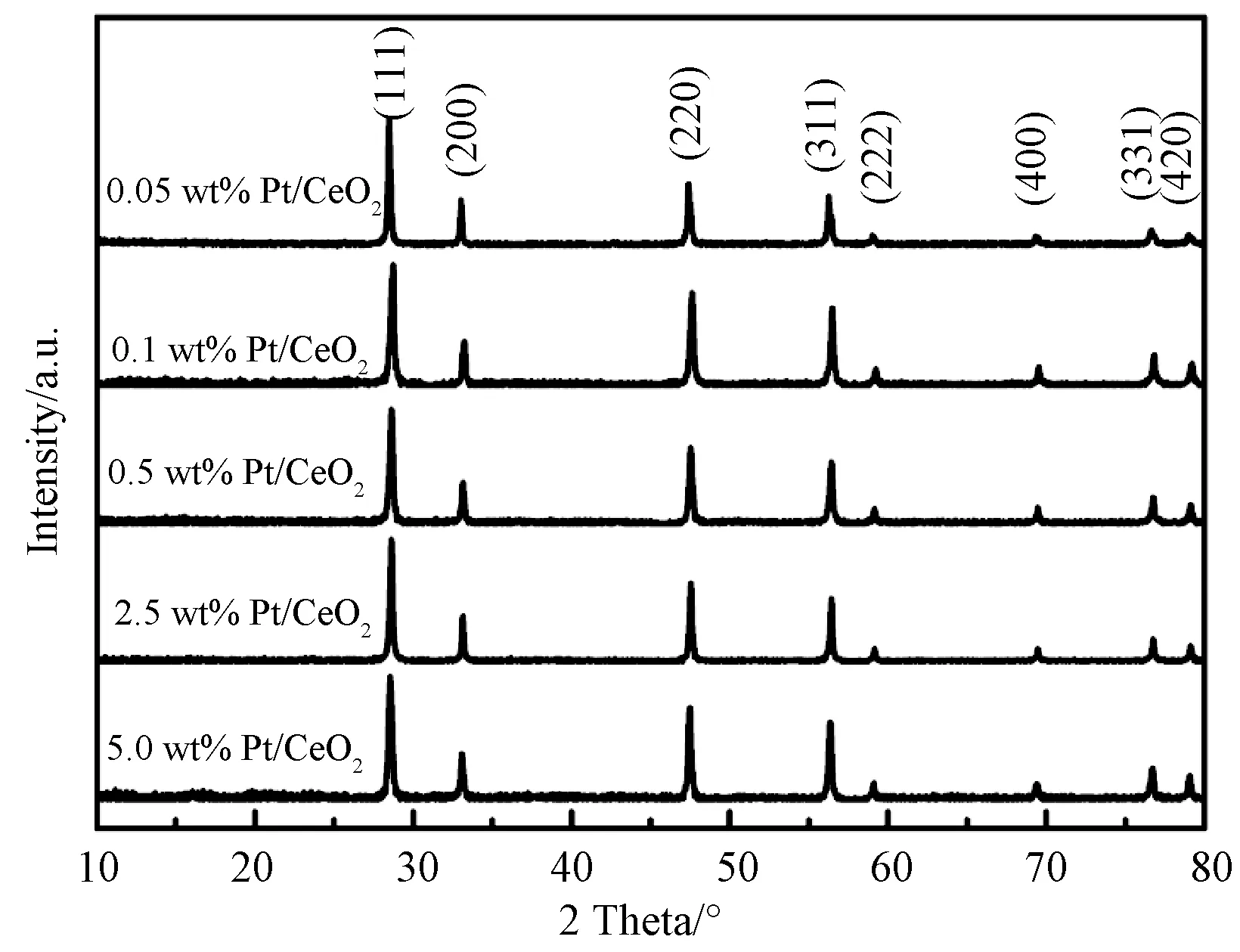
图1 不同Pt负载量Pt/CeO2样品的XRD图谱Fig.1 XRD patterns of the Pt/CeO2 samples with different Pt loading

表1 样品中Pt的实际负载量和平均粒径Table 1 Measured Pt loading and size distribution of the samples
3.2 XPS分析
利用XPS分析了催化剂表面化学状态,如图3所示,在Pt/CeO2样品的Ce 3d XPS能谱曲线中,标记为U和V的峰分别代表Ce 3d3/2和Ce 3d5/2。通过反卷积方法处理得到八个峰[23-24],其中:六个峰U‴ (916.1 eV),V‴ (897.6 eV),U (900.3 eV),V (881.9 eV),U″ (906.9 eV)和V″ (888.5 eV)源于Ce4+。另外两个峰U′ (901.9 eV) 和 V′ (883.9 eV)源于Ce3+,其通常视为氧化铈上氧空位存在的象征。Ce3+/(Ce3++ Ce4+)比例通过解卷积的峰面积计算得到,见表2。值得注意的是Ce3+的量与Pt负载量密切相关,具有较高Pt负载量的样品同样具有较高的Ce3+比例,这表明较高的氧空位浓度有利于提高催化剂的氧化还原能力。
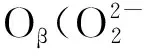

图2 Pt/CeO2样品的TEM图像(a, b, c, d和e)和尺寸分布图(f, g, h, i和j)Fig.2 TEM images (a, b, c, d and e) and size distribution (f, g, h, i and j) of the loading of Pt nanoparticles on Pt/CeO2 samples

图3 Pt/CeO2样品的Ce 3d的XPS图谱Fig.3 XPS spectra of Ce 3d of Pt/CeO2 samples
Pt的 4f XPS能谱曲线如图5所示。Pt的4f7/2可以解卷积成两个峰,结合能分布为71.1~71.4 eV和72.1~72.5 eV[26-27],而Pt的4f5/2具有74.3~74.6 eV和75.2~75.6 eV的两个成分。在71.1~71.3 eV和74.3~74.6 eV处的峰与Pt0物种相关;在72.1~72.5 eV和75.2~75.6 eV处 的峰与Pt2+物种相关。可见Pt颗粒大部分在0和+2价态,并且由于金属-载体强相互作用(SMSI效应),结合能在一定范围内波动[28]。Pt价态的百分比见表2,当Pt纳米颗粒低于1.45 nm时,Pt0/(Pt0+Pt2+)的含量随着尺寸增大而增大。然而,当Pt纳米颗粒大于1.45 nm时,含量随着尺寸增大而减小。据Grass等的报道[29],CO预处理后Rh颗粒表面氧化态比例随颗粒尺寸的增大而减小。本实验的样品通过氢气还原制备得到,生成的Pt0物种表面的量同样随着颗粒尺寸的增大而减小。颗粒尺寸小于1.45 nm时出现的异常现象可以用两种原因来解释。第一,当Pt粒径减小时,表面Pt-O键的强度增加,进而导致Pt不易被还原[30]。第二,小尺寸Pt纳米颗粒负载于CeO2载体中,金属载体电子相互作用(EMSI)起主导地位[31],电荷从具有低电离电位的负载颗粒(Pt)跑到可还原氧化物(CeO2)的表面。
图4 不同Pt负载量的Pt/CeO2样品的O 1s的XPS图谱Fig.4 XPS spectra of O 1s of different Pt/CeO2 samples
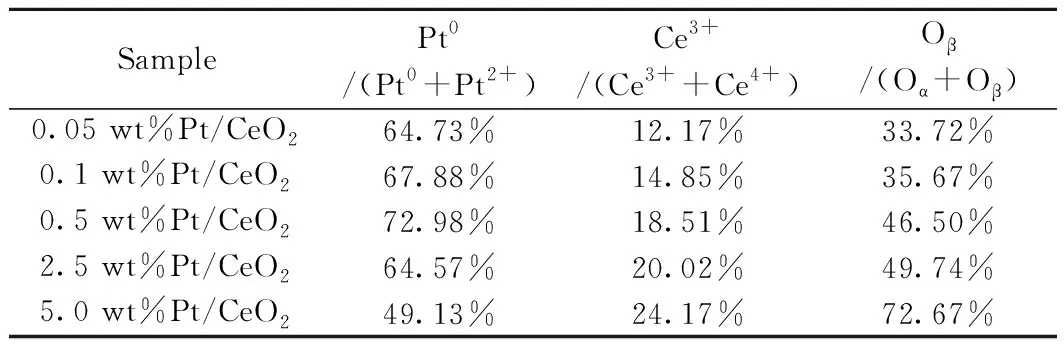
表2 XPS测定的表面Pt,Ce,O的价态分布Table 2 Surface valence distribution of Pt 4f, Ce 3d, O1s state calculated by XPS analysis
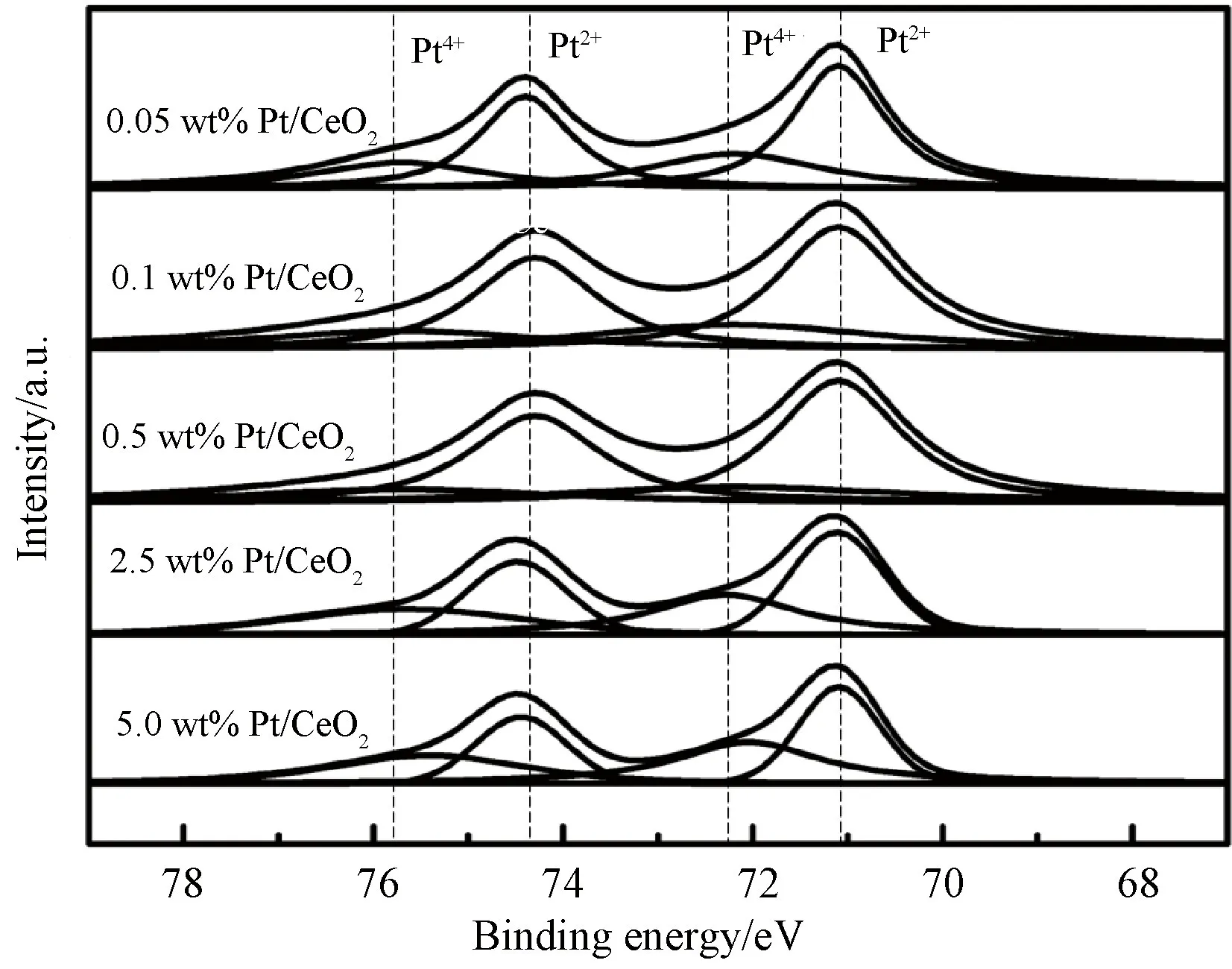
图5 不同Pt负载量的Pt/CeO2样品的Pt 4f的XPS图谱Fig.5 XPS spectra of Pt 4f of Pt/CeO2 samples
3.3 H2-TPR分析
利用H2-TPR研究分析了Pt/CeO2样品的氧化还原性能。贵金属如Pt,Pd和Rh的掺杂,对提高CeO2的还原性能起着重要作用[32]。如图6所示,对于纯CeO2,观察到约489 ℃的一个还原峰,源自表面和亚表面氧化物的还原。在负载Pt之后,曲线发生变化,在低于100 ℃的位置出现了一个小的还原峰,可归属于PtOX的还原;在400~500 ℃范围内的出现了一个较宽的还原峰,可归属于CeO2的还原峰,需要说明的是,随着Pt负载量的增加,CeO2的还原峰向低温方向偏移。说明Pt的负载提高了CeO2的氧化能力。此外,该还原峰的H2消耗量随Pt负载量的增加而明显增加。进一步说明Pt的引入活化CeO2表面/亚表面的Ce-O键。

图6 不同Pt负载量的Pt/CeO2样品的H2-TPR曲线Fig.6 H2-TPR profiles of Pt/CeO2 samples
3.4 NH3-TPD分析
利用NH3-TPD研究分析了0.5 wt% Pt/CeO2样品的表面酸性,如图7所示。图中出现在小于200 ℃的脱附峰归属于样品上的弱酸性位点,出现在200 ℃到450 ℃的脱附峰归属于样品上的中等酸性位点。NH3-TPD曲线显示,在400 ℃反应温度时,NH3仍然吸附在催化剂上,对N2O生成有促进作用[33]。
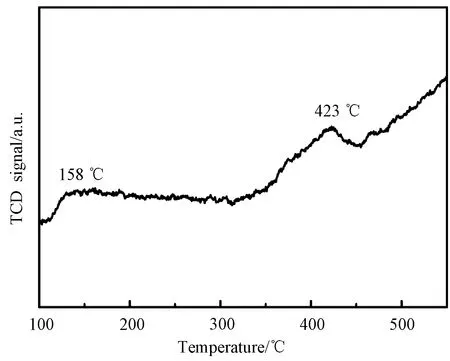
图7 0.5 wt% Pt/CeO2样品的NH3-TPD曲线Fig.7 NH3-TPD profile of 0.5 wt% Pt/CeO2 sample
3.5 NOX-TPD分析
图8显示了在100~500 ℃范围内的所有样品的NOX解吸附曲线。NO和NO2的解吸分别由亚硝酸盐物种和硝酸盐物种分解产生[33]。0.05 wt% Pt/CeO2,0.1 wt% Pt/CeO2,0.5 wt% Pt/CeO2,2.5 wt% Pt/CeO2和5 wt% Pt/CeO2催化剂解吸的NO浓度分别为41,81,152,84和 43 mg/Nm3。解吸的NO2浓度分别为 27.1,41.9,63.5,57.1和32.9 mg/Nm3。0.5 wt% Pt/CeO2的NO和NO2解吸峰值大于其他样品,表明0.5 wt% Pt/CeO2样品可在表面吸附了更多的NOX物质,对N2O的生成有促进作用[34]。
3.6 N2O生成催化性能测试
图9是在Pt/CeO2系列催化剂样品上制备N2O时N2O的选择性随温度的变化情况。在 150~400 ℃范围内,所有催化剂样品上N2O的选择性首先都随着温度的升高而升高并达到最佳值,然后进一步提高温度导致N2O选择性的降低,显示出火山型特征。图9还显示,随着催化剂中Pt负载量的增加,催化剂的最佳工作温度从250 ℃(0.05 wt% Pt/CeO2)升高到275 ℃(0.5 wt% Pt/CeO2),然后又降低到225 ℃(5.0 wt% Pt/CeO2)。此外,N2O选择性和产率都先随Pt负载量的增加而增加,在0.5 wt% Pt/CeO2催化剂上达到最大值85.1%,进一步增加Pt的负载量,导致催化活性的降低,可见催化性能同样呈现火山型,与Liu等[35-36]报导的实验现象一致。
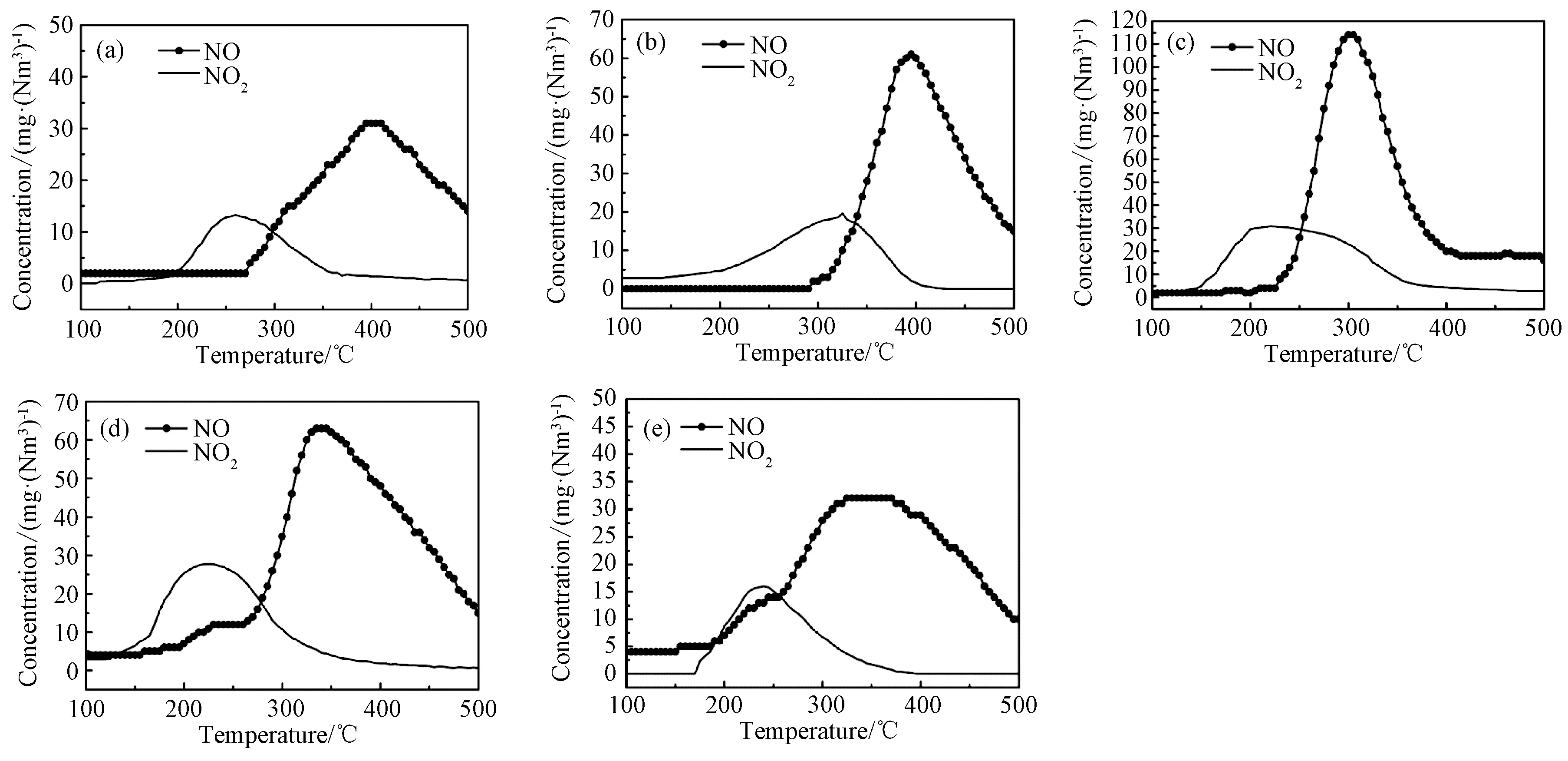
图8 不同Pt负载量的Pt/CeO2样品的NO-TPD曲线Fig.8 NO-TPD profiles of Pt/CeO2 samples with different Pt loading: (a) 0.05 wt% Pt/CeO2, (b) 0.1 wt% Pt/CeO2, (c) 0.5 wt% Pt/CeO2, (d) 2.5 wt% Pt/CeO2, (e) 5 wt% Pt/CeO2
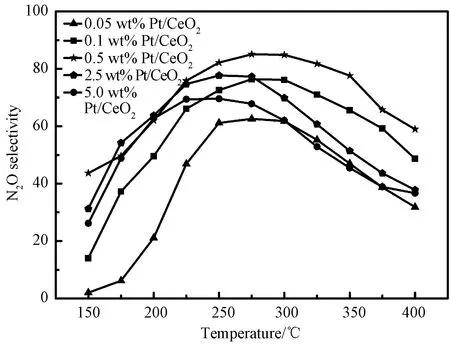
图9 不同温度下N2O选择性随Pt负载量的变化Fig.9 Temperature dependent of N2O selectivity over the Pt/CeO2catalysts with different Pt loading. (Reaction conditions: [NH3]=600 mg/Nm3, [NO]=535 mg/Nm3, [O2]=5 vol.%, [N2] as balance, GHSV=36,000 h-1)
3.7 反应气氛的影响
3.7.1NO/NH3比例的影响 由于NH3和NO参与N2O生成反应,因此有必要优化最佳NO/NH3比例。NO/NH3比例对N2O的选择性如图10所示。从图可见,当NO/NH3比例低于1/2时,N2O选择性和产率随着NO/NH3比例提高而显着提高,在1/2时达到85.1%,N2O的产率达到970 mg/Nm3。当该比例超过1/2时,N2O选择性开始下降。因此,NO/NH3=1/2是N2O生成的最佳比例。

图10 NO/NH3比例对N2O选择性和浓度的影响Fig.10 Effects of NO/NH3 ratio on N2O selectivity and concentration over 0.5 wt% Pt/CeO2 catalysts. Reaction conditions: [NH3]=600 mg/Nm3, [NO]/[NH3]=0~1.00, [O2]=5 vol.%, [N2] as balance, GHSV=36000 h-1, reaction temperature: 275 ℃
3.7.2O2浓度的影响 O2含量对N2O生成的影响如图11所示。从图可见,当反应气氛中没有O2时,几乎没有N2O生成,当O2浓度从0增加到1 vol.%时,催化活性显著增强,在150~300 ℃内随温度的升高N2O的选择性快速提升并达到64.8%,进一步升高温度却导致N2O选择性的显著下降。当O2浓度从1 vol.%增加到5 vol.%时,在低温区和高温区的N2O选择性显著增加,300 ℃时达到了85.1%。文献报导显示[37],反应气氛中的O2可以再生晶格氧,并补充化学吸附氧,这有利于催化反应和N2O的生成。 因此,反应气体中O2浓度的提升有利于N2O的生成,从图还可知,当O2浓度从1 vol.%升高到5 vol.%,最佳温度下N2O的产率与1 vol.% O2浓度相比,升高不多,因此文中O2浓度不再提高。
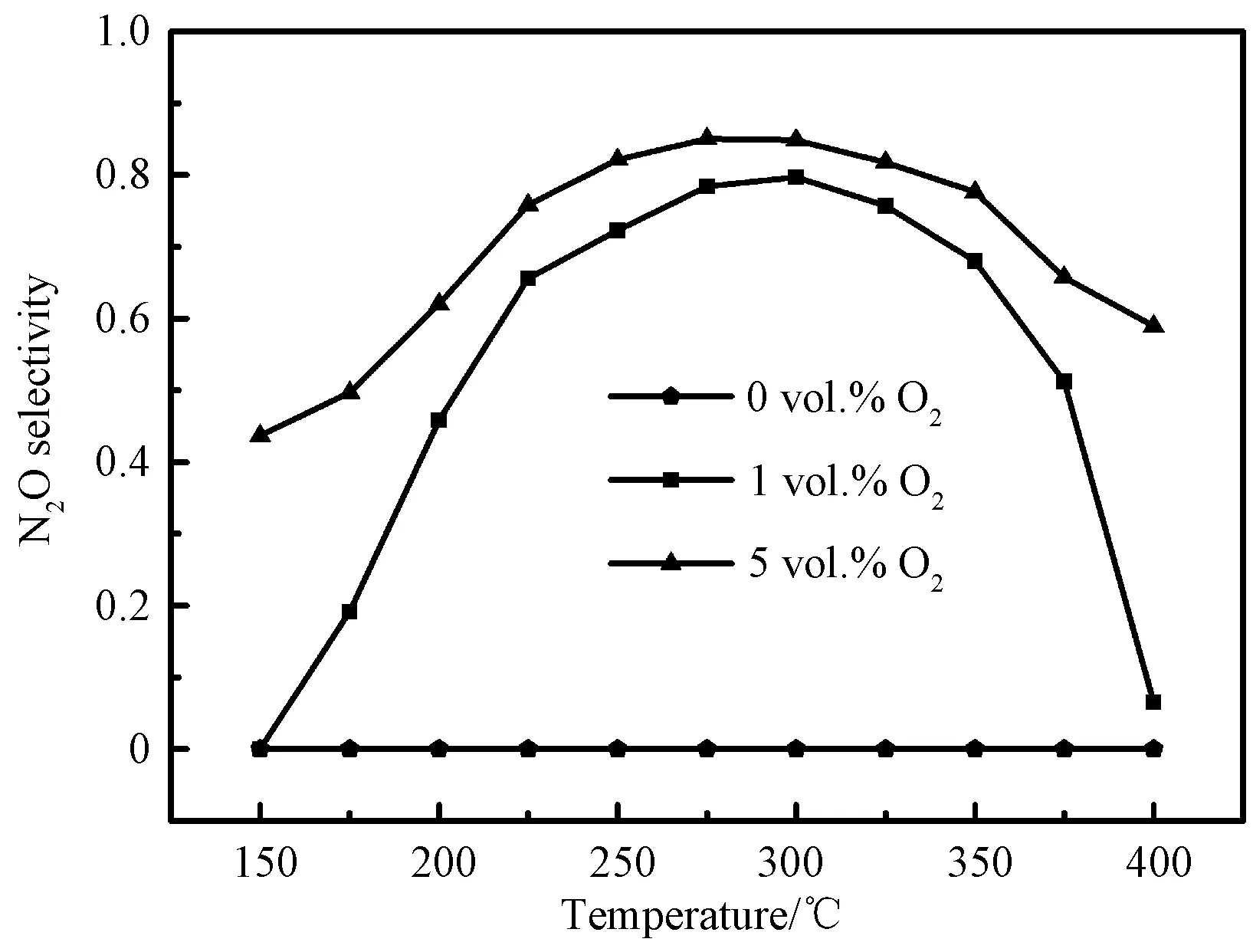
图11 O2浓度对N2O选择性的影响Fig.11 Effect of O2 concentration on N2O selectivity over 0.5 wt% Pt/CeO2 catalyst. Reaction conditions: [O2]=0 vol.%, 1 vol.%, 5 vol.%, [NH3]=600 mg/Nm3, [NO]=535 mg/Nm3, [N2] as balance, GHSV=36,000 h-1)
3.8 机理探究
Langmuir-Hinshelwood(L-H)和Eley-Rideal(E-R)机理是气固相催化反应中最常被接受的两种机制。对于Pt/CeO2上生成N2O的催化反应,从NH3-TPD曲线和NOX-TPD曲线可以看出,反应过程中在温度不超过400 ℃时NH3和NO都是以吸附形式存在于催化剂的表面。因此,该催化反应的主要路径应该遵循L-H机制。N2O生成的反应路径主要分三个阶段。
NH3(g)→NH3(ads)
(7)
NO(g)→NO(ads)
(8)
NH3(ads)→NH2(ads)→NH(ads)→N(ads)
(9)
NH3(ads)+H(ads)→NH4(ads)
(10)
NO(ads)+Ce-O(Pt)→ONO-Ce(Pt)
(11)
ONO-Ce(Pt)+O2→O2NO-Ce(Pt)
(12)
NH4(ads)+O2NO-Ce(Pt)→N2+H2O+Ce-O(Pt)
(13)
NH2(ads)+ONO-Ce(Pt)→N2+H2O+Ce-O(Pt)
(14)
NH(ads)+ONO-Ce(Pt)→N2O+HO(ads)+Ce-O(Pt)
(15)
N(ads)+ONO-Ce(Pt)→N2O+Ce-O(Pt)
(16)
第一阶段如式(7)和(8)所示,NH3和NO吸附在固相催化剂表面。其中Pt的作用主要体现在对NH3的活化,和NO的吸附的促进。第二阶段如式(9)~(12)所示,活性位点上的NH3被催化剂活化氧化,NH3中的N-H键断裂生成-NH2,-NH和-N活性基团,而产生的-H一部分与O2生成H2O,另一部分-H与晶格氧结合产生Brønsted酸,(Ce-OH)吸附NH3并生成NH4基团,如式(10)所示。NO则以亚硝酸盐的形式化学吸附在催化剂上,如式(11)所示。部分吸附的NO被氧化为单齿硝酸盐或者双齿硝酸盐,如式(12)所示[38]。第三阶段见式(13)~(16),吸附的氨物种与亚硝酸盐或硝酸盐反应分别产生N2和N2O,其中式(13)和(14)对应于脱硝反应生成N2,式(15)和(16)则产生N2O。
如图10所示,当反应气体中不含有NO时,N2O来自于NH3的氧化,部分NH3生成-N或者-NH自由基,而部分被过度氧化生成NO,然后通过式(15)和(16)生成N2O。可见当体系中引入NO后,可有利于N2O的生成。但是过多的NO同时也捕捉-NH2甚至-NH4+,当[NO]/[NH3]超过0.5时,过度消耗-NH2导致催化剂表面的-N或者-NH自由基的减少,反而抑制了N2O的生成。
如图11所示,当氧浓度略微增加时,催化活性显著增强。这是因为NH3在相对低的氧浓度条件下就可以被活化氧化,式(8)被加强,有更多的N-H键被断裂,这与Li等[39]报导的一致。当温度不断升高时,催化性能大幅度提升是源于NH3的活化能力的提升。当温度高于300 ℃时,催化性能的下降,是因为式(13)和(14)被激活,NH2捕获亚硝酸盐,式(15)反应随之减少,N2产物增多。另外,当催化剂的氧化能力的过度提升,如Pt负载量超过 0.5 wt%时,会促进亚硝酸盐在高温下与O2反应,生成硝酸盐,激活反应式(13)导致N2产物增多,抑制N2O的生成,这与图9的结果一致。
4 结 论
通过水热法结合固相研磨法制备了Pt/CeO2负载型催化剂。由于形成了Pt-O-Ce键,使Pt颗粒高度分散在催化剂载体的表面上。发现催化剂适中的氧化能力对NH3和NOX吸附能力是影响笑气产率的关键因素,因此N2O选择性和生成率都随着负载量和温度的变化呈现火山型,其中负载量为0.5 wt%的催化剂在275 ℃下具有最佳的催化活性。反应遵循Langmuir-Hinshelwood机理。本实验还优化了最佳的NO/NH3比例和氧浓度,发现在NH3浓度为600 mg/Nm3时生成N2O的最佳反应条件为:[NO]/[NH3]=1/2,[O2]=5 vol.%。本实验的研究结果不仅为催化剂的设计和反应条件优化提供了新的思路,还为工业化生产N2O提供了一种可行的廉价的方案。
