坦布苏病毒感染诱导雏鸭体内未折叠蛋白反应
2021-03-08赵冬敏黄欣梅章丽娇刘青涛杨婧韩凯凯刘宇卓李银
赵冬敏,黄欣梅,章丽娇,刘青涛,杨婧,韩凯凯,刘宇卓,李银
坦布苏病毒感染诱导雏鸭体内未折叠蛋白反应
赵冬敏,黄欣梅,章丽娇,刘青涛,杨婧,韩凯凯,刘宇卓,李银
江苏省农业科学院兽医研究所/国家兽用生物制品工程技术研究中心/农业部兽用生物制品工程技术重点实验室,南京 210014
【】检测坦布苏病毒在雏鸭体内诱导未折叠蛋白反应的信号通路(PERK、IRE1和ATF6),为揭示坦布苏病毒致病机制提供理论基础。取1日龄SPF雏鸭,腹腔接种坦布苏病毒(JS804株),于接种后12、24、36和48 h从对照组和攻毒组各取5只剖杀,分别取肝脏、心脏和脑组织,利用组织总RNA提取试剂盒提取各个组织样品总RNA,反转录获得cDNA。根据未折叠蛋白反应的3条信号通路,选取不同通路中的标志性分子,设计合成特异性引物,利用荧光定量PCR方法检测靶基因。以GAPDH为内参基因,采用相对定量法(2-ΔΔCt),分析靶基因的表达水平。雏鸭肝脏中坦布苏病毒含量最高,心脏次之,脑最低。对未折叠蛋白反应标志性分子GRP78的检测结果显示,脑和肝脏中GRP78表达量持续升高,并在攻毒后36 h达到顶峰(4.21倍和10.14倍),心脏中GRP78表达量仅在攻毒后36 h短暂升高(1.32倍)。PERK信号通路标志性分子ATF4表达水平在肝脏和脑中分别从攻毒后24 h和36 h持续升高至攻毒后48 h,并在攻毒后36 h达到顶峰(2.71倍和6.02倍),心脏中ATF4的表达量则仅在攻毒后36 h时升高(1.57倍)。IRE1信号通路标志性分子XBP1s在肝脏中的表达量升高最为显著(9倍),而脑中EDEM的表达量升高最为显著(3.87倍)且持续时间最长(从攻毒后12 h至攻毒后48 h)。与对照组相比,ATF6信号通路标志性分子GRP94和XBP1u均出现升高现象,虽然两种蛋白在不同组织中表达量变化的时间点和趋势不同,但均在攻毒后36 h出现峰值。首次报道了坦布苏病毒感染可在雏鸭体内激活未折叠蛋白反应的3条信号通路,本研究将有助于深入研究坦布苏病毒与宿主之间的相互作用机制。
坦布苏病毒;SPF雏鸭;内质网应激;未折叠蛋白反应;信号通路
0 引言
【研究意义】内质网是病毒蛋白折叠、装配与成熟的场所,病毒蛋白的大量合成常导致内质网应激。发生应激后,为了维持内质网稳态和功能,细胞随即启动未折叠蛋白反应(unfolded protein response,UPR)应对病毒感染导致的内质网应激。UPR不仅可以缓解内质网应激,还可调控细胞自噬与凋亡,调节炎症相关信号通路,抑制干扰素等天然抗病分子的表达,参与病毒致病过程[1]。因此,对UPR进行深入研究有助于阐明病毒的致病机制。坦布苏病毒(tembusu virus,TMUV)是一种危害鸭鹅的黄病毒属病毒,主要引起患病鸭鹅食欲急剧减退、产蛋量骤降、瘫痪及出血性卵巢炎,给鸭鹅养殖业造成了重大经济损失[2]。作为一种新发病原,TMUV的致病机制尚不明确。鉴于UPR在病毒感染及致病机制中的重要作用,本文针对TMUV感染后诱导雏鸭体内UPR进行探讨,不仅加深对TMUV致病机制的认识,也有利于TMUV感染的综合防控。【前人研究进展】坦布苏病毒属于黄病毒科、黄病毒属,病毒基因组为单股正链RNA,大小约为11 kb,可以直接作为mRNA翻译3种结构蛋白和7种非结构蛋白。黄病毒属病毒在细胞中复制的典型结构特征是病毒复制发生在细胞内质网,感染后病毒对宿主细胞内质网进行重塑[3]。内质网是真核细胞中一种重要的细胞器,具有多种生物学功能,如钙离子的储存、细胞内信号转导、跨膜和分泌型蛋白的合成和折叠等,接近三分之一的分泌型蛋白是在内质网中折叠和成熟的[4-5]。为了保证分泌蛋白可以正确折叠,内质网具有一套严谨和复杂的质量控制系统,如果错误折叠的蛋白在内质网腔中大量聚集则会影响其正常生理功能,从而导致内质网应激[6]。为了恢复内质网稳态,应对内质网应激,细胞会启动未折叠蛋白反应(unfolded protein response,UPR)。UPR可通过抑制新生蛋白的合成、降解驻留在内质网的病毒蛋白量或诱导促折叠伴侣分子表达等增强内质网功能[7]。UPR主要包括3条信号通路,分别由3种内质网驻留蛋白起始:双链RNA依赖的蛋白激酶样内质网激酶(PERK)、I型内质网转膜蛋白激酶(IRE1)和活化转录因子6(ATF6)[8]。在PERK信号通路中,真核翻译起始因子2的α亚基(eIF2α)被磷酸化后,抑制eIF2α启动的mRNA翻译,减少蛋白质合成,减轻内质网的负担。同时磷酸化的eIF2α上调激活转录因子4(ATF4)的表达,ATF4可依次上调下游转录因子C/EBPα-同源蛋白(CHOP,也称GADD153)和生长抑制DNA损伤基因34(GADD34)的表达。GADD34可与蛋白磷酸酶1(PP1)结合,水解eIF2αSer51位的磷酸基团,发挥反馈抑制作用,部分恢复蛋白的翻译[9-10]。在IRE1信号通路中,具有转录因子活性的剪切型X盒结合蛋白1(XBP1s)可诱导内质网相关降解蛋白(EDEM)和内质网相关降解途径(ERAD)中分子伴侣的表达,促进错误折叠蛋白的降解[11-12]。在ATF6信号通路中,ATF6被水解后释放出含有b-ZIP的转录激活功能域(ATF6p50),转位入核后,作为转录因子,与内质网应激响应元件(ERSE)结合,编码产生更多的分子伴侣,如GRP78、GRP94和蛋白二硫异构酶(PDI),提高内质网折叠蛋白的能力[13-14]。目前,很多研究报道黄病毒属病毒感染后可诱导UPR。登革病毒(DENV)感染后诱导的UPR途径具有时间依赖性:感染早期主要诱导PERK途径,随后该途径关闭,在感染的中晚期IRE1途径和ATF6途径依次开启[15]。西尼罗病毒(WNV)减毒株感染后可抑制PERK信号通路的开启,而具有神经毒力的强毒株感染诱导的UPR可开启3条信号通路[16-17]。日本乙型脑炎病毒(JEV)感染其易感细胞后可促进分子伴侣的表达[18]。此外,导致新生儿小头畸形和成人神经发育异常的寨卡病毒(ZIKV)可在体内、体外激活IRE1信号通路和ATF6信号通路,缓解ZIKV感染导致的内质网应激[19]。【本研究切入点】目前有关TMUV感染诱导UPR的研究较少,Zhao等[3]的研究表明TMUV感染BHK-21细胞后,可在不同时期诱导细胞启动不同的UPR信号通路,但是尚无TMUV感染后在体内诱导UPR信号通路的相关报道。【拟解决的关键问题】为了进一步研究TMUV感染后在雏鸭体内诱导的UPR信号通路,本文通过检测UPR不同信号通路中的靶分子表达水平,分析TMUV感染在雏鸭体内诱导的UPR,拓展对TMUV感染诱导UPR的认识,为阐明TMUV致病机理奠定理论基础。
1 材料与方法
1.1 试验材料
坦布苏病毒JS804株由江苏省农业科学院兽医研究所禽病与生物兽药研究室保存;SPF鸭胚购自中国农业科学院哈尔滨兽医研究所,自行孵化至出壳,置于隔离器中饲养。组织总RNA提取试剂盒购自Invitrogen公司。反转录试剂RT SuperMix for qPCR(+gDNA wiper)、2×ChamQ SYBR Master Mix购自南京诺唯赞生物科技有限公司。
1.2 试验方法
1.2.1 雏鸭攻毒试验 40只1日龄SPF雏鸭随机分为2组,分别为攻毒组和对照组,每组20只。攻毒组腹腔接种104TCID50TMUV JS804株病毒液,对照组仅接种相同体积的RPMI-1640培养液。将攻毒组和对照组隔离饲养,于攻毒后12、24、36和48 h,每组随机抽取5只剖杀,分别取肝脏、心脏和脑组织,置于-80℃保存备用。
1.2.2 RNA提取及cDNA合成 将每只雏鸭肝脏、心脏和脑分别用组织匀浆机处理,分别取0.1 g处理后的组织匀浆,加入0.2 mL Trizol,按照组织总RNA提取试剂盒的操作步骤提取组织总RNA。紫外分光光度计测定RNA浓度后,取1 μg RNA,利用反转录试剂RT SuperMix for qPCR(+gDNA wiper)反转录成cDNA,反转录产物于-20℃保存备用。
1.2.3 引物设计 选取UPR三条信号通路中的靶分子,设计SYBR Green I荧光定量PCR引物(表1),交由南京金斯瑞生物有限公司合成。
1.2.4 SYBR Green I荧光定量PCR检测不同组织中TMUV核酸拷贝数 将含有E基因片段的质粒pMD18- E在大肠杆菌DH5α中扩增,提取质粒,用Nanodrop2000分光光度计测定其浓度。根据质粒浓度和分子量,计算质粒的拷贝数。对已知含量的质粒进行10倍系列稀释,取1 μL作为阳性模板。用针对E基因的特异性引物(表1)对不同稀释度的质粒进行 SYBR Green I荧光定量PCR扩增。SYBR Green I荧光定量PCR反应体系总计20 μL,包括2×ChamQ SYBR Master Mix 10 μL,上下游引物(25μmol·L-1)各0.56 μL,阳性模板1 μL,ddH2O 7.88 μL。反应条件为94℃ 3 min,94℃ 10 s,60℃ 30 s(此阶段收集荧光信号),共40个循环。以ddH2O为模板作为空白对照。采集荧光数据,绘制E基因拷贝数和Ct值的标准曲线。
将反转录获得的不同组织cDNA用Nanodrop2000分光光度计进行浓度测定,用ddH2O调整至100 ng·μL-1。以组织cDNA为模板,用针对E基因的特异性引物进行 SYBR Green I荧光定量PCR检测。SYBR Green I荧光定量PCR反应体系总计20 μL,包括2×ChamQ SYBR Master Mix 10 μL,上下游引物(25 μmol·L-1)各0.56 μL,cDNA模板1 μL(100ng),ddH2O 7.88 μL。反应条件为94℃ 3 min,94℃ 10 s,60℃ 30 s(此阶段收集荧光信号),共40个循环。以ddH2O为模板作为空白对照。采集荧光数据,将不同组织的Ct值与标准曲线对比,计算不同组织中病毒的拷贝数。
1.2.5 SYBR Green I荧光定量PCR检测UPR靶分子 将反转录获得的cDNA用Nanodrop2000分光光度计进行浓度测定,用ddH2O调整至100 ng·μL-1。SYBR Green I荧光定量PCR反应体系总计20 μL,包括2×ChamQ SYBR Master Mix 10 μL,上下游引物(25 μmol·L-1)各0.56 μL,cDNA模板1 μL(100 ng),ddH2O 7.88 μL。反应条件为94℃ 3 min,94℃ 10 s,60℃ 30 s(此阶段收集荧光信号),共40个循环。以ddH2O为模板作为空白对照。采集荧光数据,数据分析采用相对定量法(2-ΔΔCt),以GAPDH为内参基因,分别计算攻毒组和对照组样品的循环阈值差值:ΔCt靶基因=Ct靶基因-Ct内参基因。以同一时间点对照组为对照,计算攻毒组靶基因的表达情况:ΔΔCt=攻毒组ΔCt靶基因-对照组ΔCt靶基因。

表1 引物序列
2 结果
2.1 不同组织中TMUV核酸的检测
雏鸭攻毒后,于攻毒后第12、24、36、48小时分别检测攻毒组和对照组不同组织中病毒核酸含量,结果发现,攻毒后12 h至36 h期间各组织中TMUV含量显著升高,在攻毒后36 h时3种脏器中TMUV核酸含量达到顶峰,脑、肝脏和心脏中TMUV核酸含量分别是攻毒后12 h时的105.66、104.94、105.9倍。在攻毒后48 h时3种脏器中TMUV核酸含量均稍有降低。比较3种脏器中TMUV核酸含量发现,肝脏中TMUV核酸含量最高,心脏次之,脑组织最低(图1)。在整个检测过程中,未从对照组组织中检测到TMUV核酸。
2.2 TMUV感染诱导GRP78表达情况检测
分子伴侣GRP78被认为是内质网应激和UPR的标志性分子,GRP78表达量升高说明存在内质网应激,UPR被激活。为了确定TMUV感染雏鸭后是否在体内激活UPR,在攻毒后第12、24、36、48小时分别检测攻毒组和对照组雏鸭不同组织中GRP78的表达情况。与对照组相比,脑组织中GRP78表达量在攻毒后12 h开始升高,并持续至攻毒后48 h。肝脏中GRP78表达量在攻毒后24 h升高,在攻毒后36 h达到顶峰(10.14倍),随后有所降低(5.33倍)。心脏中GRP78表达量仅在攻毒后36 h略有升高(1.32倍),其他时间点则未检测到GRP78表达量升高(图2)。上述结果说明,TMUV感染在雏鸭体内激活了UPR。
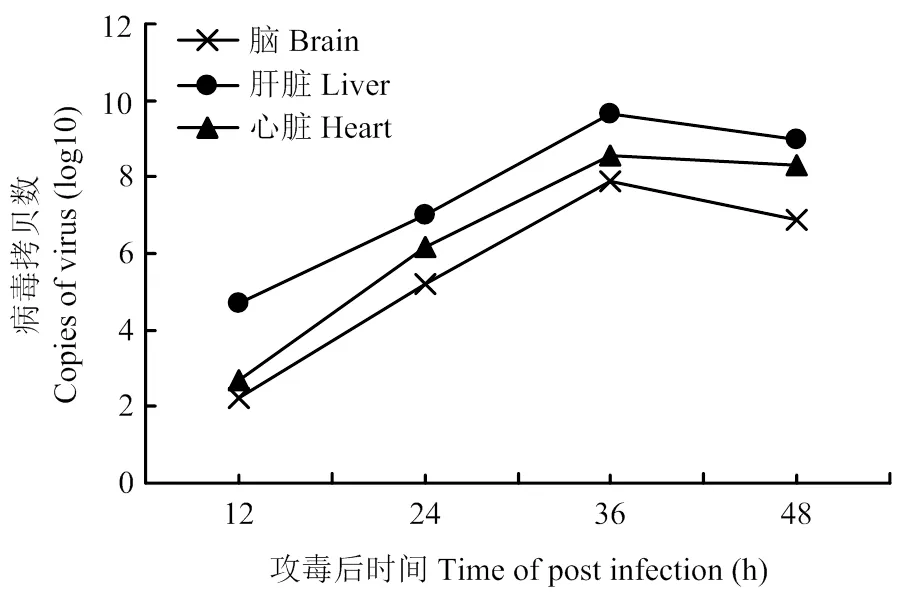
图1 不同组织中TMUV核酸的拷贝数
2.3 TMUV感染诱导PERK信号通路的检测
PERK信号通路开启后,磷酸化的eIF2α会优先起始ATF4 mRNA的翻译,因此,ATF4的表达水平可以反映UPR中PERK途径是否开启。与对照组相比,ATF4表达水平最先在肝脏中显著升高,从TMUV攻毒后24 h持续至攻毒后48 h。脑组织中ATF4的表达在攻毒后36 h开始显著升高并持续至48 h,而心脏中ATF4的表达则仅在攻毒后36 h时升高(1.57倍)。脑、肝脏和心脏中ATF4表达量的峰值均出现在攻毒后36 h(2.71倍、6.02倍、1.57倍)。上述结果显示,TMUV感染后可诱导PERK信号通路,但是不同脏器中开启该信号通路的时间不同(图3)。
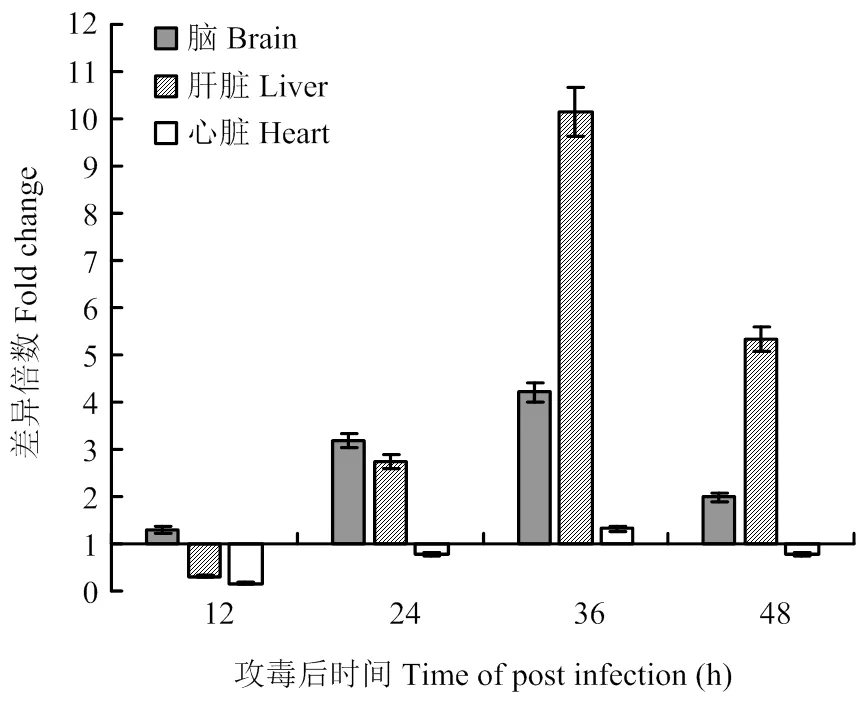
图2 不同组织中GRP78表达量的检测
2.4 TMUV感染诱导IRE1信号通路的检测
IRE1信号通路中,IRE1通过自身磷酸化作用激活其核糖核酸酶活性,剪切唯一底物XBP1mRNA,造成移码突变,编码新型XBP1蛋白,即剪切型XBP1(XBP1s)。XBP1s具有转录因子活性,可诱导EDEM等UPR相关靶基因表达。荧光定量PCR检测结果显示,TMUV感染后,攻毒组雏鸭脑、肝脏和心脏中XBP1s的表达量在攻毒后36 h达到峰值,随后开始降低,但仍显著高于对照组雏鸭的表达量,其中肝脏中XBP1s的表达量在3种脏器中升高最为显著(9倍)。与XBP1s不同的是,脑中EDEM的表达量最高,持续时间最长,说明TMUV感染能在脑中持续激活EDEM的表达。上述结果显示,TMUV感染后可诱导IRE1信号通路(图4)。
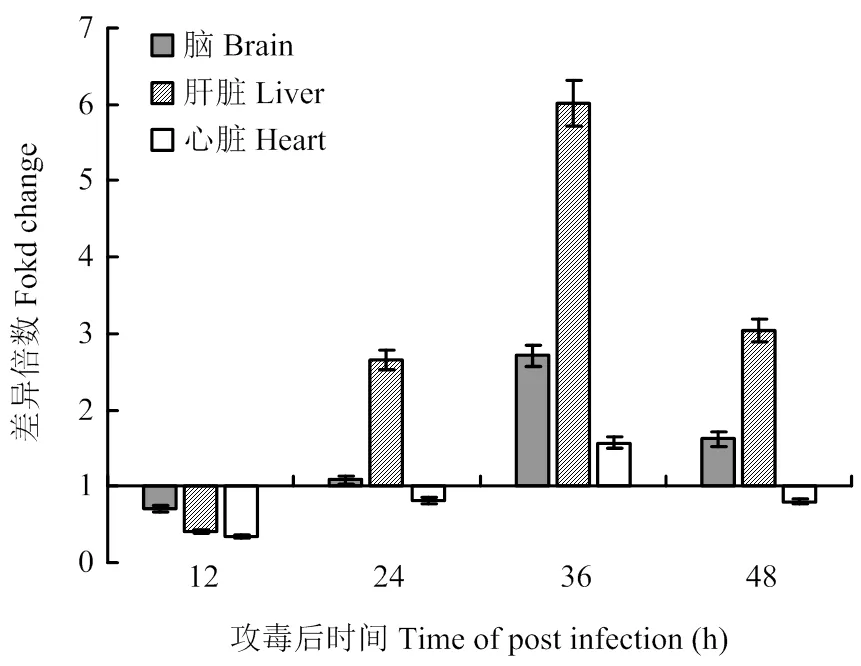
图3 不同组织中ATF4表达量的检测
2.5 TMUV感染诱导ATF6信号通路的检测
ATF6信号通路中,活化的ATF6可促进下游靶基因的表达。为了确定TMUV感染是否激活ATF6信号通路,分别检测了ATF6靶基因GRP94和非剪切型XBP1(XBP1u)的表达情况。如图5所示,与对照组相比,GRP94和XBP1u表达均出现升高现象,说明TMUV感染激活了ATF6信号通路,但不同组织中两者表达量变化的趋势和时间点存在不同。在脑组织中,TMUV感染未导致GRP94表达量发生大幅度变化,仅在攻毒后36 h略有升高(1.26倍);XBP1u则在攻毒后12 h出现升高并持续至攻毒后48 h(1.49、1.07、1.73和1.57倍)。在肝脏中,GRP94和XBP1u表达量变化的趋势一致,在攻毒后24 h开始上升,至攻毒后36 h出现峰值(4.93倍、4.73倍),随后略有降低,但仍显著高于对照组(2.83倍、3.14倍)。在心脏中,TMUV攻毒后48 h内仅在攻毒后36 h时检测到GRP94和XBP1u的表达量出现升高(1.26和1.39倍)。
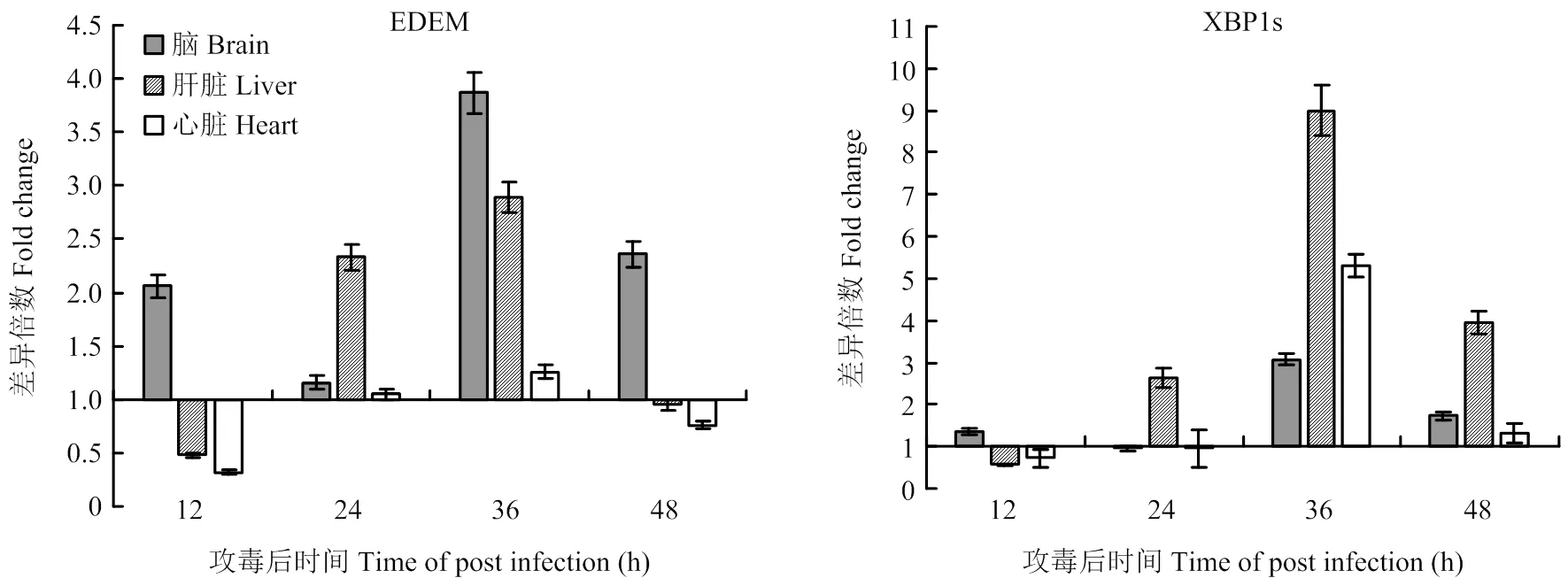
图4 不同组织中XBP1s、EDEM表达量的检测
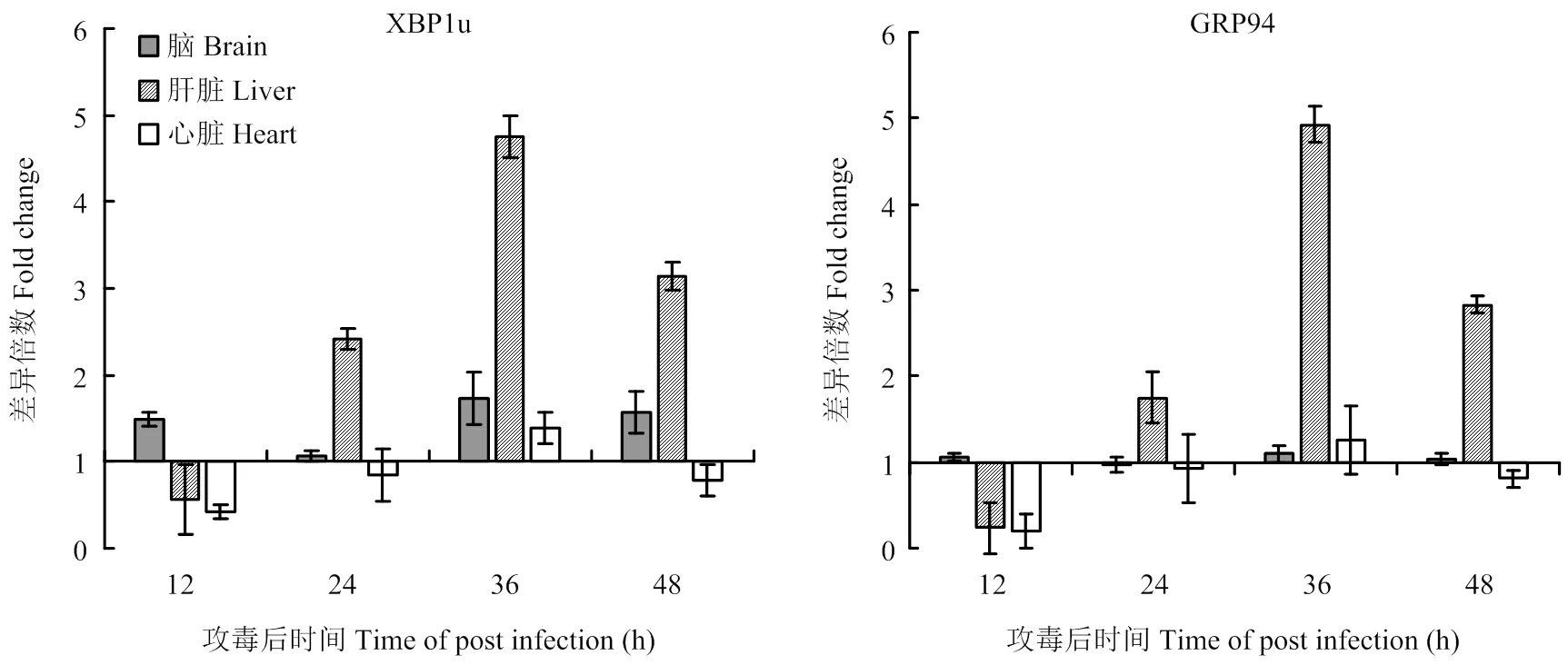
图5 不同组织中GRP94、XBP1u表达量的检测
3 讨论
病毒利用宿主资源促进其复制繁殖[20]。在这一过程中会在宿主细胞内合成大量病毒蛋白,造成未折叠蛋白或者错误折叠蛋白在内质网大量聚集,最终导致内质网应激[11]。为了缓解内质网应激,宿主通过激活3种感应器蛋白(PERK、IRE1和ATF6)提高内质网蛋白折叠能力,促进错误折叠蛋白的降解,这一应对机制被称为未折叠蛋白反应(UPR)[21]。UPR广泛存在于不同病毒感染的细胞中,如鸡马立克氏病毒、乙型肝炎病毒、疱疹病毒、流感病毒、猪圆环病毒、伪狂犬病毒及黄病毒属病毒等[22-26]。
黄病毒属病毒的病毒粒子在内质网腔组装和成熟[27]。研究表明,多种黄病毒属病毒,包括JEV、DENV、WNV和TBEV通过激活UPR缓解由病毒蛋白大量累积造成的内质网应激[11, 16, 28-29]。但是,目前尚未见TMUV感染后在宿主体内导致内质网应激和UPR激活的报道。
本课题组的前期研究及其它研究均表明,TMUV在体内和体外感染宿主后迅速开始复制繁殖,病毒滴度在感染后48 h内处于指数增长期[30-31]。由于病毒蛋白大量聚集是UPR的诱因,因此本研究在TMUV攻毒后48 h内对UPR进行了检测。鉴于其他黄病毒属病毒UPR的研究[16-19]及TMUV体外诱导UPR的研究[3]均在接毒后每隔12 h采样检测,因此本研究选取TMUV攻毒后12、24、36和48 h进行采样。由于缺少针对鸭源UPR靶分子的特异性抗体,本研究利用荧光定量PCR方法对雏鸭感染TMUV后不同组织中UPR信号通路进行了研究。
临床上患病鸭剖检常可见脑膜充血、出血,心肌水肿、松软,肝脏肿大,卵巢出血。人工攻毒试验中,病毒虽然广泛存在于各个脏器中,但是由于攻毒毒株不同、鸭的品种不同、攻毒日龄和途径不同、病毒检测的时间点不同,导致不同研究中病毒分布检测结果并不一致[30, 32-33]。综合临床患病鸭剖检结果和其它研究中人工攻毒试验结果,本研究检测了攻毒雏鸭脑、肝脏、心脏的病毒滴度和UPR。结果显示,TMUV感染雏鸭后,组织中病毒的含量在攻毒后36 h最高,其中肝脏中的病毒含量最高。虽然脑中病毒滴度在3种脏器中最低,但是在攻毒后36 h病毒拷贝数仍可达107.9,说明TMUV可在雏鸭脑内进行有效复制,这与临床上TMUV感染后常常导致瘫痪及脑炎样神经症状相符。
GRP78被认为是内质网应激和UPR的标志分子。正常状态时GRP78作为分子伴侣与PERK、IRE1和ATF6结合,使这些分子不能活化。内质网应激时GRP78与这些感应分子解离,使感应分子活化,启动从内质网到细胞核的信号级联放大效应,引发UPR[34]。GRP78的检测结果显示,虽然不同脏器GRP78表达量开始升高的时间点不尽相同,但是都在攻毒后36 h到达顶峰,以肝脏中GRP78表达量的变化最为显著(升高约10.14倍)。这些结果显示随着TMUV在组织内复制繁殖,合成大量病毒蛋白,导致内质网应激,激活UPR。
PERK信号通路主要通过降低宿主翻译水平,抑制新生蛋白合成,来缓解内质网应激[6]。本研究通过检测ATF表达水平反应PERK信号通路状态。在3种脏器中,TMUV攻毒后24 h肝脏最先激活PERK信号通路,脑中PERK信号通路在攻毒后36 h激活,两种脏器中PERK信号通路均可持续至攻毒后48 h,而心脏中PERK信号通路仅在攻毒后36 h时短暂开启,说明PERK信号通路可能不是心脏中UPR的主要信号通路。IRE信号通路主要通过降解错误折叠蛋白的方式恢复内质网稳态[11]。TMUV感染后,IRE1信号通路标志性分子sXBP1和EDEM表达水平都在攻毒后36 h达到峰值。脑的检测结果说明IRE1信号通路可能是TMUV感染后脑中UPR的主要信号通路。ATF6信号通路通过促进分子伴侣的表达提高内质网折叠蛋白的能力[7]。Zhao等报道BHK-21细胞感染TMUV后12 h至24 h短暂激活ATF6信号通路,但是该通路并不是TMUV激活的UPR的主要信号通路。然而,本研究的体内试验结果显示,ATF6信号通路从攻毒后24 h至攻毒后48 h持续激活,该通路标志性分子GRP94和XBP1u的表达量变化趋势说明ATF6是肝脏中UPR的主要信号通路之一,这些差异表明TMUV感染激活UPR信号通路在体内和体外存在不同。
病毒感染激活UPR的同时,也可利用UPR促进其自身复制繁殖并实现在细胞中的持续感染[35]。Ambrose等[36]报道WNVKUN感染ATF6缺失细胞后,eIF2α磷酸化水平升高,病毒蛋白合成和感染性病毒粒子释放均显著下降。Yu等[37]报道激活IRE1信号通路可抑制细胞凋亡,减轻内质网应激,促进病毒蛋白合成。He等[38]报道猪瘟病毒感染导致的内质网应激通过激活IRE1-XBP1-GRP78信号通路促进病毒复制。WNV和DENV通过激活ATF6信号通路调节信号转导和固有免疫应答促进病毒复制[36, 39]。这些研究表明,UPR在病毒复制过程中发挥关键作用。但是UPR在TMUV复制过程中作用的研究尚处于空白,有待后续研究。
4 结论
坦布苏病毒感染雏鸭24 h时在脑、肝脏、心脏中激活PERK、IRE1和ATF6信号通路,在感染后36 h达到高峰。肝脏中病毒含量最高,3条信号通路均被显著激活;心脏中病毒含量低于肝脏中病毒含量,其主要激活IRE1通路,PERK和ATF6通路仅在感染后36 h短暂激活;脑中主要激活PERK和IRE1通路,ATF6可被短暂激活但不作为主要通路。
[1] Janssens S, Pulendran B, Lambrecht B N. Emerging functions of the unfolded protein response in immunity. Nature Immunology, 2014, 15(10):910-919.
[2] Zhang W, Chen S, Mahalingam S, Wang M, Cheng A. An updated review of avian-origin Tembusu virus: a newly emerging avian Flavivirus. Journal of General Virology, 2017, 98(10): 2413-2420.
[3] Zhao D, Yang J, Han K, Liu Q, Wang H, Liu Y, Huang X, Zhang L, Li Y. The unfolded protein response induced by tembusu virus infection. BMC Veterinary Research, 2019, 15:34.
[4] Domínguez-Martín E, Hernández-Elvira M, Vincent O, Coria R, Escalante R. Unfolding the endoplasmic reticulum of a social amoeba: Dictyostelium discoideum as a new model for the study of endoplasmic reticulum stress. Cells, 2018;7(6). pii: E56.
[5] Winnay J N, Kahn C R. PI 3-kinase regulatory subunits as regulators of the unfolded protein response. Methods in Enzymology, 2011, 490:147-158.
[6] Oslowski C M, Urano F. Measuring ER stress and the unfolded protein response using mammalian tissue culture system. Methods in Enzymology, 2011, 490: 71-92.
[7] Cnop M, Toivonen, Igoillo-Esteve, Salpea P. Endoplasmic reticulum stress and eIF2α phosphorylation: The Achilles heel of pancreatic β cells. Molecular Metabolism, 2017, 6(9): 1024-1039.
[8] Harding H P, Zhang Y, Ron D. Protein translation and folding are coupled by an endoplasmic-reticulum-resident kinase. Nature, 1999, 397(6716):271-274.
[9] Harding H P, Novoa I, Zhang Y, Zeng H, Wek R, Schapira M, Ron D. Regulated translation initiation controls stress-induced gene expression in mammalian cells. Molecular Cell, 2000, 6(5): 1099-1108.
[10] Novoa I, Zeng H, Harding H P, Ron D. Feedback inhibition of the unfolded protein response by GADD34-mediated dephosphorylation of eIF2alpha. Journal of Cell Biology, 2001, 153(5): 1011-1022.
[11] Yu C, Achazi K, Niedrig M. Tick-borne encephalitis virus triggers inositol-requiring enzyme 1 (IRE1) and transcription factor 6 (ATF6) pathways of unfolded protein response.Virus Research, 2013, 178(2):471-477.
[12] Clarke R, Cook K L, Hu R, Facey C O, Tavassoly I, Schwartz J L, Baumann W T, Tyson J J, Xuan J, Wang Y, Wärri A, Shajahan A N. Endoplasmic reticulum stress, the unfolded protein response, autophagy, and the integrated regulation of breast cancer cell fate. Cancer Research, 2012, 72(6):1321-1331.
[13] Higa A, Chevet E. Redox signaling loops in the unfolded protein response. Cellular Signalling, 2012, 24(8):1548-1555.
[14] Yoshida H, Matsui T, Yamamoto A, Okada T, Mori K. XBP1 mRNA is induced by ATF6 and spliced by IRE1 in response to ER stress to produce a highly active transcription factor. Cell, 2001, 107(7):881-891.
[15] PeNa J, Harris E. Dengue virus modulates the unfolded protein response in a time-dependent manner. The Journal of Biological Chemistry, 2011, 286(16):14226-14236.
[16] Ambrose R L, Mackenzie J M. West Nile virus differentially modulates the unfolded protein response to facilitate replication and immune evasion. Journal of Virology, 2011, 85(6):2723-2732.
[17] Medigeshi G R, Lancaster A M, Hirsch A J, Briese T, Lipkin W I, Defilippis V, Früh K, Mason P W, Nikolich- Zugich J, Nelson J A. West Nile virus infection activates the unfolded protein response, leading to CHOP induction and apoptosis. Journal of Virology, 2007, 81(20):10849-10860.
[18] Su H L, Liao C L, Lin Y L. Japanese encephalitis virus infection initiates endoplasmic reticulum stress and an unfolded protein response. Journal of Virology, 2002, 76(9):4162-4171.
[19] Tan Z, Zhang W, Sun J, Fu Z, Ke X, Zheng C, Zhang Y, Li P, Liu Y, Hu Q, Wang H, Zheng Z. ZIKV infection activates the IRE1-XBP1 and ATF6 pathways of unfolded protein response in neural cells. Journal of Neuroinflammation, 2018;15(1):275.
[20] He B. Viruses, endoplasmic reticulum stress, and interferon responses. Cell Death & Differentiation, 2006, 13(3):393-403.
[21] Bertolotti A, Zhang Y, Hendershot L M, Harding HP, Ron D. Dynamic interaction of BiP and ER stress transducers in the unfolded-protein response. Nature Cell Biology, 2000, 2(6): 326-332.
[22] Frabutt D A, Wang B, Riaz S, Schwartz R C, Zheng Y H. Innate sensing of influenza A virus Hemagglutinin glycoproteins by the host endoplasmic reticulum (ER) stress pathway triggers a potent antiviral response via ER-associated protein degradation. Journal of Virology, 2017, 92(1). pii: e01690-17.
[23] Chan S W. The unfolded protein response in virus infections. Frontiers in Microbiology, 2014, 5:518.
[24] Smith J A. Regulation of cytokine production by the unfolded protein response; implications for infection and autoimmunity. Frontiers in Immunology, 2018, 9:422.
[25] Ouyang Y, Xu L, Lv J, Hou Y, Fan Z, Xu P, Jiang Y, Wu M, Li R, Zhang Y, Guo K. Porcine circovirus type 2 ORF5 protein induces endoplasmic reticulum stress and unfolded protein response in porcine alveolar macrophages. Archives of Virology, 2019, 164(5): 1323-1334.
[26] Yang S, Zhu J, Zhou X, Wang H, Li X, Zhao A. Induction of the unfolded protein response (UPR) during pseudorabies virus infection. Veterinary Microbiology, 2019, 239:108485.
[27] Martín-Acebes M A, Merino-Ramos T, Blázquez A B, Casas J, Escribano-Romero E, Sobrino F, Saiz J C. The composition of West Nile virus lipid envelope unveils a role of sphingolipid metabolism in flavivirus biogenesis. Journal of Virology, 2014, 88(20):12041-12054.
[28] Knowlton A A, Grenier M, Kirchhoff S R, Salfity M. Phosphorylation at tyrosine-524 influences nuclear accumulation of HSP72 with heat stress. American Journal of Physiology-heart and Circulatory Physiology, 2000, 278(6): 2143-2149.
[29] Wu Y P, Chang C M, Hung C Y, Tsai M C, Schuyler S C, Wang R Y. Japanese encephalitis virus co-opts the ER-stress response protein GRP78 for viral infectivity. Virology Journal, 2011, 8:128.
[30] Zhang L, Li Z, Zhang Q, Sun M, Li S, Su W, Hu X, He W, Su J. Efficacy assessment of an inactivated Tembusu virus vaccine candidate in ducks. Research in Veterinary Science, 2017, 110:72-78.
[31] Yang Z, Wang J, Wang X, Duan H, He P, Yang G, Liu L, Cheng H, Wang X, Pan J, Zhao J, Yu H, Yang B, Liu Y, Lin J. Immunogenicity and Protective Efficacy of an EB66® Cell Culture-Derived Duck Tembusu Virus Vaccine. Avian Pathology, 2020, 1-37 [Epub ahead of print].
[32] 李宁, 石迎, 吕传位, 岳瑞超, 刘思当. 鸭坦布苏病毒对雏鸭的致病性研究. 畜牧兽医学报, 2015, 46(3): 476-481.
LI N, SHI Y, LÜ C W, YUE R C, LIU S D. Pathogenicity of duck tembusu virus for ducklings. Acta Veterinaria et Zootechnica Sinica, 2015, 46(3): 476-481. (in Chinese)
[33] Li N, Wang Y, Li R, Liu J, Zhang J, Cai Y, Liu S, Chai T, Wei L. Immune responses of ducks infected with duck Tembusu virus. Frontiers in Microbiology, 2015, 6:425.
[34] Diwaker D, Mishra K P, Ganju L. Effect of modulation of unfolded protein response pathway on dengue virus infection. Acta Biochim Biophys Sin (Shanghai), 2015, 47(12):960-968.
[35] BlAzquez A B, Escribano-Romero E, Merino-Ramos T, Saiz J C, Martín-Acebes M A. Stress responses in flavivirus- infected cells: activation of unfolded protein response and autophagy. Frontiers in Microbiology, 2014, 5:266.
[36] Ambrose R L, Mackenzie J M. ATF6 signaling is required for efficient West Nile virus replication by promoting cell survival and inhibition of innate immune responses. Journal of Virology, 2013, 87(4):2206-2214.
[37] Yu C Y, Hsu Y W, Liao C L, Lin Y L. Flavivirus infection activates the XBP1 pathway of the unfolded protein response to cope with endoplasmic reticulum stress. Journal of Virology, 2006, 80(23):11868-11880.
[38] HE W, XU H, GOU H, YUAN J, LIAO J, CHEN Y, FAN S, XIE B, DENG S, ZHANG Y, CHEN J, ZHAO M. CSFV infection up-regulates the unfolded protein response to promote its replication. Frontiers in Microbiology, 2017, 8:2129.
[39] YIN H, ZHAO L, JIANG X, LI S, HUO H, CHEN H. DEV induce autophagy via the endoplasmic reticulum stress related unfolded protein response. PLoS One, 2017, 12(12):e0189704.
The Induction of Unfolded Protein Response in Tembusu Virus Infected Ducklings
ZHAO DongMin, HUANG XinMei, ZHANG LiJiao, LIU QingTao, YANG Jing, HAN KaiKai, LIU YuZhuo, LI Yin
Institute of Veterinary Science, Jiangsu Academy of Agricultural Sciences/Key Laboratory of Veterinary Biologicals Engineering and Technology, Ministry of Agriculture/National Center for Engineering Research of Veterinary Bio-products, Nanjing 210014
【】The aim of this study was to determine the signal pathways (PERK, IRE1 and ATF6) of unfolded protein response induced by tembusu virus in ducklings, so as to provide a theoretical basis for elucidating the pathogenesis of TMUV.1-day-old SPF ducklings were infected intraperitoneally with TMUV (JS804). Ducklings inoculated in the same manner with equal volume of RMPI-1640 were used as negative control. Five ducklings from each group were euthanized at 12, 24, 36 h and 48 h post infection, and their brains, livers and hearts were collected. The total RNAs were extracted from collected tissues by using total RNA extraction kit. Then the total RNAs were reverse transcribed into cDNA. Specific target genes representing the three known pathways of unfolded protein response were selected, and the primers were designed based on the published GenBank sequence. The relative expression of target genes was quantified by real time PCR. Real time PCR data were analyzed using the comparative Ct method (2-ΔΔCt). GAPDH was chosen as a reference gene for internal control. 【】 In three organs from infected ducklings, it was observed that the viral titers were the highest in the liver, lower in the heart, and the lowest in the brain. The unfolded protein response was characterized by upregulated expression of GRP78. The relative expression of GRP78 in the brain and liver were persistently upregulated and reached a peak at 36 h post infection (4.21 fold and 10.14 fold, respectively). GRP78 expression in the heart was upregulated transiently at 36 h post infection (1.32 fold). ATF4 expression represented the activation of PERK pathway. The ATF4 expression in the liver and brain were persistently upregulated from 24 h and 36 h post infection to 48 h post infection respectively, and peaked at 36 h post infection (2.71 fold and 6.02 fold, respectively). However, the upregulation of ATF4 expression in the heart was observed at 36 h post infection (1.57 fold). The activation of IRE pathway was characterized by XBP1s. In the liver, the expression level of XBP1s increased most significantly (9 fold). In the brain, the expression level of EDEM enhanced most significantly (3.87 fold) and persistently upregulated from 12 to 48 h post infection. Comparing to negative control, the expression of ATF6 pathway marker GRP94 and XBP1u were upregulated in three tissues, which reached a peaked at 36 h post infection, although expression profiles of GRP94 and XBP1u were different at indicated time points. 【】 It was the first report that TMUV infection induced three branches of unfolded protein response in ducklings, and these results might be helpful for understanding the interaction between tembusu virus infection and host response.
Tembusu virus; SPF ducklings; endoplasmic reticulum; unfolded protein response; signaling pathway

10.3864/j.issn.0578-1752.2021.04.016
2020-03-17;
2020-07-10
国家自然科学基金(31802222)、国家重点研发计划(2017YFD0500804)、江苏省农业科技自主创新资金(CX(18)3017)
赵冬敏,Tel:025-84390047;E-mail:zhaodongmin126@126.com。通信作者李银,Tel:025-84391687;E-mail:muziyin08@163.com
(责任编辑 林鉴非)
