243份云南普通小麦地方品种抗条锈病鉴定及分子标记检测
2021-03-08习玲王昱琦杨修朱微陈国跃王益覃鹏周永红康厚扬
习玲,王昱琦,杨修,朱微,陈国跃,王益,覃鹏,周永红,康厚扬
243份云南普通小麦地方品种抗条锈病鉴定及分子标记检测
习玲1,王昱琦1,杨修1,朱微1,陈国跃1,王益1,覃鹏2,周永红1,康厚扬1
1四川农业大学小麦研究所/西南作物基因资源发掘与利用国家重点实验室,成都 611130;2云南农业大学农学与生物技术学院,昆明 650201
【】小麦条锈病由条形柄锈菌小麦专化型(f. sp,)引起的气传性真菌病害,是世界范围内最具破坏性的小麦病害之一。发掘抗病资源和培育抗病品种是防治条锈病最经济有效的措施。通过鉴定和评价云南小麦地方品种对中国当前流行的条锈菌生理小种的抗性水平,综合分析可能携带的抗条锈病基因,为小麦抗病育种提供理论依据。利用当前中国小麦生产上毒性强、流行频率高的条锈菌生理小种CYR32和CYR34对243份云南小麦地方品种进行苗期抗病性鉴定,成株期使用CYR32、CYR33、CYR34和贵农致病类群等混合生理小种进行抗性鉴定,并利用小麦生产上重要抗条锈病基因、、、、、、、、、、、、、、和的紧密连锁标记对供试材料进行分子检测。在243份小麦材料中,18份种质对CYR32表现苗期抗性,32份种质对CYR34表现苗期抗性,对CYR32和CYR34均表现苗期抗病的有8份,占3.29%。结合苗期和成株期抗性鉴定,174份地方种质表现为稳定的成株期抗性,占71.6%,其中105份种质高抗条锈病。分子检测结果显示,携带、、、、和抗性基因的材料分别有48、44、4、6、4和101份。同时携带2、3和4个抗性基因的材料各有34、4和1份。所有供试材料均未检测到、、、、、、、、和。此外,74份地方种质未检测到以上所有抗性基因,其中58份具有成株期抗性,可能携带其他已知或新的条锈病抗性基因。云南小麦地方品种作为中国特有的小麦种质资源,具有优良的条锈病抗性。243份供试小麦品种对当前条锈菌流行小种抗性水平整体偏高,筛选得到174份具有稳定抗性的地方种质,同时有74份可能携带其他已知或未知的抗性基因,可作为进一步挖掘抗条锈病新基因或QTL的亲本来源。
小麦地方品种;条锈病;抗病鉴定;分子标记;
0 引言
【研究意义】小麦是世界范围内广泛种植的三大粮食作物之一,是35%以上人口的主粮,每年在不同的地理区域种植面积约为2亿hm2[1]。小麦条锈病是由条形柄锈菌小麦专化型(f. sp.,)引起的气传性真菌病害,具有波及范围广、危害面积大、破坏性强等特点,条诱病发生后主要危害其叶片,严重时可危害叶鞘,甚至是穗部,它是现代冬季谷物生产中最具破坏性的植物病害之一[2]。条锈菌较高的繁殖率和长距离传播,使其危害范围覆盖西北、华北、西南、黄淮海及长江中下游等地区;使小麦每年减产10%—70%,严重年份甚至绝收。由于病原体的快速进化和新的毒力小种的出现,常常导致抗病品种丧失抗性,发掘抗病资源和培育推广抗病品种被认为是防止条锈病危害、确保小麦高产稳产最具成本效益和生态可持续的方法[3]。2009年起源于甘肃南部和四川成都地区的条锈病致病类型CYR34,近年来出现频率升高,使目前育种中广为利用的重要抗源贵农22丧失抗性,抗条锈病基因、、相继失效,给条锈病防治工作带来新的挑战[4]。截至目前,虽然已有83个(—)小麦抗条锈病基因被正式命名,300多个暂命名基因或QTL被报道,但仍然面临着许多矛盾,例如毒力小种变异频率高,抗性品种培育速度慢,抗性基因发掘较多但运用到小麦育种中的却很少[5]。因此,要实现抗条锈病基因的高效利用就要明确小麦中抗性基因的分布情况。【前人研究进展】随着分子生物学技术的快速发展,基于DNA多态性的分子标记是目前定位小麦抗性基因应用最广泛的,包括SSR、STS、CAPS、KASP等[6]。通过寻找与抗病基因紧密连锁的分子标记,能够直接或间接地鉴定抗病基因在小麦中的分布;同时,利用分子标记辅助选择技术聚合多个抗病基因是培育持久抗性小麦品种的重要手段,可有效提高抗病育种的使用年限[7]。小麦地方品种又称农家品种,是人类在长期的栽培过程中适应特定环境、在遗传上保持相对稳定的作物复合群。具有早熟、对生物和非生物胁迫的高度亲和性、对各种生态条件的适应性等特点,作为一级基因源,拥有丰富的遗传多样性,尤其在抗病性、抗逆性和抗虫性上表现突出,已成为小麦育种中最重要的遗传资源之一[8-9]。近年来,利用表型鉴定结合分子标记技术加快了对中国小麦地方种质较为系统的条锈病抗性评价与鉴定。韩德俊等[10]利用分子标记在中国小麦地方品种和国外种质中鉴定得到了8份全生育期抗性材料和42份成株期抗性材料。张二喜等[11]对142份国内小麦地方品种资源进行条锈病抗性鉴定,筛选出24份抗条锈病的种质资源。蔺瑞明等[12]对684份农家品种进行苗期和成株期的抗性鉴定,得到117份成株期抗性和42份全生育期抗性材料,进一步丰富了中国抗条锈病资源库。Zheng等[13]利用分子标记检测36个抗条锈病基因在170份中国小麦地方品种中的分布情况,携带和的材料分别占38.82%和59.41%;在田间条件下,发现和等基因具有较强的抗性,在+和+的基因组合中也观察到了显著的加性效应。Ye等[14]在79份四川小麦地方品种中鉴定了12份高抗条锈病的材料,定位到2个新的抗病QTL。管方念等[15]发现黄淮海麦区小麦地方品种中35份种质表现出稳定的成株期抗性,该麦区主要携带和抗性基因。截至目前,在小麦地方品种中已发现多个正式命名的抗条锈病基因,如、、、、和等[16-21]。【本研究切入点】云南省地处亚热带,地势、气候及耕作制度多样,品种资源十分丰富。云南小麦地方品种作为中国特有的小麦类型,主要包括普通小麦、圆锥小麦、密穗小麦、硬粒小麦4个种及云南小麦一个亚种,具有丰富的遗传多样性,适应性好,结实率高,粒小质硬等特点[22-23]。前人对于云南小麦地方品种抗条锈病鉴定和抗性基因发掘的系统研究相对较少。【拟解决的关键问题】本研究利用分布于云南省15个市州的243份小麦地方品种进行苗期和成株期抗性鉴定,结合15个已知抗条锈病基因分子检测,分析云南小麦地方品种对条锈病优势生理小种的整体抗性,明确已知抗性基因在云南小麦地方品种中的分布情况,为小麦条锈病抗性品种改良及抗病基因的有效利用和合理布局提供理论依据,也为西南麦区抗病育种提供新抗源。
1 材料与方法
1.1 试验材料
243份云南小麦地方品种(电子附表1),分布于云南省15个市州,由云南农业大学覃鹏教授提供。成株期条锈病鉴定诱发材料SY95-71和台长29,苗期条锈病鉴定感病对照为铭贤169。已知条锈病抗性基因阳性对照材料,包括()、/6*AvocetS、/6*AvocetS、/6*AvocetS、/6*AvocetS、(蜀麦1675)、(川麦55)、(Opata85)、(RSL65)、(PI 566596)、(川农19)、(PI 610750)、(PI 480016)和(C591)。Avocet S作为阴性对照材料。对照材料由四川农业大学小麦研究所保存并提供。
苗期条锈病生理小种包括CYR32(Avirulence/Virulence:、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、)[24-26]和CYR34(Avirulence/Virulence:、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、)[25-27]。成株期条锈病鉴定的等量混合菌种由中国小麦生产上流行频率高、毒性强的条锈病生理小种CYR32、CYR33、CYR34及贵22-14、水源和贵农致病类群组成。所有菌种均由甘肃省农业科学院植物保护研究所贾秋珍教授提供。
1.2 苗期抗病性鉴定
苗期接种鉴定于甘肃省农业科学院植物保护研究所温室进行。供试材料及感病对照品种铭贤169分别选取10粒种子发苗培养,采用喷接法于一叶一心期的小麦叶片上分别接种条锈菌单小种分离物CYR32和CYR34,置于10℃接种间黑暗保湿24 h,再置于温室内培养。接种后15—18 d待铭贤169充分感病,反应型(infection type,IT)按照0—9级标准记录其抗锈程度,高抗(IT:0—3)、中抗(IT:4—6)、中感(IT:7)、高感(IT:8—9)[28]。
1.3 成株期抗病性鉴定
243份云南小麦地方品种进行两年三点成株期条锈病鉴定,包括2018—2019年四川农业大学温江基地(19WJ)、2019—2020年四川农业大学温江基地(20WJ)和2019—2020年四川农业大学崇州基地(20CZ)。采用随机区组设计,1.5 m行长、行距0.3 m,每个材料单粒播种,每行定植15株。每20行设置1行感病对照SY95-71用以诱发病害。在小麦处于分蘖期时采用涂抹法[29]人工接种条锈菌混合生理小种,待感病材料充分发病时,根据叶片锈孢子堆情况,每行随机选取6个单株,分3次,每次间隔7 d调查其严重度和普遍率,最后一次调查记录反应型。严重度采用0、5%、10%、20%、40%、60%、80%、100%等8个等级[28],反应型鉴定标准与苗期一致。
1.4 抗条锈病基因的分子标记检测
采用Hill-Ambroz等[30]改良的CTAB提取方法,取小麦3叶期时叶片组织,提取基因组DNA,用紫外分光光度计测定DNA浓度及纯度,并用TE将DNA稀释至100 ng·ml-1左右的工作浓度,-20℃保存备用。用PCR链式反应扩增目的片段,PCR程序使用降落反应(touchdown PCR),利用、、、、、、、、、、、、、、和[16]的紧密连锁标记或功能标记对供试材料进行分子检测,产物在1.5%—2%的琼脂糖凝胶电泳、毛细管电泳中分离。同时对和抗病基因的KASP标记进行荧光定量PCR扩增检测。分子标记序列如表1,以上所有引物均由上海生工生物工程有限公司合成。
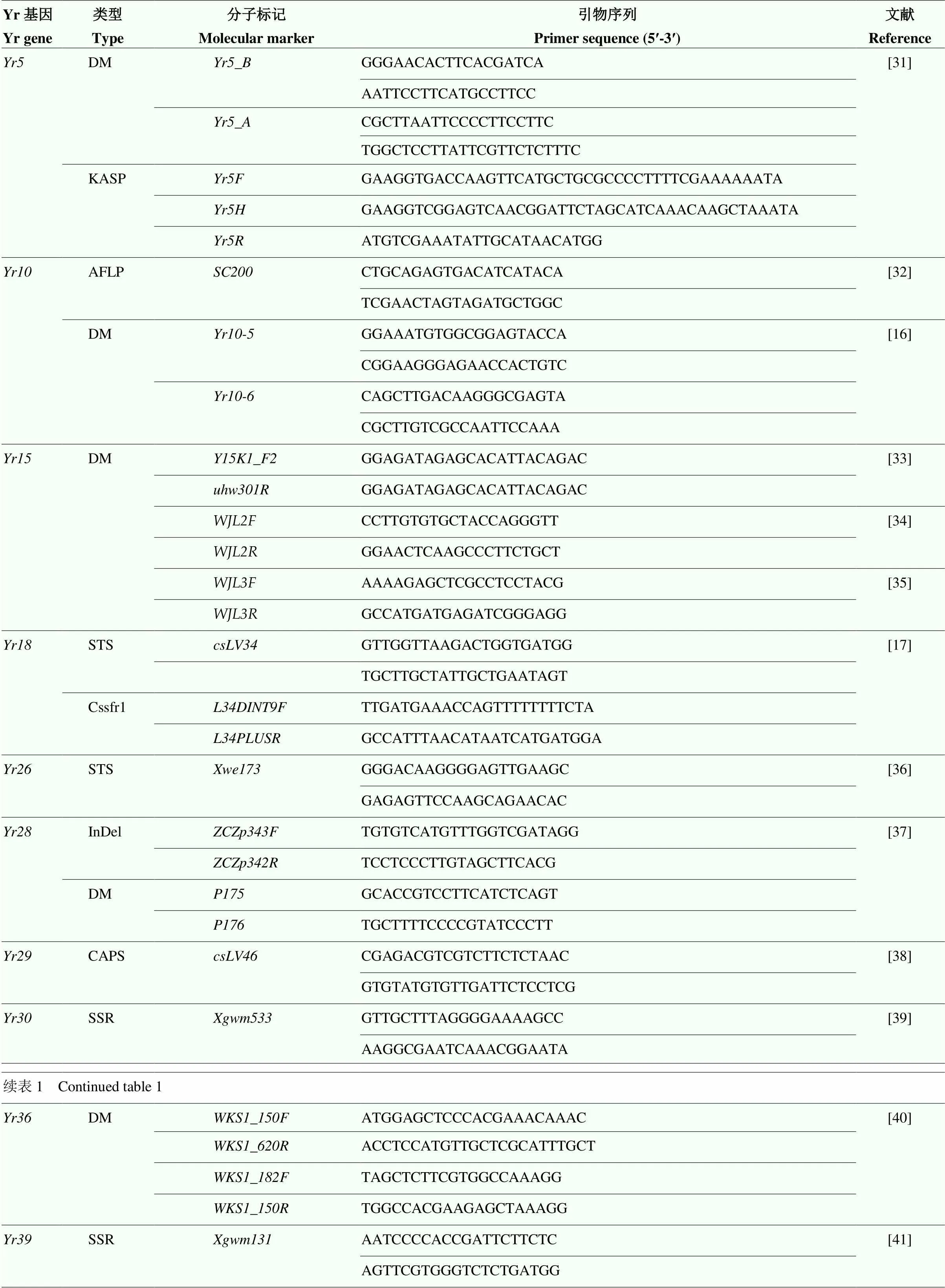
表1 抗条锈病基因的分子标记及引物序列
DM:显性标记;AFLP:扩增片段长度多态性;STS:序列标志位点;InDel:插入缺失;CAPS:酶切扩增多态性序列;SSR:简单重复序列;KASP:竞争性等位基因特异性PCR
DM: Dominant marker; AFLP: Amplified fragment length polymorphism; STS: Sequence tagged sites; InDel: Insertion/Deletion; CAPS: Cleavage amplification polymorphism sequence; SSR: Simple sequence repeats; KASP: Kompetitive allele-specifc PCR
2 结果
2.1 苗期抗病性鉴定
利用中国当前小麦生产上毒性强、流行频率高的2个条锈病生理小种CYR32和CYR34对243份云南小麦地方品种进行苗期抗病性鉴定。结果发现,供试材料在苗期对2个生理小种的抗病性存在明显差异,18份种质对CYR32表现为苗期抗性(IT=0—6),占7.41%;32份种质对CYR34具有苗期抗性,占13.17%。8份云南小麦地方品种对CYR32和CYR34均具有苗期抗性,占3.29%,其中1份种质云0330对生理小种表现出免疫水平(IT=0)(电子附表1)。苗期抗性鉴定结果表明云南小麦地方品种在苗期对中国当前小麦条锈病2个流行小种整体抗性水平相对较低。
2.2 成株期抗病性鉴定
利用当前中国小麦生产上流行的条锈病毒性小种或致病类群组成的混合菌群对云南小麦地方品种进行多年多环境(19WJ、20WJ和20CZ)成株期抗性鉴定。19WJ田间成株期抗性鉴定中226份地方种质具有抗性(IT:0—6、MDS<60%),占93%;20WJ田间鉴定224份地方种质具有抗性,占92.18%;20CZ田间鉴定223份地方种质在成株期具有抗性,占91.77%。综合比较3个环境鉴定结果发现,共214份材料在成株期表现稳定的抗性,占88.07%。其中,135份种质在成株期表现高抗病性(IT:0—3、MDS<20%)(电子附表1)。
2.3 苗期和成株期抗条锈病综合分析
结合苗期和成株期抗性表型鉴定结果,19WJ鉴定185份种质表现出成株期抗性(adult-plant resistance,APR),即苗期表现感病而成株期表现抗病,占76.13%。20WJ鉴定191份种质表现出成株期抗性,占78.6%。20CZ鉴定181份种质表现出成株期抗性,占74.49%。对比3个环境抗性鉴定结果表明,共174份地方种质在所有环境均表现为稳定的成株期抗性,占71.6%,其中105份种质在成株期高抗条锈病。对CYR32表现苗期抗性的18份种质中,同时也在成株期表现稳定抗性;对CYR34表现苗期抗性的32份种质中,在成株期表现稳定抗性的有30份。上述结果表明云南小麦地方品种对中国当前流行的条锈菌群具有很好的成株期抗性,可为中国抗条锈病品种的改良和选育提供重要的抗性资源。
2.4 抗条锈病基因的分子标记检测
利用已正式命名的16个抗条锈病基因、、、、、、、、、、、、、、和的紧密连锁标记或功能标记对供试材料进行分子检测,以携带目的基因的材料作为阳性对照,以感病材料Avocet S作为阴性对照。在供试材料中,48份种质可能携带,占19.75%;与紧密连锁的标记中,有74份种质扩增出目标条带,标记有52份材料(图1),2个标记同时扩增出目标条带的有44份,占18.11%;与紧密连锁的标记中,4份种质扩增出目标条带,占1.65%;6份种质可能携带,占2.47%;4份种质可能携带,占1.65%;与紧密连锁的KASP标记中(图2),101份种质扩增出目标荧光信号,占41.56%。在所有供试材料中均未检测到、、、、、、、、和。
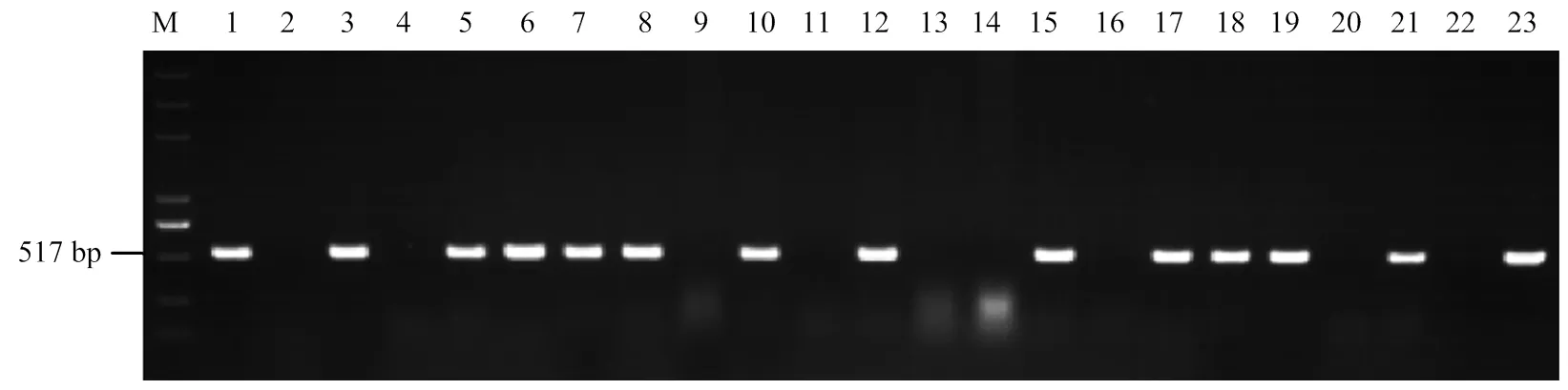
M:Marker(DL2000);1:Yr18/6* Avocet S;2:Avocet S;3:云0054 Yun 0054;4:云0055 Yun 0055;5:云0056 Yun 0056;6:云0057 Yun 0057;7:云0058 Yun 0058;8:云0059 Yun 0059;9:云0060 Yun 0060;10:云0061 Yun 0061;11:云0062 Yun 0062;12:云0063 Yun 0063;13:云0066 Yun 0066;14:云0074 Yun 0074;15:云0075 Yun 0075;16:云0076 Yun 0076;17:云0077 Yun 0077;18:云0079 Yun 0079;19:云0084 Yun 0084;20:云0086 Yun 0086;21:云0087 Yun 0087;22:云0088 Yun 0088;23:云0098 Yun 0098
分子检测发现携带2个及以上抗性基因的种质39份。其中,34份种质携带2个抗病基因,+组合有16份,+组合有9份,+组合有4份,+组合有2份,+、+和+组合各1份。4份种质携带3个抗病基因,、++、++和组合各1份。云0288同时携带4个抗病基因++。共有74份地方种质未检测到以上所有抗性基因,其中58份为成株期抗性材料,推测其含有未检测的其他已知或未知的条锈病抗性基因或组合。条锈病抗性表型鉴定及分子检测结果如电子附表1所示。
3 讨论
3.1 云南小麦地方品种在小麦抗条锈病育种中的重要性
小麦条锈病是影响小麦产量的重要病害之一。2020年,国内小麦条锈病总体呈偏重发生态势,西南、汉水流域和黄淮南部9个省份的约86.67万hm2麦田发生条锈病害,为近10年来最严重的一年,所以培育和推广抗病品种已刻不容缓[45]。云南省是中国重要的条锈病越冬区和初菌源,在条锈病流行中占有重要地位,由于其地形地貌复杂,气候类型多样,小麦条锈菌群体毒性在云南省易发多变[46]。云南省拥有丰富的小麦地方种质资源,其中可能蕴含着丰富的抗性基因。李明菊等[47]利用CYR31、CYR32和水源11-14 Hybrid46-7等多小种混合菌群对63份云南小麦地方品种进行条锈病抗性鉴定,发现35份表现抗病,28份表现慢锈性,可作为小麦育种和的品质改良优异抗性亲本材料。李菁等[48]利用CYR32、CYR33、CYR34和贵农22-9等条锈菌生理小种和致病类型组成的混合菌群对78份云南铁壳麦进行抗条锈病鉴定,所有材料均表现出成株期抗性,且不含有、、、、、/、、、、和等已知抗病基因,进一步说明云南特有小麦种质是发掘条锈病抗性基因的重要基因源和抗性亲本材料。本研究筛选得到了表现稳定成株期抗性的174份种质,占供试材料的71.6%。由于这些材料与其他小麦品种的遗传交换较少,因此该地区的小麦抗性材料可能存在抵抗当前条锈病流行小种的未知抗性基因资源[46]。代君丽等[49]鉴定了51份中国小麦地方品种,有17份种质含有未知的抗病基因,占农家品种的33.3%。王吐虹等[50]鉴定的40份中国小麦农家品种中,有35份材料含未知抗条锈病基因,占农家品种的87.5%,说明小麦农家品种具有丰富的抗性基因资源,可作为小麦抗性育种的亲缘材料。本研究鉴定得到74份地方种质具有很好的成株期条锈病抗性,且分子检测未鉴定出小麦生产中16个已知抗性基因,推测这些种质可能含有其他已知的或未知的新抗条锈病基因或组合,可为小麦持久抗条锈病品种的选育提供新的抗源。
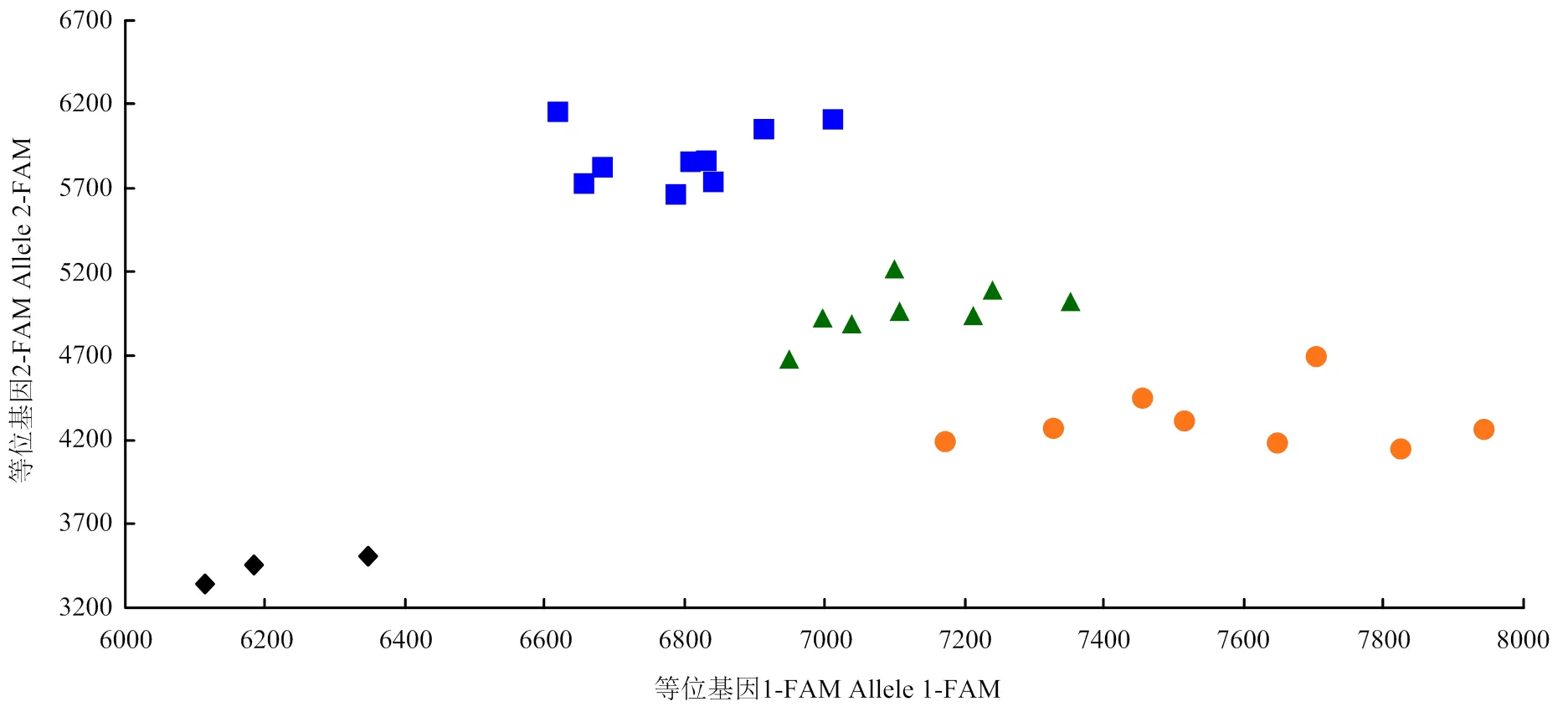
:携带Yr81:云0190、云0191、云0192、云0193、云0194、云0202、云0203、云0208;:未携带Yr81:云0188、云0206、云0218、云0221、云0224、云0228、云0254、云0255;:杂合:云0196、云0207、云0209、云0226、云0227、云0235、云0236、云0237;:空白对照:H2O
3.2 Yr10、Yr18和Yr81在小麦育种中的利用
分子标记辅助选择在作物育种中的研究已有30多年历史,发挥了较大的作用。来源于土耳其小麦PI 178383,定位在染色体1BS上,但对目前流行的生理小种CYR34已失去抗性,Zheng等[13]、尉法刚等[51]、李敏州等[52]分别对中国小麦地方品种,中国小麦品种(系)和陕西小麦品种(系)进行检测,结果发现在地方品种中分布较多,占38.82%,而在小麦品种(系)中利用较少。本研究利用功能标记和对材料进行检测,发现只携带的有17份,其中15份抗条锈病,由于CYR34对具有毒性,因此,这15份材料可能含有其他未检测的已知或未知基因。为成株期抗性基因,其抗性优良且持久,Krattinger等[53]完成了的克隆。Lagudah等[17]根据抗性位点等位基因的exon11中TTC碱基缺失开发了5个功能标记(—)。本研究利用显性标记和STS标记对供试材料进行分子检测,结果发现25份材料可能只携带。杨文雄等[54]利用STS标记鉴定了231个小麦育成品种和422个农家种的,其频率分别为6.1%和85.1%。ZENG等[55]在495份中国小麦品种及育种品系中检测出只有10份携带,占2.02%,占0.4%,并证实测试品种中没有和。张玉薇等[56]在75份国家审定的小麦品种中仅有一个品种即陕西的西农928检测出。李北等[57]在107份重庆地区主栽品种和高代品系材料中,检测到3份材料携带。可见目前在中国小麦地方种质中分布较多,但对于小麦育成品种的利用率偏低。研究表明现今对中国的条锈菌生理小种仍然有抗性,今后在小麦育种中可利用分子标记进行辅助育种,加大对等慢锈基因的有效利用,以期提高小麦品种的抗性水平。被鉴定来自小麦地方品种Aus27430,定位于染色体6AS上,当和相互作用时,种质的抗性比单独携带这些基因强[21]。管方念等[15]对152份黄淮海麦区小麦农家品种进行条锈病抗性鉴定和分子检测,地方种质主要携带和,且二者的聚合材料抗条锈病能力显著提高。在本研究中,利用特异分子标记检测得到82份只携带该基因的地方种质,表型鉴定中80份种质是具有不同抗性类型的抗源材料,64份材料高抗条锈病(IT:0—3,MDS<20%)。4份+聚合材料中有3份对条锈菌表现为抗病,另外携带的基因组合,如+、++等种质在表型鉴定中对条锈病都具有很好的抗性。可见和抗性优良,但在小麦育种中还未对其进行有效利用,本研究筛选出的携带和的抗病种质可为小麦抗性育种提供基础材料。
3.3 抗性基因聚合的研究与利用
由于条锈菌的不断变异,新出现的毒性小种会导致已知的抗条锈病基因丧失抗性,获得抗性持久的小麦种质是小麦抗性育种的目标。可以利用主效抗性基因的累加或聚合成株期抗性基因和全生育期抗性基因来实现,通过分子标记辅助选择有目的地进行基因累加,但前提是明确亲本中抗病基因的分布情况[58]。基因组合可以聚类成不同的模型,不同抗性基因的综合利用将有利于作物获得广谱和持久的抗性[57]。Zhang等[59]利用分子标记辅助选择成功在普通小麦品种陕麦139中聚合了2个显性抗条锈病基因139-1B和139-2D,优良的抗性和农艺性状使其每年在陕西和安徽种植6.6万hm2以上。穆京妹[60]聚合了源于四倍体小麦的抗条锈病基因和,创制了二者的聚合系种质,该种质在田间对条锈病表现为高抗水平。抗条锈病基因对目前流行的生理小种已丧失抗性,但韩德俊等[61]研究发现,与其他聚合,如+或+,都能增强品种抗病性,这可能意味着不存在抗病基因的“失效”问题,而是如何合理地聚合这些抗性基因来进行抗性育种。Liu等[62]研究发现虽然、、和对当前流行的条锈菌种只有部分抗性,但当它们聚合在一起时的基因组合存在加性效应或上位效应,例如+、+、+和+等组合。在本研究中,同时携带4个抗性基因的云0288(++),田间表型为中抗条锈病。携带3个抗性基因的4份材料在田间大部分抗条锈病,仅云0364(++)反应型IT=7,感条锈病。虽然对当前的条锈病流行小种CYR34已丧失抗性,但本研究中+、+和等基因组合的材料绝大部分对条锈病表现出抗性,原因可能是抗性基因、和表现出抗性水平,也可能是这些基因组合存在加性效应或上位效应,或是由于该种质携带其他未检测到的已知或新的抗性基因存在。利用分子标记辅助选择有目的地进行基因聚合和基因合理布局将有助于提高育种材料的抗病性,以培育抗性持久的种质[61]。本研究中获得的聚合种质材料有助于小麦“持久抗性”品种的选育。
4 结论
基于条锈病抗性表型,结合抗性基因连锁标记或功能标记,在243份云南小麦地方品种中筛选出174份在3个环境中表现稳定成株期抗性的材料,对中国当前流行频率高,毒性强的条锈菌生理小种和致病类型的抗性水平整体较高,且含有丰富的已知或未知的抗病新基因或组合。
[1] GUPTA P K, MIR R R, MOHAN A, KUMAR J. Wheat genomics: Present status and future prospects. International Journal of Plant Genomics, 2008: 1-36.
[2] WELLINGS C R. Global status of stripe rust: a review of historical and current threats. Euphytica, 2011, 179(1): 129-141.
[3] LINE R F, CHEN X M. Successes in breeding for and managing durable resistance to wheat rusts.Plant Disease, 1995, 79(12): 1254-1255.
[4] 王琪琳, 张立, 魏国荣, 曾庆东, 赵杰, 王晓杰, 黄丽丽, 康振生. “西北-华北-长江中下游”条锈病流行区系当前小麦品种(系)抗条锈病性评价.中国农业科学, 2010, 43(14): 2889-2896.
WANG Q L, ZHANG L, WEI G R, ZENG Q D, ZHAO J, WANG X J, HUANG L L, KANG Z S. Evaluation of resistance of current wheat cultivars to stripe rust in Northwest China, North China and the Middle and Lower Reaches of Changjiang River Epidemic Area. Scientia Agricultura Sinica, 2010, 43(14): 2889-2896. (in Chinese)
[5] LI J B, DUNDAS I, DONG C M, LI G R, TRETHOWAN R, YANG Z J, HOXHA S, ZHANG P. Identification and characterization of a new stripe rust resistance geneon rye chromosome 6R in wheat. Theoretical and Applied Genetics, 2020, 133(4): 1095-1107.
[6] KUMAR S, GOYAL A, MOHAN A, BALYAN H S, GUPTA P K. An integrated physical map of simple sequence repeats in bread wheat. Australian Journal of Crop Science, 2013, 7: 460-468.
[7] LU Y M, LAN C X, LIANG S S, ZHOU X C, LIU D, ZHOU G, LU Q L, JING J X, WANG M N, XIA X C, HE Z H. QTL mapping for adult-plant resistance to stripe rust in Italian common wheat cultivars Libellula and Strampelli. Theoretical and Applied Genetics, 2009, 119(8): 1349-1359.
[8] PAYNE P I, NIGHTINGALE M A, KRATTIGER A F, HOLT L M. The relationship between HMW glutenin subunit composition and the bread-making quality of British-grown wheat varieties.ournal of the Science of Food and Agriculture, 1987, 40(1): 51-65.
[9] 金善宝. 中国小麦品种及其系谱. 北京: 中国农业出版社, 1983: 366-381.
JIN S B.Beijing: China Agriculture Press, 1983: 366-381. (in Chinese)
[10] 韩德俊, 张培禹, 王琪琳, 曾庆东, 吴建辉, 周新力, 王晓杰, 黄丽丽, 康振生. 1980份小麦地方品种和国外种质抗条锈性鉴定与评价. 中国农业科学, 2012, 45(24): 5013-5023.
HAN D J, ZHANG P Y, WANG Q L, ZENG Q D, WU J H, ZHOU X L, WANG X J, HUANG L L, KANG Z S. Identification and evaluation of resistance to stripe rust in 1980 wheat landraces and abroad germplasm. Scientia Agricultura Sinica, 2012, 45(24): 5013- 5023. (in Chinese)
[11] 张二喜, 李金昌, 吕莉莉, 王伟. 小麦地方品种资源对条锈病的抗性鉴定及评价. 甘肃农业科技, 2006(7): 9-12.
ZHANG E X, LI J C, Lü L L, WANG W. Evaluation of resistance to strike rust landrace wheat germplasm resources. Gansu Agricultural Science and Technology, 2006(7): 9-12. (in Chinese)
[12] 蔺瑞明, 郄彦敏, 冯晶, 徐世昌. 中国小麦农家品种抗条锈病的鉴定与评价. 沈阳农业大学学报, 2010, 41(5): 535-539.
LIN R M, QIE Y M, FENG J, XU S C. Identification of the yellow rust resistance gene-carrying wheat landraces in China. Journal of Shenyang Agricultural University, 2010, 41(5): 535-539. (in Chinese)
[13] ZHENG S G, LI Y F, LU L, LIU Z H, ZHANG C H, AO D H, LI L R, ZHANG C Y, LIU R, LUO C P, WU Y, ZHANG L. Evaluating the contribution ofgenes to stripe rust resistance breeding through marker-assisted detection in wheat. Euphytica, 2017, 213(2): 1-16.
[14] YE X L, LI J, CHENG Y K, YAO F J, LONG L, YU C, WANG Y Q, WU Y, LI J, WANG J R, JIANG Q T, LI W, MA J, WEI Y M, ZHENG Y L, CHEN G Y. Genome-wide association study of resistance to stripe rust (f. sp.) in Sichuan wheat. BioMed Central Plant Biology, 2019, 19(1): 147.
[15] 管方念, 龙黎, 姚方杰, 王昱琦, 江千涛, 康厚扬, 蒋云峰, 李伟, 邓梅, 李豪, 陈国跃. 152份黄淮海麦区小麦农家品种抗条锈性评价及重要条锈病抗性基因的分子检测. 中国农业科学, 2020, 53(18): 3629-3637.
GUAN F N, LONG L, YAO F J, WANG Y Q, JIANG Q T, KANG H Y, JIANG Y F, LI W, DENG M, LI H, CHEN G Y. Evaluation of resistance to stripe rust and molecular detection of important knowngene(s) of 152 Chinese Wheat Landraces from the Yellow and Huai River Valleys. Scientia Agricultura Sinica, 2020, 53(18): 3629-3637. (in Chinese)
[16] LIU W, FRICK M, HUEL R, NYKIFORUK C L, WANG X M, GAUDET D A, EUDES F, CONNER R L, KUZYK A, CHEN Q, KANG Z S, LAROCHE A. The stripe rust resistance geneencodes an evolutionary-conserved and unique CC-NBS-LRR sequence in wheat. Molecular Plant, 2014, 7(12): 1740-1755.
[17] LAGUDAH E S, KRATTINGER S G, HERRERA-FOESSEL S, SINGH R P, HUERTA-ESPINO J, SPIELMEYER W, BROWN- GUEDIRA G, SELTER L L, KELLER B. Gene-specific markers for the wheat genewhich confers resistance to multiple fungal pathogens. Theoretical and Applied Genetics, 2009, 119(5): 889-898.
[18] MOORE J W, HERRERA-FOESSEL S, LAN C, SCHNIPPENKOETTER W, AYLIFFE M, HUERTA-ESPINO J, LILLEMO M, VICCARS L, MILNE R, PERIYANNAN S, KONG X Y, SPIELMEYER W, TALBOT M, BARIANA H, PATRICK J W, DODDS P, SINGH R, LAGUDAH E. A recently evolved hexose transporter variant confers resistance to multiple pathogens in wheat. Nature Genetics, 2015, 47(12): 1494-1498.
[19] CHENG P, XU S, WANG M N, SEE D R, CHEN X M. Molecular mapping of genesandfor stripe rust resistance in hexaploid derivatives of durum wheat accessions PI 331260 and PI 480016. Theoretical and Applied Genetics, 2014, 127(10): 2267-2277.
[20] NSABIYERA V, BARIANA H S, QURESHI N, WONG D, HAYDEN M J, BANSAL U K. Characterization and mapping of adult plant stripe rust resistance in wheat accession Aus27284. Theoretical and Applied Genetics, 2018, 131(7): 1459-1467.
[21] GESSESE M, BARIANA H, WONG D, HAYDEN M, BANSAL U. Molecular mapping of stripe rust resistance genein a common wheat landrace Aus27430. Plant Disease, 2019, 103(6): 1166-1171.
[22] 曾学琦, 恩在诚, 伍绍云.云南省小麦品种资源的特点及分布. 云南农业科技, 1989(5): 3-6.
ZENG X Q, EN Z C, WU S Y. Characteristics and distribution of wheat variety resources in Yunnan province. Yunnan Agricultural Science and Technology, 1989(5): 3-6. (in Chinese)
[23] 李明菊. 云南省小麦条锈病流行体系的研究现状. 植物保护, 2004(3): 30-33.
LI M J. Current research situation on epidemic system of wheat stripe rust in Yunnan province. Plant Protection, 2004(3): 30-33. (in Chinese)
[24] QUAN W, HOU G L, CHEN J, DU Z Y, LIN F, GUO Y, LIU S, ZHANG Z J. Mapping of QTL lengthening the latent period ofin winter wheat at the tillering growth stage.European Journal of Plant Pathology, 2013, 136(4): 715-727.
[25] LIU T G, PENG Y L, CHEN W Q, ZHANG Z Y. First detection of virulence inf. sp.in China to resistance genes(=) present in wheat cultivar Chuanmai 42. Plant disease, 2010, 94(9): 1163.
[26] WU J H, WANG Q L, CHEN X M, WANG M J, MU J M, LV X N, HUANG L L, HAN D J, KANG Z S. Stripe rust resistance in wheat breeding lines developed for Central Shaanxi, an overwintering region forf. sp.in China. Canadian Journal of Plant Pathology, 2016, 38(3): 317-324.
[27] 刘博, 刘太国, 章振羽, 贾秋珍, 王保通, 高利, 彭云良, 金社林, 陈万权. 中国小麦条锈菌条中34号的发现及其致病特性. 植物病理学报, 2017, 47(5): 681-687.
LIU B, LIU T G, ZHANG Z Y, JIA Q Z, WANG B T, GAO L, PENG Y L, JIN S L, CHEN W Q. Discovery and pathogenicity of CYR34, a new race off. sp.in China. Acta Phytopathologica Sinica, 2017, 47(5): 681-687. (in Chinese)
[28] LINE R F, QAYOUM A, Virulence, aggressiveness, Evolution and distribution of races of(the cause of stripe of wheat) in North America, 1968-1987., 1992: 1-54.
[29] 陈国跃, 姚琦馥, 刘亚西, 邓梅, 吴文雄, 何员江, 余马. 四川地方小麦品种条锈病抗性研究. 四川农业大学学报, 2013, 31(1): 1-8.
CHEN G Y, YAO Q F, LIU Y X, DENG M, WU W X, HE Y J, YU M. Studies on yellow rust resistance of Sichuan wheat landraces. Journal of Sichuan Agricultural University, 2013, 31(1): 1-8. (in Chinese)
[30] HILL-AMBROZ K L, BROWN-GUEDIRA G L, FELLERS J P. Modified rapid DNA extraction protocol for high throughput microsatellite analysis in wheat. Crop Science, 2002, 42(6): 2088-2091.
[31] MARCHAL C, ZHANG J P, ZHANG P, FENWICK P, STEUEMAGEL B, ADAMSKI N M, BOYD L, MCINTOSH R, WULFF B B H, BERRY S, LAGUDAH E, UAUY C. BED-domain-containing immune receptors confer diverse resistance spectra to yellow rust. Nature Plants, 2018, 4(9): 662-668.
[32] 邵映田, 牛永春, 朱立煌, 翟文学, 徐世昌, 吴立人.小麦抗条锈病基因的AFLP标记. 科学通报, 2001(8): 669-672.
SHAO Y T, NIU Y C, ZHU L H, ZHAI W X, XU S C, WU L R. AFLP markers of wheat stripe rust resistance gene. Chinese Science Bulletin, 2001(8): 669-672. (in Chinese)
[33] KLYMIUK V, YANIV E, HUANG L, RAATS D, FATIUKHA A, CHEN S S, FENG L H, FRENKEL Z, KRUGMAN T, LIDZBARSKY G, CHANG W, JÄÄSKELÄINEN M J, SCHUDOMA C, PAULIN L, LAINE P, BARIANA H, SELA H, SALEEM K, SØRENSEN C K, HOVMØLLER M S, DISTELFELD A, CHALHOUB B, DUBCOVSKY J, KOROL A B, SCHULMAN A H, FAHIMA T. Cloning of the wheatresistance gene sheds light on the plant tandem kinase- pseudokinase family. Nature Communications, 2018, 9(1): 178-202.
[34] HE Y, FENG L H, JIANG Y, ZHANG L Q, YAN J, ZHAO G, WANG J R, CHEN G Y, WU B H, LIU D C, HUANG L, FAHIMA T. Distribution and nucleotide diversity ofin wild emmer populations and Chinese wheat germplasm. Pathogenetics, 2020, 9(3): 212.
[35] HUANG L, FENG L H, HE Y, TANG Z Z, HE J S, SELA H, KRUGMAN T, FAHIMA T, LIU D C, WU B H. Variation in stripe rust resistance and morphological traits in wild emmer wheat populations. Agronomy, 2019, 9(2): 44.
[36] WANG C M, ZHANG Y P, HAN D J, KANG Z S, LI G P, CAO A Z, CHEN P D. SSR and STS markers for wheat stripe rust resistance gene. Euphytica, 2008, 159(3): 359-366.
[37] ZHANG C Z, HUANG L, ZHANG H F, HAO Q Q, LYU B, WANG M N, EPSTEIN L, LIU M, KOU C L, QI J, CHEN F J, LI M K, GAO G, NI F, ZHANG L Q, HAO M, WANG J R, CHEN X M, LUO M C, ZHENG Y L, WU J J, LIU D C, FU D L. An ancestral NB-LRR with duplicated 3'UTRs confers stripe rust resistance in wheat and barley. Nature Communications, 2019, 10(1): 4023.
[38] REN Y, SINGH R P, BASNET B R, LAN C X, HUERTA-ESPINO J, LAGUDAH E S, PONCE-MOLINA L J, LAN C X. Identifcation and mapping of adult plant resistance loci to leaf rust and stripe rust in common wheat cultivar Kundan. Plant Disease, 2017, 101: 456-463.
[39] HAYDEN M J, KUCHEL H, CHALMERS K J. Sequence tagged microsatellites for thelocus provide new diagnostic markers to select for the presence of stem rust resistance genein bread wheat (L.). Theoretical and Applied Genetics, 2004, 109(8): 1641-1647.
[40] HUANG L, SELA H, FENG L H, CHEN Q J, KRUGMAN T, YAN J, DUBCOVSKY J, FAHIMA T. Distribution and haplotype diversity of WKS resistance genes in wild emmer wheat natural populations. Theoretical and Applied Genetics, 2016, 129(5): 921-934.
[41] LIN F, CHEN X M. Genetics and molecular mapping of genes for race-specific all-stage resistance and non-race-specific high-temperature adult-plant resistance to stripe rust in spring wheat cultivar Alpowa. Theoretical and Applied Genetics, 2007, 114(7): 1277-1287.
[42] LUO P G, HU X Y, REN Z L, ZHANG H Y, SHU K, YANG Z J. Allelic analysis of stripe rust resistance genes on wheat chromosome 2BS., 2008, 51(11): 922-927.
[43] LOWE I, JANKULOSKI L, CHAO S, CHEN X M, SEE D, DUBCOVSKY J. Mapping and validation of QTL which confer partial resistance to broadly virulent post-2000 North American races of stripe rust in hexaploid wheat. Theoretical and Applied Genetics, 2011, 123(1): 143-157.
[44] XU H X, ZHANG J, ZHANG P, QIE Y M, NIU Y C, LI H J, MA P T, XU Y F, AN D G. Development and validation of molecular markers closely linked to the wheat stripe rust resistance genefor marker-assisted selection. Euphytica, 2014, 198(3): 317-323.
[45] XU Q, WANG J F, ZHAO J R, XU J H, SUN S T, ZHANG H F, WU J J, TANG C L, KANG Z S, WANG X J. A polysaccharide deacetylase fromf. sp.is an important pathogenicity gene that suppresses plant immunity. Plant Biotechnology Journal, 2020: 1-13.
[46] 李明菊, 杨子林, 杨莲, 顾中量, 吉勇, 韦丽莉, 张翼亮, 张培花, 宋文宏, 张庆, 赵剑锋, 刘太国. 部分小麦抗条锈基因及生产品种在云南的抗性表现. 植物保护, 2016, 42(4): 161-168.
LI M J, YANG Z L, YANG L, GU Z L, JI Y, WEI L L, ZHANG Y L, ZHANG P H, SONG W H, ZHANG Q, ZHAO J F, LIU T G. Resistance ofgenes and commercial wheat cultivars to yellow rust in Yunnan province.Plant Protection, 2016, 42(4): 161-168. (in Chinese)
[47] 李明菊, 伍少云. 云南小麦品质改良亲缘材料成株期抗条锈性评价. 麦类作物学报, 2006(1): 113-116.
LI M J, WU S Y. Assessment to adult-plant resistance to stripe rust of parent materials for quality improvement of wheat germplasms in Yunnan. Journal of Triticeae Crops, 2006(1): 113-116. (in Chinese)
[48] 李菁, 姚方杰, 龙黎, 王昱琦, 叶雪玲, 邓梅, 蒋云峰, 李伟, 江千涛, 康厚扬, 陈国跃. 中国特有的3个普通小麦亚种抗条锈病评价及其抗性基因分子检测. 植物病理学报, 2020, 50(4): 426-441.
LI J, YAO F J, LONG L, WANG Y Q, YE X L, DENG M, JIANG Y F, LI W, JIANG Q T, KANG H Y, CHEN G Y. Evaluation and molecular detection of stripe rust resistance in three subspecies of Chinese endemic wheat. Acta Phytopathologica Sinica, 2020, 50(4): 426-441. (in Chinese)
[49] 代君丽, 刘珂, 牛永春, 李洪连. 中国小麦地方品种抗条锈病基因推导. 河南农业科学, 2010(12): 83-87.
DAI J L, LIU K, NIU Y C, LI H L. Postulation of resistance genes to stripe rust in local wheat varieties from China. Journal of Henan Agricultural Sciences, 2010(12): 83-87. (in Chinese)
[50] 王吐虹, 郭青云, 蔺瑞明, 姚强, 冯晶, 王凤涛, 陈万权, 徐世昌. 中国40个小麦农家品种和甘肃南部40个生产品种抗条锈病基因推导. 中国农业科学, 2015, 48(19): 3834-3847.
WANG T H, GUO Q Y, LIN R M, YAO Q, FENG J, WANG F T, CHEN W Q, XU S C. Postulation of stripe rust resistance genes in Chinese 40 wheat landraces and 40 commercial cultivars in the southern region of Gansu province. Scientia Agricultura Sinica, 2015, 48(19): 3834-3847. (in Chinese)
[51] 尉法刚, 王光浩, 王长有, 张宏, 刘新伦, 田增荣, 朱建峰, 陈春环, 吉万全, 王亚娟. 400份小麦品种(系)条锈病成株期抗性鉴定与评价. 植物遗传资源学报, 2020, 21(4): 846-854.
WEI F G, WANG G H, WANG C Y, ZHANG H, LIU X L, TIAN Z R, ZHU J F, CHEN C H, JI W Q, WANG Y J. Evaluation and identification of adult resistance to stripe rust from 400 wheat varieties (lines). Journal of Plant Genetic Resources, 2020, 21(4): 846-854. (in Chinese)
[52] 李敏州, 李强, 巢凯翔, 申雪雪, 樊玉, 王阳, 王保通. 陕西省115个小麦品种(系)抗条锈病基因的分子检测. 植物病理学报, 2015, 45(6): 632-640.
LI M Z, LI Q, CHAO K X, SHEN X X, FAN Y, WANG Y, WANG B T. Molecular detection of stripe rust resistance genes in 115 wheat varieties (lines) from Shaanxi province. Acta Phytopathologica Sinica, 2015, 45(6): 632-640. (in Chinese)
[53] KRATTINGER S G, LAGUDAH E S, SPIELMEYER W, SINGH R P, HUERTAESPINO J, MCFADDEN H G, BOSSOLINI E, SELTER L L, KELLER B. A putative ABC transporter confers durable resistance to multiple fungal pathogens in wheat. Science, 2009, 323(5919): 1360-1363.
[54] 杨文雄, 杨芳萍, 梁丹, 何中虎, 尚勋武, 夏先春. 中国小麦育成品种和农家种中慢锈基因的分子检测. 作物学报, 2008, 34(7): 1109-1113.
YANG W X, YANG F P, LIANG D, HE Z H, SHANG X W, XIA X C. Molecular characterization of slow-rusting genes
[55] ZENG Q D, HAN D J, WANG Q L, YUAN F P, WU J H, ZHANG L, WANG X J, HUANG L L, CHEN X M, KANG Z S. Stripe rust resistance and genes in Chinese wheat cultivars and breeding lines. Euphytica, 2014, 196(2): 271-284.
[56] 张玉薇, 刘博, 刘太国, 高利, 陈万权. 小麦品种抗条锈病基因,及1BL/1RS易位的分子检测. 植物保护, 2014, 40(1): 54-59.
ZHANG Y W, LIU B, LIU T G, GAO L, CHEN W Q. Molecular detection ofandgenes and 1BL/1RS translocation in wheat cultivars. Plant Protection, 2014, 40(1): 54-59. (in Chinese)
[57] 李北, 徐琪, 杨宇衡, 王琪琳, 曾庆东, 吴建辉, 穆京妹, 黄丽丽, 康振生, 韩德俊. 重庆麦区小麦品种(系)抗条锈性评价与基因分析. 中国农业科学, 2017, 50(3): 413-425.
LI B, XU Q, YANG Y H, WANG Q L, ZENG Q D, WU J H, MU J M, HUANG L L, KANG Z S, HAN D J. Stripe rust resistance and genes in Chongqing wheat cultivars and lines. Scientia Agricultura Sinica, 2017, 50(3): 413-425. (in Chinese)
[58] 何中虎, 夏先春, 陈新民, 庄巧生. 中国小麦育种进展与展望. 作物学报, 2011, 37(2): 202-215.
HE Z H, XIA X C, CHEN X M, ZHUANG Q S. Progress of wheat breeding in China and the future perspective. Acta Agronomica Sinica, 2011, 37(2): 202-215. (in Chinese)
[59] ZHANG H, ZHANG L, WANG C Y, WANG Y J, ZHOU X L, LV S, LIU X L, KANG Z S, JI W Q. Molecular mapping and marker development for the-derived stripe rust resistance genein bread wheat cv. Shaanmai 139. Theoretical and Applied Genetics, 2016, 129(2): 369-376.
[60] 穆京妹. 基于连锁分析和关联分析的小麦抗条锈病基因挖掘及与聚合选育[D]. 杨凌: 西北农林科技大学, 2019.
MU J M. Gene mining of wheat resistance to stripe rust based on linkage analysis and association analysis and aggregation breeding ofand[D]. Yangling: Northwest Agriculture and Forestry University, 2019. (in Chinese)
[61] 韩德俊, 康振生. 中国小麦品种抗条锈病现状及存在问题与对策. 植物保护, 2018, 44(5): 1-12.
HAN D J, KANG Z S. Current status and future strategy in breeding wheat for resistance to stripe rust in China. Plant Protection, 2018, 44(5): 1-12. (in Chinese)
[62] LIU R, LU J, ZHOU M, ZHENG S G, LIU Z H, ZHANG C H, DU M, WANG M X, LI Y F, WU Y, ZHANG L. Developing stripe rust resistant wheat (L. lines with gene pyramiding strategy and marker-assisted selection. Genetic Resources and Crop Evolution, 2020, 67(2): 381-391.
Evaluation of Resistance to Stripe Rust and Molecular Detection of Resistance Gene(s) in 243 Common Wheat Landraces from the Yunnan province
XI Ling1, WANG YuQi1, YANG Xiu1, ZHU Wei1, CHEN GuoYue1, WANG Yi1, QIN Peng2, ZHOU YongHong1, KANG HouYang1
1Triticeae Research Institute, Sichuan Agricultural University/State Key Laboratory of Crop Gene Exploitation and Utilization in Southwest China, Chengdu 611130;2College of Agronomy and Biotechnology, YunnanAgricultural University, Kunming 650201
【】As one of the most destructive wheat diseases in the world, stripe rust is an airborne fungal disease caused by fungus. f. sp, (). Breeding resistant cultivars by exploiting resistant genetic resources is the most economical and effective strategy to combat the rusts. To provide theoretical basis for the management of wheat stripe rust by identifying and evaluating the resistance level of Yunnan wheat landraces to the current predominant races of the pathogen, and synthetically screened resistance genes that may be carried in the tested materials. 【】In this study, 243 wheat landraces originated from Yunnan were inoculated with two highly toxic and prevalent stripe rust races CYR32 and CYR34 at seedling stage. At the adult plant stage of wheat, the mixture of the current predominant races of CYR32, CYR33, CYR34, and Guinong Pathogenic group was used as the inoculums to test the resistance of the tested wheat. The wheat landraces were screened with the molecular markers closely linked to known stripe rust resistance genes,,,,,,,,,,,,,,,and.【】The results showed that the 243 of the tested wheat materials, of which 18 were resistant to CYR32, 32 resistant to CYR34, and only 8 (3.29%) were resistant to both races at the seedling stage. Based on identification results of the seedling stage and the adult plant stage, 174 (71.6%) exhibited adult plant resistance, of which 105 were high resistance to stripe rust. The results of molecular detection indicated that 48, 44, 4, 6, 4, and 101out of the 243 tested wheat materials carried the resistance genes,,,,,and, respectively. There were 34, 4 and, 1 simultaneously carrying 2, 3, and 4 resistance genes, respectively.,,,,,,,,,andwere not detectable in all of the wheat landraces. In addition, 74 landraces not detected any of the 16 resistance genes mentioned the above, and 58 exhibited adult plant resistance, which, presumably, may carry other known or new resistance genes to wheat stripe rust.【】As a special wheat germplasm resource in China, Yunnan wheat landraces have excellent resistance to stripe rust. This study determined that resistance of the 243 tested wheat landraces to the current predominant races of the pathogen was high on the whole, and 174 wheat landraces with stable resistance were identified. Among them, 74 lines might carry other known or new resistance genes to wheat stripe rust, which could be used as parents’ sources for further exploration of new stripe rust resistance genes or QTL.
wheat landraces; stripe rust; resistance identification; molecular markers;

10.3864/j.issn.0578-1752.2021.04.002
2020-06-24;
2020-08-20
国家“十三五”重点研发计划(2017YFD0100900)、四川省应用基础重点项目(2020YJ0348)
习玲,E-mail:1043975458@qq.com。通信作者康厚扬,E-mail:houyang.kang@sicau.edu.cn
(责任编辑 李莉)
