盐胁迫条件下长白10号水稻籽粒中差异代谢物的分析
2021-03-08张桂云朱静雯孙明法严国红刘凯宛柏杰代金英朱国永
张桂云,朱静雯,孙明法,严国红,刘凯,宛柏杰,代金英,朱国永
盐胁迫条件下长白10号水稻籽粒中差异代谢物的分析
张桂云,朱静雯,孙明法,严国红,刘凯,宛柏杰,代金英,朱国永
江苏沿海地区农业科学研究所,江苏盐城 224001
【】通过分析长白10号盐胁迫和非盐胁迫条件下水稻籽粒代谢产物的变化,揭示盐胁迫对稻米代谢产物及代谢通路的影响,了解长白10号耐盐机制,并筛选可能的耐盐水稻品种标志物。以耐盐碱优质粳稻品种长白10号为研究对象,采用气相色谱质谱联用技术(gas chromatography-mass spectrometry,GC-MS)分析了4‰盐胁迫条件下长白10号花后25 d籽粒中代谢组学变化,并用差异代谢物提高倍数最多的代谢产物设置不同浓度梯度(0—400 mg·L-1),用含上述不同浓度梯度的NaCl溶液(5‰)浸泡处理耐盐性一般的粳稻品种盐稻8号20 h后置于发芽盒内进行发芽试验,鉴定该代谢产物是否有利于提高耐盐性。共稳定检测到295种代谢产物。利用主成分分析(principal component analysis,PCA)和正交偏最小二乘法分析(orthogonal partial least squares discriminant analysis,OPLS-DA)方法鉴定出71种代谢产物发生显著变化(<0.05),其中盐胁迫后差异代谢物上调42个,下调29个,上调幅度排名前10位的分别为:5-羟基正缬氨酸(5.23倍)、戊烷-1,2,5-三醇(4.10倍)、氰丙氨酸(2.97倍)、L-天冬酰胺(2.91倍)、2-羟基丁酸(2.86倍)、酮戊二酸(2.74倍)、丙酮酸(2.50倍)、鸟氨酸(2.40倍)、瓜氨酸(2.07倍)、脯氨酸(1.94倍),下调幅度排名前10位的分别为:赤藓糖(2.82倍)、木糖酸内酯(2.49倍)、天冬氨酸(2.42倍)、尿苷5'-单磷酸(2.37倍)、胆甾酮(1.90倍)、己糖二酸(1.87倍)、D7-葡萄糖(1.86倍)、5,7-二羟基-4'-甲氧基异黄酮(1.72倍)、氨基磺酸(1.61倍)、6-脱氧半乳糖醛酸(1.61倍)。获得KEGG注释的差异代谢物数量为15个,盐胁迫极显著影响精氨酸代谢、丙氨酸-天冬氨酸-谷氨酸代谢、丁酸酯代谢、碳代谢、赖氨酸降解、氨基酸合成、丁醛酸-二羧酸代谢、三羧酸循环等多条代谢途径。盐稻8号在盐胁迫下(5‰)的发芽率仅为66.7%,外施5-羟基正缬氨酸(20—400 mg·L-1)均能极显著提高盐稻8号盐胁迫条件下(5‰)种子的发芽率(74.3%—90.3%),其中200 mg·L-1浓度处理后发芽率高达90.3%左右。盐胁迫后,稻米中氨基酸和有机酸的含量主要表现为上调,糖类和脂类的含量主要表现为下调;精氨酸代谢和三羧酸循环代谢通路的改变可能是其较为耐盐的原因之一;5-羟基正缬氨酸能够有效缓解盐胁迫对水稻种子发芽的抑制作用,最优浓度为200 mg·L-1。
盐胁迫;代谢组;差异代谢物;代谢通路;GC-MS;稻米
0 引言
【研究意义】水稻是重要的粮食作物之一,提高水稻产量和品质是确保粮食安全生产的关键问题。水稻生长发育进程中会面临各种胁迫因素的限制。近年来,各类极端气候不定时出现,土壤盐碱化问题呈日益加重的趋势。江苏沿海滩涂是省重要的土地资源,海岸泥沙淤积速度较快,每年增长面积达1 333 hm2以上。而水稻是沿海滩涂土壤改良利用的先锋作物,在盐胁迫下,体内发生了复杂的生理变化,为抵御盐害在细胞中积累大量的代谢产量,如叶片中脯氨酸含量会明显提高以调节受盐胁迫时的渗透平衡[1]。虽然基因组学、转录组学和蛋白质组学在植物逆境胁迫研究中取得很多进展,但它们很难涵盖重要的生命活性物质,细胞内许多生命活动发生在代谢物层面,如细胞信号释放、能量传递、细胞间通信等都受代谢物调控,因此代谢组学应运而生。【前人研究进展】与转录组学和蛋白质组学相比,代谢组学专门研究生物体由于基因修饰或外界环境改变引起代谢物的变化,是最接近表型的组学,也是目前组学研究领域热点之一。在干旱、高温及盐多重胁迫下,Sun等[2]利用核磁共振(nuclear magnetic resonance,NMR)技术发现玉米叶片中葡萄糖、果糖、苹果酸、柠檬酸、脯氨酸、丙氨酸、天冬氨酸、天冬酰胺酸及苏氨酸等多种代谢物发生显著变化,这些变化与TCA循环和核心代谢有关。Guo等[3]利用GC-MS对玉米幼苗在中性盐和碱性盐胁迫下代谢组的变化进行了系统分析,发现碱性盐使植物糖异生作用改变,同时抑制光合作用、氮代谢、糖酵解及多种氨基酸的合成。Zhang等[4]利用代谢组学探究不同盐浓度对烟草植株的影响及烟草对盐胁迫的动态响应,发现盐胁迫造成三羧酸循环、谷氨酸介导的脯氨酸生物合成、莽草酸介导的次生代谢产物、核苷酸等代谢途径发生改变。Wu等[5]利用GC-MS技术鉴定出野生和栽培大麦在盐胁迫下有82个差异代谢产物,其中多元醇只有在根系生长和耐盐性中发挥重要作用,野生大麦叶片中具有较高含量的叶绿素和渗透调节物质。Guo等[6]利用GC-MS分析中性盐和碱性盐胁迫对小麦代谢的影响,筛选出75个差异代谢物,主要为有机酸、氨基酸、糖、多元醇等,中性盐胁迫和碱性盐胁迫引起不同的代谢变化。碱性盐胁迫显著抑制光合速率、氮代谢、糖和氨基酸产量降低等。Kim等[7]对拟南芥盐胁迫处理0.5—72 h后进行代谢组研究,检测到氨基酸、糖、糖醇、有机酸和胺的极性代谢物等,发现短时间的盐胁迫处理会影响甲基化循环,苯甲素代谢途径和甜菜碱的生物合成,长时间的盐胁迫会诱导糖酵解、蔗糖代谢和抑制甲基化循环。【本研究切入点】前人利用代谢组学对不同植物进行了逆境胁迫研究,为植物耐盐生理机制提供了新的技术和思路[8-9]。但研究多集中在植物受到逆境胁迫后,叶片或者根中代谢产物和代谢途径发生哪些改变[10-11],且目前对水稻耐盐代谢组学的研究较少,特别是盐胁迫后对水稻籽粒代谢物的影响及代谢通路的分析仍鲜见报道。【拟解决的关键问题】本研究拟采用一耐盐碱性较好的水稻品种长白10号为研究对象,通过测定盐胁迫后对其籽粒中代谢产物的变化,探讨其应对盐胁迫的适应机制,筛选可能的可用于后续水稻品种耐盐性鉴定的标志物。
1 材料与方法
1.1 材料及种植条件
试验所用的水稻材料为耐盐碱的优质粳稻品种长白10号。选取饱满新收获的长白10号种子播种,25—30 d后选取生长健壮、长势一致的秧苗移栽至含遮雨棚的人工盐池(无盐),活苗后盐胁迫组先灌溉浓度为2‰的NaCl水溶液,适应一周后排空水并灌溉4‰ NaCl水溶液继续生长3个月,期间不定时调盐使NaCl浓度保持在4‰左右,对照组整个生长过程无盐胁迫。
1.2 样品采集和提取方法
将同一天开花的颍壳用记号笔做标记,25 d后选取颍壳上有标记的籽粒小心剥去颍壳(不破坏糊粉层),用液氮速冻保存备用。盐胁迫组和对照组6株混合为1个生物学样品,每组7个重复。
样品制备根据王玲[12]的方法加以改进。将种子液氮研磨后精确称取60 mg米粉放入1.5 mL的离心管中,加入含40 μL内标(L-2-氯-苯丙氨酸,0.3 mg·mL-1,甲醇配置)的360 μL冷甲醇,冰水浴超声提取30 min,加入200 μL的氯仿和400 μL的ddH2O涡旋2 min后,冰水浴再超声提取30 min,低温离心20 min(13 000 r/min,4℃)后取300 μL的上清液装入玻璃衍生瓶中用离心浓缩干燥器挥干样品,加入80 μL的甲氧胺盐酸盐吡啶溶液(15 mg·mL-1),涡旋后于37℃震荡培养箱中90 min进行肟化反应。将样本取出后再加入80 μL的BSTFA(含1%TMCS)衍生试剂和20 μL的正己烷,加入11种内标(C8/C9/C10/C12/C14/C16,0.8 mg·mL-1;C18/C20/C22/C24/C26,0.4 mg·mL-1,均为氯仿配置)10 μL,涡旋震荡2 min后,于70℃反应60 min。取出样本后,在室温放置30 min,进行GC-MS代谢组学分析。
1.3 GC-MS分析
色谱条件:DB-5MS毛细管柱(30 m×0.25mm×0.25 μm,Agilent J&W Scientific,Folsom,CA,USA),载气为高纯氦气,流速1.0 mL·min-1,进样口的温度为260℃。进样量1 μL,不分流进样,溶剂延迟5 min。程序升温:柱温箱的初始温度为60℃,以8℃·min-1程序升温至125℃,5℃·min-1升温至210℃;10℃·min-1升温至270℃,20℃·min-1升温至305℃保持5 min。
质谱条件:电子轰击离子源(Electron Impact,EI),离子源温度230℃,四级杆温度150℃,电子能量70 eV。扫描方式为全扫描模式,质量扫描范围:50—500 m·z-1。
1.4 数据处理
将GC/MS的原始数据经Analysisbasefileconvert软件转换格式后倒入MS-DIAL软件进行预处理,利用主成分分析PCA、正交偏最小二乘法分析(OPLS-DA)等多元统计分析和T检验筛选组间的差异代谢物。差异代谢物通过KEGG数据库(https://www. kegg.jp/)比对并注释。
1.5 盐胁迫下种子发芽试验
选用耐盐性一般的水稻品种盐稻8号,挑选籽粒饱满无霉点的种子进行发芽试验。试验设对照、5‰盐胁迫两大组,其中盐胁迫组用含5-羟基正缬氨酸(0—400 mg·L-1)的NaCl溶液(5‰)浸种20 h后置于发芽盒内进行发芽试验,其间不定时添加同等体积的NaCl溶液(5‰)保持湿度。发芽箱温度设28℃,光照/黑暗时间设为16 h/8 h。6 d后统计发芽率,根长和苗高二者之和大于0.5 cm视为发芽。试验设3个重复。
2 结果
2.1 盐胁迫下籽粒中代谢组学的主成分分析
盐胁迫组与对照组抽穗期和分蘖数无显著差异,但盐胁迫组平均株高和平均穗长均极显著低于对照组(株高分别为82.4和91.5 cm(<0.01);穗长分别为13.3和16.1 cm,(<0.01)),说明长白10号对盐胁迫有一定的耐受性,但生长发育仍受到一定程度的抑制。
为鉴定盐胁迫组和对照组稻米样品间的差异,首先采用无监督的PCA方法观察样品间的总体分布趋势,共得到2个主成分(图1-A),2组稻米样品均处于置信区间内。由于该方法无法忽略组内误差、消除与研究目的无关的随机误差,故不利于发现组内差异。OPLS-DA是有监督的判别分析统计方法,可滤除与分类信息无关的噪音,最大化地凸显组别间的差异。如图1-B所示,盐胁迫组和对照组7个生物学重复数据点能分别很好地集中在一起并分成2组,说明2组样品的代谢产物在种类、含量等方面存在差异。
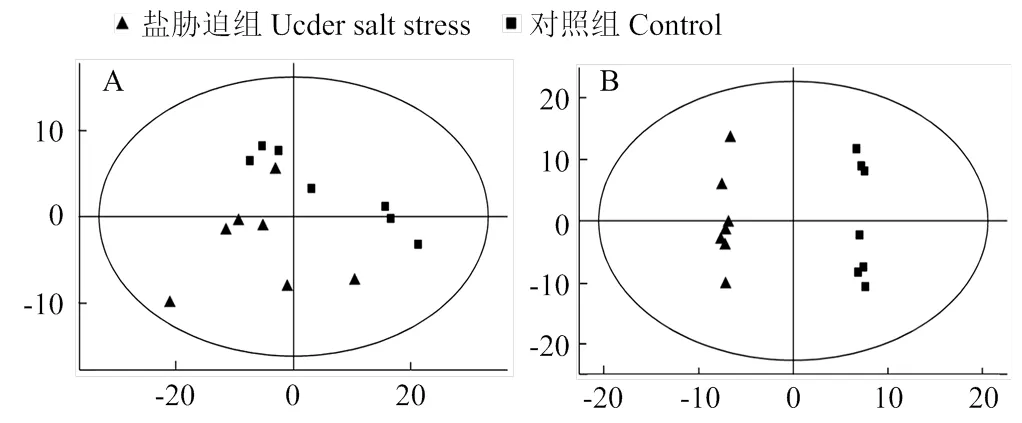
图1 盐胁迫组与对照组代谢产物PCA散点图(A)与OPLS-DA散点图(B)
2.2 盐胁迫下籽粒中的差异代谢物
在盐胁迫处理组和对照组样品中共检测到295种代谢产物。OPLS-DA分析中,变量权重值(variable important in projection,VIP)大于1的代谢物被认为是差异代谢物,通过T检验,共筛选到存在显著差异的代谢物71个,其中,上调代谢物42个,下调代谢物29个。将所有显著差异代谢物表达量进行层次聚类(图2),可更直观地看出差异代谢物在盐胁迫组和对照组间的表达差异。其中上调代谢物的差异倍数都在1.9倍以上,最大的为5.2倍(5-羟基正缬氨酸,图3)。
2.3 差异代谢物涉及精氨酸合成等18条代谢通路
生物体中复杂的代谢反应一般由多个基因和蛋白质互相影响和调控,最终导致代谢组发生系统性改变。利用差异代谢物的KEGG ID进行通路富集分析,获得代谢通路富集结果。应用超几何检验,找出与整个背景相比,在显著性差异表达代谢物中显著富集的pathway条目(图4)。71种差异代谢物共14种(9个上调,多为氨基酸和有机酸类,5个下调,多为糖类和淄醇类)被注释到41个代谢通路中,其中18个代谢通路发生显著或极显著变化。前10位发生极显著改变的代谢通路分别是精氨酸合成、丙氨酸-天冬氨酸-谷氨酸代谢、丁酸酯代谢、碳代谢、赖氨酸降解、氨基酸合成、丁醛酸-二羧酸代谢、TCA循环、牛磺酸和亚牛磺酸代谢、C5支链二元酸代谢。
2.4 差异代谢物5-羟基正缬氨酸极显著提高盐胁迫条件下种子的发芽率
将差异代谢物提高倍数最高的5-羟基正缬氨酸配置成0—400 mg·L-1溶液,浸泡盐稻8号水稻(耐盐性一般)种子20 h,统计种子发芽率(图5-A),在无盐胁迫的清水中,盐稻8号种子发芽率几乎均为100%,说明所挑选的种子发芽率极高且整齐一致。5‰盐胁迫后发芽率急剧下降仅为66.7%,外源5-羟基正缬氨酸20—400 mg·L-1浸种处理均极显著提高5‰盐胁迫下种子的发芽率,其中,浓度200 mg·L-1处理后发芽率高达90.3%左右(图5-B)。
3 讨论
水稻是世界上最重要的粮食作物之一,全球有近一半人口以稻米为主食。稻米的品质除了与品种有关外,与栽培方式和生长环境密切相关。水稻在生长发育过程中常常会受到生物(病虫害)或非生物胁迫(温度、光照、盐碱、水分等)的影响[13]。当水稻处于不利生长环境中,常通过激活相关基因与代谢通路以减轻各胁迫对水稻的伤害,因此,水稻籽粒的代谢产物和营养品质极易发生变化。前人研究已鉴定出许多关键的胁迫相关功能基因[14-18],如DST为一个转录因子,通过直接调节过氧化氢H2O2代谢相关基因的表达,控制气孔保卫细胞中的H2O2含量,调节气孔的开度,从而影响水稻的耐旱性和耐盐性[19]。然而植物抗逆调节是个复杂的调控网络,目前,植物抗逆代谢组学研究大都集中在植物受到逆境胁迫后,叶片或者根中代谢产物和代谢途径发生哪些改变[10-11],而逆境胁迫后与稻米食味和营养品质息息相关的籽粒中哪些代谢产物和代谢途径发生改变的研究还鲜有报道。
稻米中含有丰富的蛋白质、膳食纤维、糖类、脂肪类等营养成分。本研究利用GC-MS在稻米中共检测出包括有机酸、有机氧化合物、氨基酸、糖类、脂类、醇类、核苷酸等295种代谢产物。盐胁迫处理后稻米籽粒中有71个代谢产物发生显著(<0.05)或极显著(<0.01)变化。代谢产物上调幅度最大的为5-羟基正缬氨酸、戊烷-1,2,5-三元醇、氰丙氨酸、天冬酰胺、羟丁酸、酮戊二酸、丙酮酸、鸟氨酸、瓜氨酸、脯氨酸。有研究表明5-羟基正缬氨酸可能与植物抗虫和耐逆有关。Yan等[20]发现当玉米遭受蚜虫、毛虫啃咬或者干旱胁迫时,叶片内会大量积聚5-羟基正缬氨酸。本研究也发现盐胁迫组5-羟基正缬氨酸的含量是对照组的5.23倍。外源5-羟基正缬氨酸是否能提高植物耐盐性?本研究利用不同浓度外源5-羟基正缬氨酸浸种处理均提高了盐胁迫条件下种子的发芽率,其中200 mg·L-1为最优浓度。目前,有关5-羟基正缬氨酸的报道极少,其生物合成与代谢途径尚不清楚,根据其分子量小易溶于水的特性,推测它也许与脯氨酸的作用类似,参与渗透平衡调节,在应激防御机制中起重要作用。盐胁迫条件下,经5-羟基正缬氨酸处理的水稻种子发芽率提高,可能正是因为其充当了细胞内部渗透调节物质,减少了水分外流,提高了盐胁迫下种子对水分的吸收。氰化物是植物体内广泛存在的一类小分子类代谢产物,对植物生长一般有抑制作用。产氰作用是植物适应外界环境的一种反应机制。当水稻遭受盐胁迫后,盐敏感植株一般表现为植株矮小,开花延迟等表型。这可能是由于植物体内的氰化物抑制了依赖于细胞色素的呼吸电子传递,导致细胞中能量供应受抑制[21],从而产生盐害表型。而长白10号是耐盐碱的水稻品种,盐胁迫处理后植株盐害表现较轻,籽粒中氰丙氨酸和天冬酰胺的含量分别提高了2.97和2.91倍,这可能是由于长白10号体内氰丙氨酸合成酶活力较高,催化转化了氰化物生成氰丙氨酸,并被进一步转变为天冬酰胺而进入水稻的氨基酸库。这也可能是在差异代谢物含量提高倍数前10名的代谢产物中,有6种为氨基酸的原因之一。因此,稻米籽粒中5-羟基正缬氨酸、氰丙氨酸和天冬酰胺的含量也许可成为评价水稻品种耐盐的指标之一,相关推测有待进一步研究验证。脯氨酸是重要的渗透调节物质,维持原生质和环境渗透平衡。大量研究发现逆境胁迫后都会造成植物体内脯氨酸含量的上升[22-23]。有机酸中的酮戊二酸是多数氨基酸分解的产物,又是合成谷氨酸的底物,而谷氨酸又是合成脯氨酸的底物。因此盐胁迫下酮戊二酸含量的上升可能与其他氨基酸向谷氨酸和脯氨酸的转化有关。盐胁迫下大量积累的有机酸,可与Na+结合,从而减轻盐的毒害作用[24]。
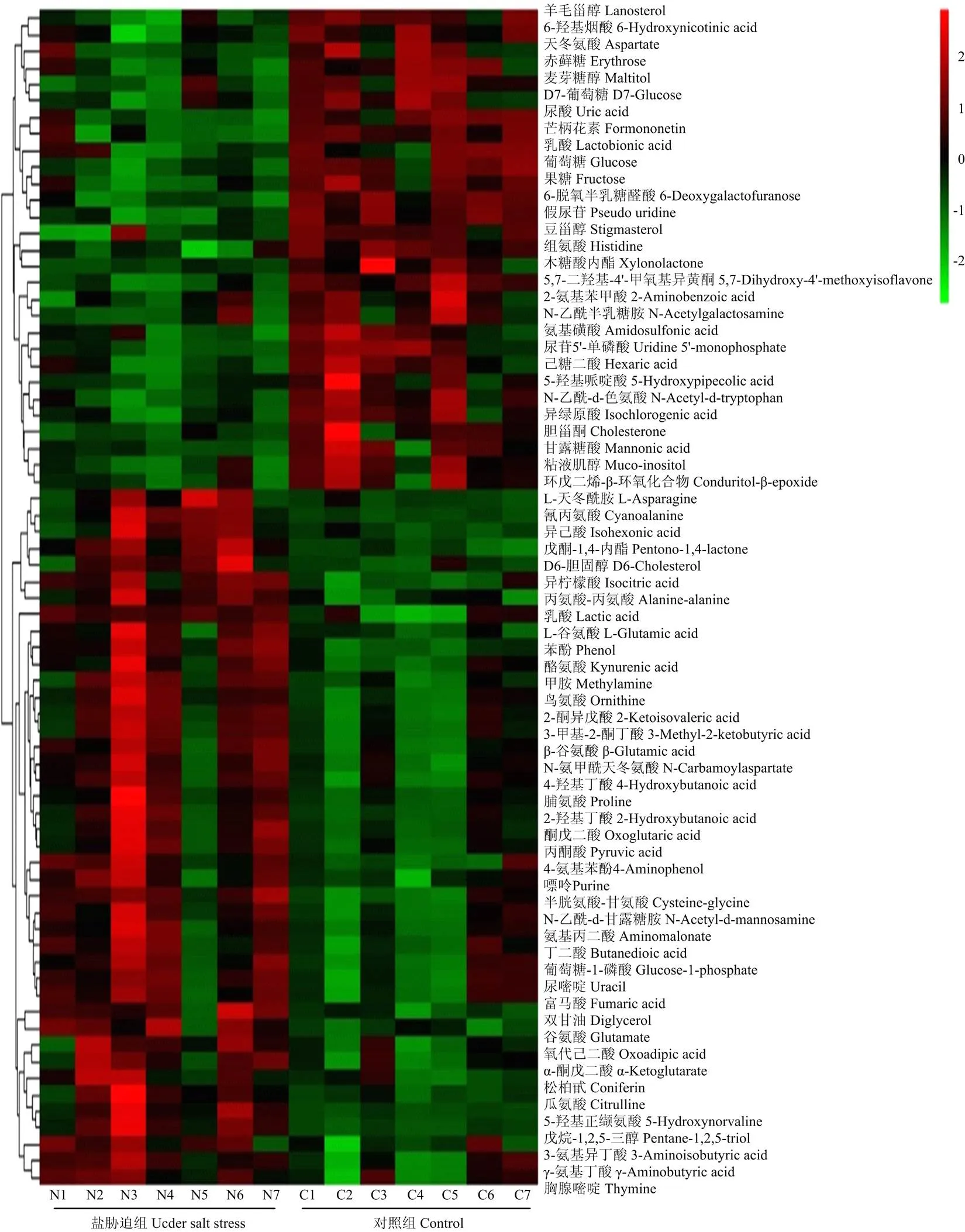
颜色从绿到红表示代谢物的表达丰度从低到高 The color from green to red indicates the expression abundance of metabolites from low to high
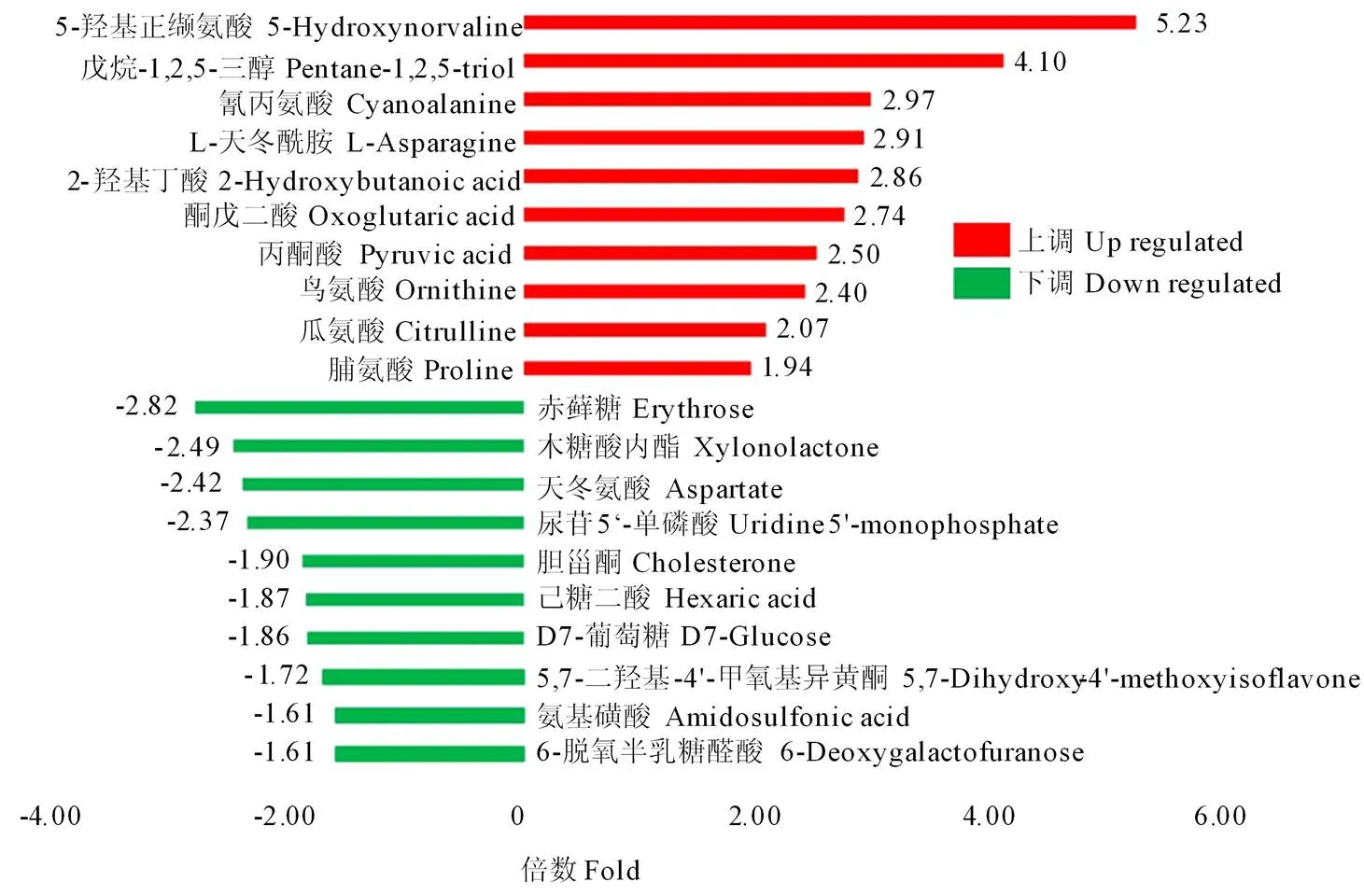
图3 盐胁迫后上调和下调差异倍数分别排在前10位的代谢物
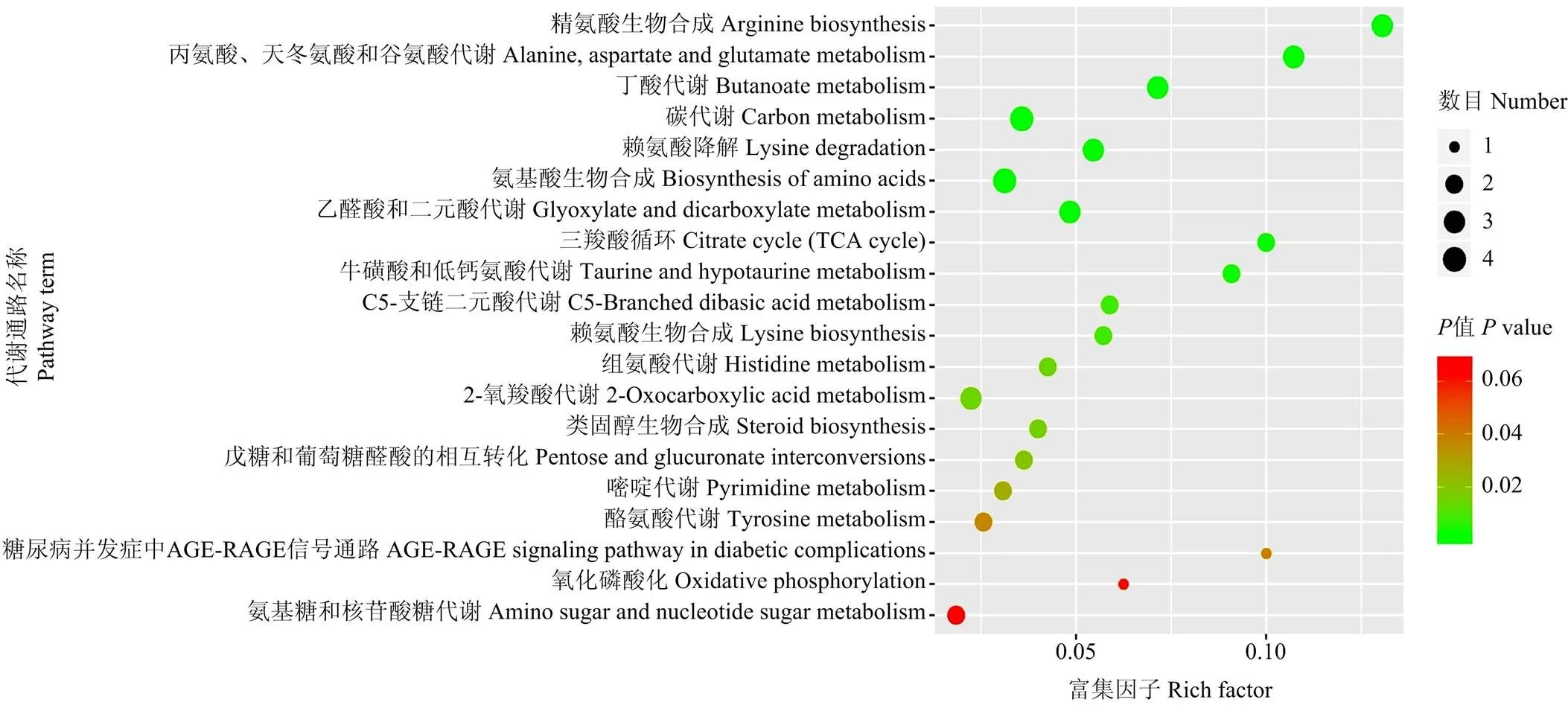
图4 盐胁迫组/对照组前20位代谢通路气泡图
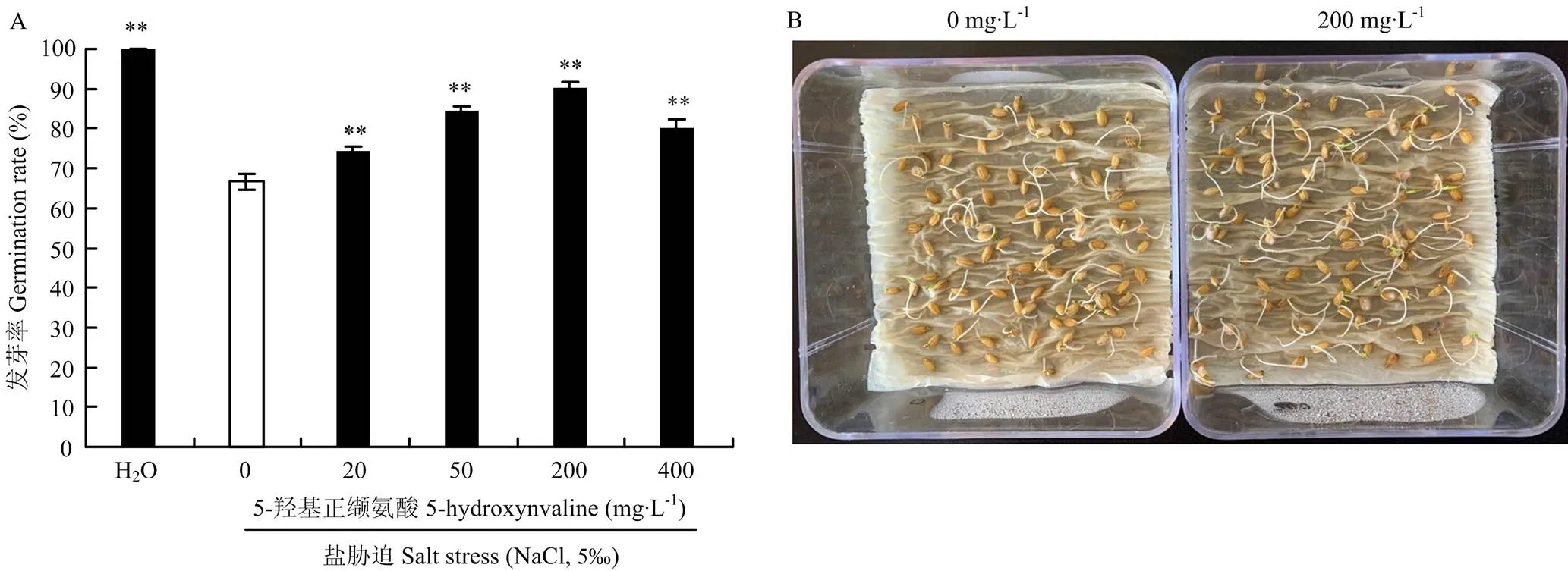
A:发芽率;B:5-羟基正缬氨酸(200 mg·L-1)浸种(右图)与未处理对照(左图)在5‰盐胁迫下生长6 d对比图。**代表各处理间差异显著(P<0.01)
在71个差异代谢物中,代谢产物上调的多为有机酸和氨基酸类。差异代谢物下调的主要为糖类和脂类。有14个差异代谢物显著或极显著影响精氨酸合成、丙氨酸-天冬氨酸-谷氨酸代谢、TCA循环等18个代谢通路,其中氨基酸类代谢通路占8个,说明盐胁迫显著影响了水稻体内氨基酸类的代谢。周根友等[25]也发现盐稻12号和盐稻8号发生盐胁迫后稻米中总蛋白质含量升高,直链淀粉含量下降,垩白度提高。稻米蛋白质含量与稻米食味品质呈极显著负相关关系[26],因此盐胁迫后米饭口感一般较差,但氨基酸是稻米营养品质的重要组成之一,所以盐胁迫后稻米的营养品质提升。糖类含量的下降可能是导致淀粉含量下降和垩白度提高的原因之一。
在前18个受盐胁迫影响的代谢通路中,排名第一的是精氨酸代谢通路。虽然没有检测到精氨酸含量有显著变化,这可能是因为精氨酸是多胺、一氧化氮、谷氨酸等重要物质的生物合成前体,而且也检测到谷氨酸以及精氨酸生成一氧化氮后另一代谢物瓜氨酸含量的大幅上调。而多胺和一氧化氮参与植物的抗盐性[27-30]。另外精氨酸酶活性的提高也有利于提高植物的抗逆性,其催化产物鸟氨酸可直接形成含氮信使分子腐胺,提高植物的抗逆性[15]。本研究也发现鸟氨酸的含量上调了2.4倍,这可能也间接说明了长白10号受盐胁迫后精氨酸酶活力增强,从而提高了耐盐性。TCA循环是三大营养素(糖类、脂类、氨基酸)的最终代谢通路,又是糖类、脂类、氨基酸和核酸代谢联络与转化的枢纽[31-32]。在盐胁迫下,水稻体内原有的稳态被打破,需要合成大量物质来转运离子、稳定渗透压、消除活性氧、修复受损的生物大分子等,以调节很多生理代谢建立新的内稳态环境。植物通过调整TCA循环一方面提高能量供给;另一方面为抗盐代谢中的物质合成提供原料。酮戊二酸和琥珀酸这两种差异代谢物KEGG注释到三羧酸循环(TCA cycle)代谢通路。研究发现这两个差异代谢物还参与到除嘧啶代谢通路的其他17条显著或极显著受影响的代谢通路中,说明这两种代谢物是联系多条代谢通路的枢纽。
4 结论
鉴定出71种差异代谢物(上调42个,下调29个),其中14个差异代谢物显著或极显著影响了18个代谢通路。精氨酸代谢和TCA循环代谢通路的改变可能是其较为耐盐的原因之一。盐胁迫后稻米中氨基酸和有机酸的含量主要表现为上调,糖类和淄醇类的含量主要表现为下调。外源5-羟基正缬氨酸能有效缓解盐胁迫对水稻种子发芽的抑制作用,提高发芽率。
[1] DEMIRAL T, TÜRKAN I. Exogenous glycinebetaine affects growth and proline accumulation and retards senescence in two rice cultivars under NaCl stress. Environmental and Experimental Botany, 2006, 56(1): 72-79.
[2] SUN C X, LI M Q, GAO X X, LIU L N, WU X F, ZHOU J H. Metabolic response of maize plants to multi-factorial abiotic stresses. Plant Biology, 2016, 18(1): 120-129.
[3] GUO R, SHI L X, YAN C R, ZHONG X L, GU F X, LIU Q, XIA X, Li H R. Ionomic and metabolic responses to neutral salt or alkaline salt stresses in maize (L.) seedlings. BMC Plant Biology, 2017, 17: 41.
[4] ZHANG J T, ZHANG Y, DU Y Y, CHEN S Y, TANG H R. Dynamic metabonomic responses of tobacco () plants to salt stress. Journal of Proteome Research, 2011, 10(4): 1904-1914.
[5] WU D Z, CAI S G, CHEN M X, YE L Z, CHEN Z H, ZHANG H T, DAI F, WU F B, ZHANG G P. Tissue metabolic responses to salt stress in wild and cultivated barley. PLoS ONE, 2013, 8(1): e55431.
[6] GUO R, YANG Z Z, LI F, YAN C R, ZHONG X L, LIU Q, XIA X, LI H R, ZHAO L. Comparative metabolic responses and adaptive strategies of wheat () to salt and alkali stress. BMC Plant Biology, 2015, 15: 170.
[7] KIM J K, BAMBA T, HARADA K, FUKUSAKI E, KOBAYASHI A. Time-course metabolic profiling incell cultures after salt stress treatment. Journal of Experimental Botany, 2006, 58(3): 415-424.
[8] 倪建伟, 杨秀艳, 张华新, 倪元颖, 武海雯, 魏琦. 代谢组学在植物逆境胁迫研究中的应用. 世界林业研究, 2014, 27(5): 11-17.
NI J W, YANG X Y, ZHANG H X, NI Y Y, WU H W, WEI Q. Metabolimics and its application in the crop research under abiotic stress. World Forestry Research, 2014, 27(5): 11-17. (in chinese)
[9] 张晓磊, 张瑞英. 代谢组学及其在农作物研究中的应用. 生物技术通讯, 2018, 29(3): 446-450.
ZHANG X L, ZHANG R Y. Metabolimics and its application in the crop research. Letters in biotechnology, 2018, 29(3): 446-450. (in chinese)
[10] OBATA T, WITT S, LISEC J, PALACIOS-ROJAS N, FLOREZ- SARASA I, YOUSFI S, ARAUS J L, CAIRNS J E, FERNIE A R. Metabolite profiles of maize leaves in drought, heat, and combined stress field trials reveal the relationship between metabolism and grain yield. Plant Physiology, 2015, 169(4): 2665-2683.
[11] DARKO E, GIERCZIK K, HUDAK O, FORGO P, PAL M, TURKOSI E, KOVACS V, DULAI S, MAJLATH I, MOLNAR I, JANDA T, MOLNAR-LANG M. Differing metabolic responses to salt stress in wheat-barley addition lines containing different 7H chromosomal fragments. PLoS ONE, 2017, 12(3): e0174170.
[12] 王玲. 转基因水稻的代谢组学研究[D]. 北京: 北京化工大学, 2013.
WANG L. Metabolimics research in transgenic rice [D]. Beijing: Beijing University of Chemical Technology, 2013. (in Chinese)
[13] MUKHERJEE S, SENGUPTA S, MUKHERJEE A, BASAK P, MAJUMDER A L. Abiotic stress regulates expression of galactinol synthase genes post-transcriptionally through intron retention in rice. Planta, 2019, 249(3): 891-912.
[14] TANG Y, BAO X, ZHI Y, WU Q, GUO Y, YIN X, ZENG L, LI J, ZHANG J, HE W, LIU W, WANG Q, JIA C, LI Z, LIU K. Overexpression of a MYB family gene, OsMYB6, increases drought and salinity stress tolerance in transgenic rice. Frontiers in Plant Science, 2019, 10: 168.
[15] ISLAM M O, KATO H, SHIMA S, TEZUKA D, MATSUI H, IMAI R. Functional identification of a rice trehalase gene involved in salt stress tolerance. Gene, 2019, 685: 42-49.
[16] PAIVA A L S. PASSAIA G, LOBO A K M, JARIM-MESSEDER D, SILVEIRA J A G, MARGIS-PINHEIRO M. Mitochondrial glutathione peroxidase (OsGPX3) has a crucial role in rice protection against salt stress. Environmental and experimental botany, 2019, 158: 12-21.
[17] LI Z, FU X, TIAN Y, XU J, GAO J, WANG B, HAN H, WANG L, ZHANG F, ZHU Y, HUANG Y, PENG R, YAO Q. Overexpression of a trypanothione synthetase gene from, TcTrys, confers enhanced tolerance to multiple abiotic stresses in rice. Gene, 2019, 710: 279-290.
[18] ZHANG A, LIU Y, WANG F, LI T, CHEN Z, KONG D, BI J, ZHANG F, LUO X, WANG J, TANG J, YU X, LIU G, LUO L. Enhanced rice salinity tolerance via CRISPR/Cas9-targeted mutagenesis of thegene. Molecular Breeding, 2019, 39(3): 47.
[19] HUANG X Y, CHAO D Y, GAO J P, ZHU M Z, SHI M, LIN H X. A previously unknown zinc finger protein, DST, regulates drought and salt tolerance in rice via stomatal aperture control. Genes Development, 2009, 23(15): 1805-1817.
[20] YAN J, LIPKA A E, SCHMELZ E A, BUCKLER E S, JANDER G. Accumulation of 5-hydroxynorvaline in maize () leaves is induced by insect feeding and abiotic stress. Journal of Experimental Botany, 2014, 66(2): 593-602.
[21] 余璐璐, 刘杨, 徐飞. 氰化物的来源及其在植物中的功能研究进展. 生命科学, 2019, 31(2): 12-18.
YU L L, LIU Y, XU F. The source of cyanide and its function in plants. Chinese Bulletin of Life Sciences, 2019, 31(2): 12-18. (in Chinese)
[22] FORLANI G, BERTAZZINI M, CAGNANO G. Stress-driven increase in proline levels, and not proline levels themselves, correlates with the ability to withstand excess salt in a group of 17 Italian rice genotypes. Plant Biology, 2019, 21(2): 336-342.
[23] GERONA M E B, DEOCAMPO M P, EGDANE J A, ISMAIL A M, DIONISIO-SESE M L. Physiological responses of contrasting rice genotypes to salt stress at reproductive stage. Rice Science, 2019, 26(4): 207-219.
[24] LIU J, SHI D C. Photosynthesis, chlorophyll fluorescence, inorganic ion and organic acid accumulations of sunflower in responses to salt and salt-alkaline mixed stress. Photosynthetica, 2010, 48(1): 127-134.
[25] 周根友, 翟彩娇, 邓先亮, 张蛟, 张振良, 戴其根, 崔士友. 盐逆境对水稻产量、光合特性及品质的影响. 中国水稻科学, 2018, 32(2): 146-154.
ZHOU G Y, ZHAI C J, DENG X L, ZHANG J, ZHANG Z L, DAI Q G, CUI S Y. Performance of yield, photosynthesis and grain quality of japonica rice cultivars under salinity stress in micro-plots. Chinese journal of rice science, 2018, 32(2): 146-154. (in chinese)
[26] 谢黎虹, 罗炬, 唐绍清, 陈能, 焦桂爱, 邵高能, 魏祥进, 胡培松. 蛋白质影响水稻米饭食味品质的机理. 中国水稻科学, 2013, 27(1): 91-96.
XIE L H, LUO J, TANG S Q, CHEN N, JIAO G A, SHAO G N, WEI X J, HU P S. Proteins affect rice eating quality properties and its mechanism.Chinese journal of rice science, 2013, 27(1): 91-96. (in chinese)
[27] AHMAD P, ABDEL LATEF A A, HASHEM A, ABD_ALLAH E F, GUCEL S, TRAN L S P. Nitric oxide mitigates salt stress by regulating levels of osmolytes and antioxidant enzymes in chickpea. Frontiers in Plant Science, 2016, 7: 347.
[28] JOSEPH E A, RADHAKRISHNAN V V, MOHANAN K V. Variation in total polyamine content in some native rice cultivars of North Kerala, India in response to salinity stress. Biotechnology, 2016, 9(5): 731-738.
[29] KHUSHBOO K, SHEKHAWAT G S. Nitric oxide improved salt stress tolerance by osmolyte accumulation and activation of antioxidant defense system in seedling of(L.) Czern. Vegetos, 2019, 32: 583-592.
[30] YASTREB T O, KOLUPAEV Y E, KARPETS Y V, DMITRIEV A P. Effect of nitric oxide donor on salt resistance ofjin1 mutants and wild-type plants. Russian journal of plant physiology, 2017, 64(2): 207-214.
[31] MARTINEZ-REYES I, DIEBOLD L P, KONG H, SCHIEBER M, HUANG H, HENSLEY C T, MEHTA M M, WANG T, SANTOS J H, WOYCHIK R, DUFOUR E, SPELBRINK J N, WEINBERG S E, ZHAO Y, DEBERARDINIS R J, CHANDEL N S. TCA Cycle and mitochondrial membrane potential are necessary for diverse biological functions. Molecular Cell, 2016, 61(2): 199-209.
[32] ZHANG Y, BEARD K F M, SWART C, BERGMANN S, KRAHNERT I, NIKOLOSKI Z, GRAF A, RATCLIFFE R G, SWEETLOVE L J, FERNIE A R, OBATA T. Protein-protein interactions and metabolite channelling in the plant tricarboxylic acid cycle. Nature Communications, 2017, 8(1): 15212.
Analysis of differential metabolites in grains of rice cultivar Changbai 10 under salt stress
Zhang Guiyun, Zhu Jingwen, Sun Mingfa, Yan Guohong, Liu Kai, Wan Baijie, Dai Jinying, ZHU GuoYong
Jiangsu institute of Agricultural sciences in coastal region, Yancheng 224001, Jiangsu
【】To reveal the influence of salt stress on metabolites and metabolism pathway in the rice seed of Changbai 10, understand the mechanism of its salt tolerance, and screen possible markers for salt tolerant rice varieties. 【】Gas chromatography-mass spectrometry (GC-MS) was used to analyze the changes of metabolites in the seeds (25 days after flower) of a saline tolerancerice Changbai 10 under salt stress (4‰). The rice variety Yandao 8 with moderate salt tolerance was treated with the metabolite which was the highest improvement among the different metabolites to identify whether it could improve the salt tolerance. The treatment methods were as follows: Yandao 8 seeds were soaked in NaCl solution (5‰) containing the metabolite with different concentration gradient (0-400 mg·L-1), after 20 hours, the seeds were put in germination box for germination test.【】A total of 295 metabolites were detected in the samples. Principal component analysis (PCA) and orthogonal partial least-squares-discriminant analysis OPLS-DA were performed to visualize the metabolic difference among experimental groups. The results revealed a total of 71 metabolites were significantly changed (42 up-regulated and 29 down-regulated) under salt stress. The top ten up-regulated metabolites were 5-hydroxynorvaline (5.23 fold), Pentane-1,2,5-triol (4.10 fold), Cyanoalanine (2.97 fold), L-asparagine (2.91 fold), 2-hydroxybutanoic acid (2.86 fold), Oxoglutaric acid (2.74 fold), Pyruvic acid (2.50 fold), Ornithine (2.40 fold), Citrulline (2.07 fold), Proline (1.94 fold). And the top ten down-regulated metabolites were Erythrose (2.83 fold), Xylonolactone (2.49 fold), Aspartate (2.42 fold), Uridine 5’-monophosphate (2.37 fold), Cholesterone (1.90 fold), Hexaric acid (1.87 fold), D7-glucose (1.86 fold), 5,7-dihydroxy-4’-methoxyisoflavone (1.72 fold), Amidosulfonic acid (1.61 fold), 6-deoxygalactofuranose (1.61 fold). Among them, 15 differential metabolites were KEGG annotated and significantly(<0.01) affected arginine biosynthesis, alanine, aspartate and glutamate metabolism, butanoate metabolism, carbon metabolism, lysine degration, biosynthesis of amino acids, glyoxylate and dicarboxylate metabolism, citrate cycle (TCA cycle) and so on. The germination rate of Yandao 8 was only 66.7% under salt stress (5‰), significantly lower than that with exogenous 5-hydroxynvaline treatment (74.3-90.3%). The result revealed that germination rate of the seeds with 200 mg·L-15-hydroxynvaline treatment was the highest.【】Amino acid and organics acid were mainly up regulated, while sugar and lipid were mainly down regulated in salt treated group. The changed metabolism pathway of Arginine biosynthesis and TCA cycle might contribute to its high salt tolerance. 5-hydroxynvaline could effectively alleviate the inhibition of salt stress on rice seeds germination, and the optimal concentration is 200 mg·L-1.
salt stress, metabolome; differential metabolite; metabolic pathway; GC-MS; rice

10.3864/j.issn.0578-1752.2021.04.001
2019-11-21;
2020-02-18
江苏省自然科学基金(BK20170470)、江苏省重点研发计划(BE2018357-3)、江苏省农业科技自主创新资金(CX(20)3033)
张桂云,Tel:13815586138;E-mail:yisuo_yisuo@sina.com。通信作者朱国永:E-mail:280684201@qq.com
(责任编辑 李莉)
