基于类器官模型的宫颈癌铂类化疗药物敏感性的免疫组化指标分析与探索
2021-03-08程忠平
许 玉,程忠平
(1.上海交通大学医学院附属第九人民医院妇产科,上海 200011;2.同济大学附属第十人民医院妇产科,上海 200072)
宫颈癌是女性中第4位常见癌症和癌症死亡原因。化疗是宫颈癌治疗重要的组成部分。基于顺铂的方案一直是宫颈癌化疗首选,但是部分患者对铂类耐药。因此,对宫颈癌患者进行化疗药物敏感性检测,对于个体化治疗具有重要的指导意义。其中,三磷酸腺苷-生物荧光肿瘤体外药物敏感性检测技术(ATP-TCA)具有灵敏度高、精确度高、重复性好等优势[1]。此外,采用新型3D细胞培养类器官模型,能够接近或重现肿瘤真实的病理生理特征[2],较准确地评估肿瘤对化疗药物的敏感性。但是宫颈癌药物敏感性检测尚未普及,需要有效的化疗药物敏感性预测手段进行补充。国内外研究表明,免疫组化指标癌胚抗原(carcinoembryonic antigen,CEA)、细胞角蛋白5/6(cytokeratin 5/6,CK5/6)、细胞角蛋白7(cytokeratin 7,CK7)、细胞增殖相关抗原Ki-67、肿瘤蛋白16(tumer protein 16,p16)、肿瘤蛋白53(tumer protein 53,p53)、肿瘤蛋白63(tumer protein 63,p63),与肿瘤对铂类药物的敏感性之间存在一定的相关性[3-9]。因此,本研究基于类器官模型,旨在通过以上免疫组化指标,对宫颈癌铂类化疗药物敏感性进行分析与探索。
1 资料与方法
1.1 一般资料
研究对象为2018年3月—2020年1月同济大学附属第十人民医院妇产科住院的宫颈癌患者共24例,术前病理诊断明确,肉眼病灶直径≥1.5cm,征得患者和家属同意行肿瘤化疗药物敏感性检测。研究经同济大学附属第十人民医院伦理委员会批准(SHSY-IEC-4.1/20-128/01)。无菌操作下自术中刚离体的肿瘤中切取标本,4℃冷藏转运至实验室,其余标本送病理科行免疫组织化学检测。患者年龄31~81岁,平均(57.9±12.0)岁;按2018国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)宫颈癌分期:Ⅰ期7例、Ⅱ期12例、Ⅲ期3例、Ⅳ期2例;病理诊断为鳞癌21例,腺癌3例,其中低分化9例,低-中分化8例,中分化5例,中-高分化1例;原发性癌22例,复发性癌2例;术前有放疗史1例,术前有顺铂化疗史5例。
化疗药物顺铂、卡铂、奈达铂、吉西他滨、紫杉醇、多西他赛化疗药物均购自美国Selleck公司。75%乙醇为国产,Hank’s平衡盐溶液(Hank’s balanced salt solution,HBSS)购自美国Cellgro公司。Ⅳ型胶原酶、1640培养基、10%胎牛血清、三抗(青霉素、链霉素、抗真菌抗生素)、双抗(青霉素、链霉素)为美国赛默飞世尔公司GIBCO品牌。氯化钙溶液、二甲基亚砜(dimethyl sulfoxide,DMSO)购自美国Sigma公司。淋巴细胞分离液购自加拿大Cedarlane公司,无血清培养基购自瑞士LONZA公司。CellTiter-Glo荧光细胞活性检测试剂购自美国Promega公司。
1.2 宫颈癌3D细胞化疗药物敏感性检测方法
(1) 制备细胞悬液:将肿瘤组织用75%乙醇快速浸泡,用含三抗的HBSS冲洗。将组织切成1~3mm3小块,加入Ⅳ型胶原酶混合溶液,37℃消化1~2h,每20min吹打混匀1次。当组织块出现絮状且细胞数目较多时,用含有双抗的完全1640培养液终止消化。通过70μm细胞滤膜收集细胞悬液,离心后加入无血清培养基重悬。
(2) 药物处理及3D细胞培养:取出-20℃保存的400倍最高浓度化疗药物,自然解冻并混匀。使用无血清培养基稀释药物至10倍浓度,再依次对半稀释,制备200%、100%、50%、25%、12.5%、6.25%标准浓度的药物。100%标准浓度为化疗药物的血浆峰值浓度(peak plasma concentration,PPC)。根据相关文献[10-11]各药物的PPC为:顺铂6.3μg/mL、卡铂25μg/mL、奈达铂5.3μg/mL、紫杉醇13.8μg/mL、多西他赛10μg/mL、吉西他滨25μg/mL。96孔低吸附板每孔分别加入15μL不同浓度药物,从上至下浓度依次递减,不同种类药物孔横向并列排列。左侧设置一列对照孔(M1),每孔加入15μL无血清培养基,右侧设置另一列对照孔(M0),分别加入15μL浓度递减的DMSO。每孔加入135μL细胞悬液,细胞密度约为104个/孔,其中对照孔M1只加入135μL无血清培养基。37℃ 5%CO2细胞培养箱中培养6d。
(3) ATP-TCA检测:每孔加入50μL CellTiter-Glo试剂,振荡5min,室温孵育30min。每孔取80μL 溶液转入不透明96孔板,放入GloMax发光检测仪检测荧光发光值。
(4) 评价宫颈癌3D细胞对化疗药物的敏感性:计算化疗药物每个浓度对宫颈癌3D多细胞肿瘤球的抑制率(inhibition rate,IR)。
(X为药物孔发光值,M1为无细胞孔发光值,M0为DMSO孔发光值平均值)
以药物浓度为自变量、抑制率为因变量绘制药物抑制曲线,采用Origin 8.5软件进行非线性拟合,函数模型选择Logistic。Origin根据药物抑制曲线计算出IC50和IC90。
化疗药物敏感性评价标准[12]:IC90≤100%测试药物浓度(test drug concentration,TDC)和IC50≤25%TDC,强敏感;IC90>100%TDC和IC50≤25%TDC,中度敏感;IC90≤100%TDC和IC50>25%TDC,弱敏感;IC90>100%TDC和IC50>25%TDC,耐药;敏感组包括强敏感和中度敏感,不敏感组包括弱敏感和耐药。(100%TDC即药物PPC)
1.3 免疫组织化学检测
宫颈癌标本送病理科行免疫组织化学检测,检测CEA、CK5/6、CK7、Ki-67、p16、p53、p63及其他分子标志物。对免疫组化指标表达水平进行分级:对于CEA、CK5/6、CK7、p16、p53、p63,阳性、强阳性为高表达。部分阳性、少量阳性、弱阳性和阴性为低表达;Ki-67≥60%为高表达,Ki-67<60%为低表达。
1.4 统计学处理
应用SPSS.21统计软件进行Spearman等级相关分析。r>0表示变量之间呈正相关,r<0表示呈负相关。|r|为0.0~0.2,极弱相关或无相关;|r|为0.2~0.4,弱相关;|r|为0.4~0.6,中等程度相关;|r|为0.6~0.8,强相关;|r|为0.8~1.0,极强相关。P<0.05表示在α=0.05的检验水准下相关系数r具有统计学意义。
2 结 果
2.1 宫颈癌3D细胞化疗药物敏感性检测结果
宫颈癌细胞培养3~6d,取孔内容物于生物倒置显微镜下观察,可见多个3D多细胞肿瘤球。图1为22号患者体外培养的宫颈癌3D细胞形态。
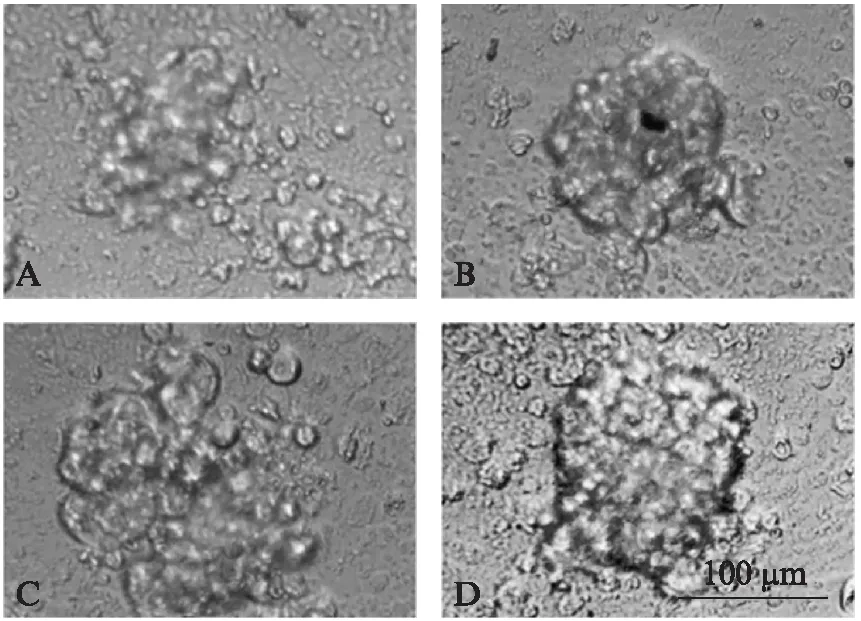
图1 22号患者体外培养的宫颈癌3D细胞形态(×100)Fig.1 Morphology of cervical cancer 3D cell cultured in vitro from patient 22(×100)培养第3d;A:100%标准浓度紫杉醇+顺铂处理;B:100%标准浓度紫杉醇+卡铂处理;C:100%标准浓度吉西他滨处理;D:100%标准浓度MDSO对照组
各种化疗药物对宫颈癌3D细胞的抑制曲线基本符合药物作用规律,当药物浓度增加时,抑制率以剂量依赖性方式增加。部分患者的宫颈癌3D细胞抑制曲线见图2。
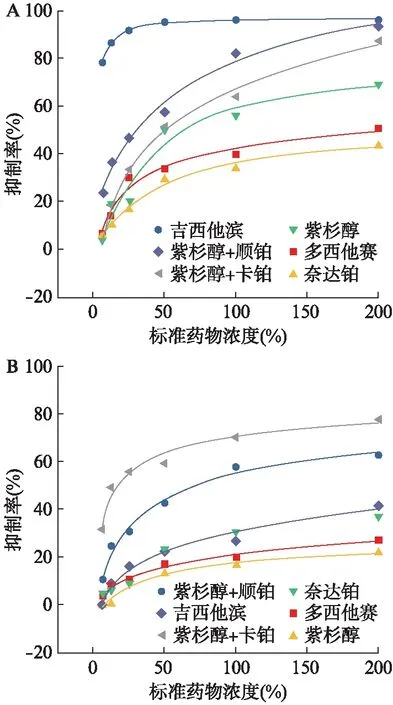
图2 化疗药物对宫颈癌患者3D细胞的抑制曲线Fig.2 Inhibition curves of chemotherapy drugs on 3D cells of cervical cancer patientsA:16号患者;B:24号患者
宫颈癌3D细胞对化疗药物的敏感性程度。药物敏感性结果见表1。
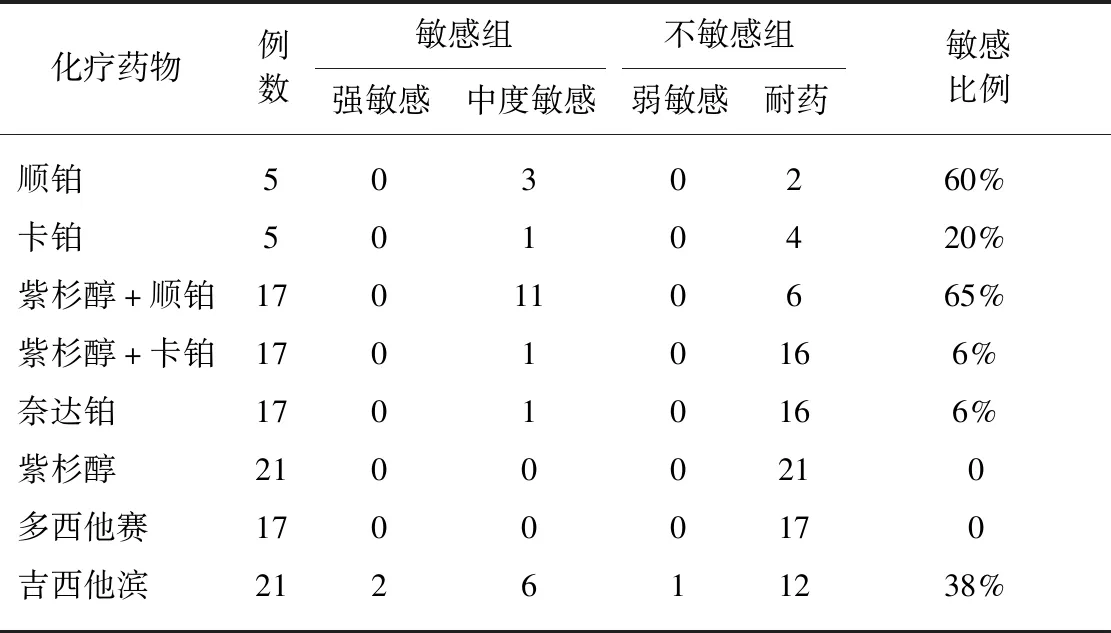
表1 宫颈癌3D细胞对化疗药物的敏感性Tab.1 Sensitivity of cervical cancer 3D cells to chemotherapy drugs
2.2 免疫组化结果
宫颈癌病理标本免疫组化指标CEA、CK5/6、CK7、Ki-67、p16、p53、p63表达见表2。Ki-67、p63、CEA高表达和低表达宫颈癌标本染色照片见图3。
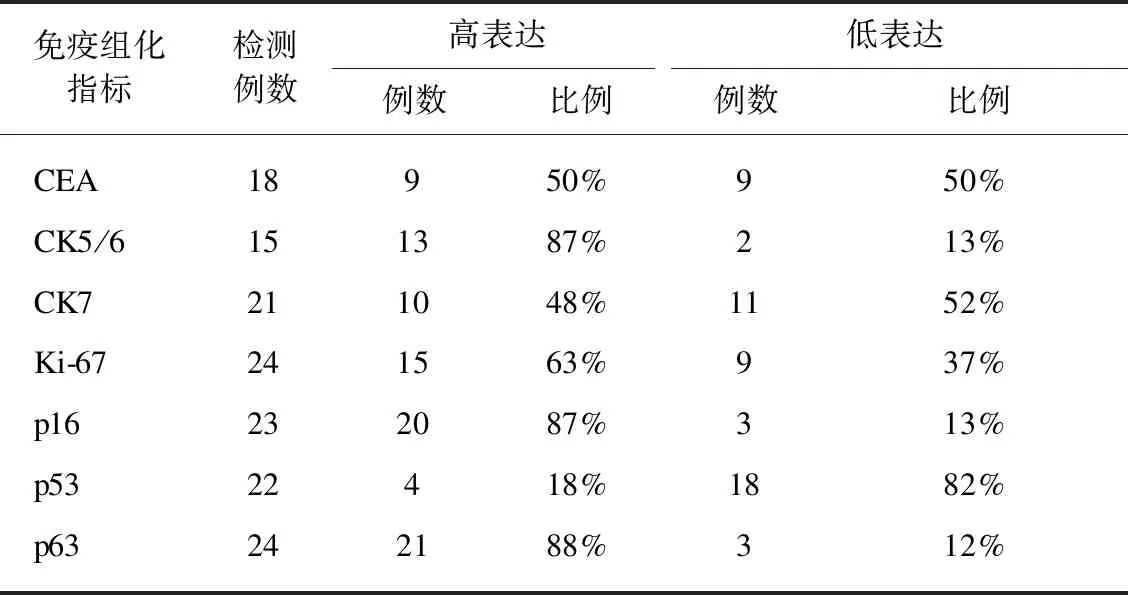
表2 宫颈癌标本免疫组化指标的表达Tab.2 Expression of immunohistochemical indices in cervical cancer specimens
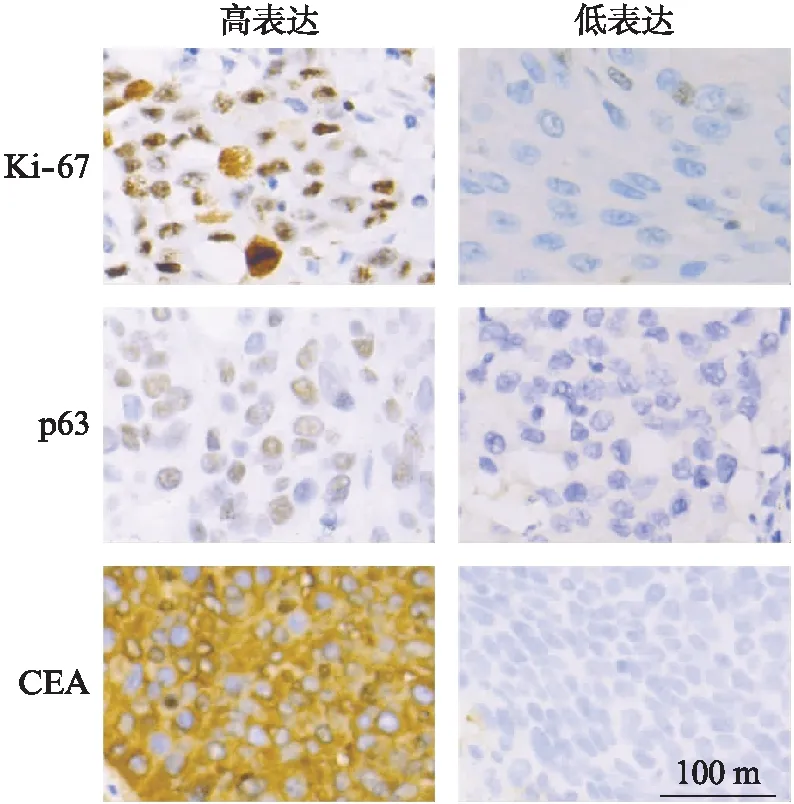
图3 Ki-67、p63、CEA高表达和低表达宫颈癌标本的免疫组化染色照片(×100)Fig.3 Stained photographs of cervical cancer specimens with high and low expression of Ki-67,p63,CEA(×100)
2.3 免疫组化指标与化疗药物敏感性的相关性分析
将宫颈癌病理标本的免疫组化指标CEA、CK5/6、CK7、Ki-67、p16、p53、p63表达水平,与宫颈癌3D细胞对化疗药物的敏感性程度分别进行双向Spearman等级相关分析,结果见表3。Ki-67表达水平与宫颈癌3D细胞对紫杉醇+顺铂的敏感性呈正相关(r=0.485,P<0.05),相关程度中等。p63表达水平与宫颈癌3D细胞对紫杉醇+卡铂的敏感性呈负相关(r=-0.540,P<0.05),相关程度中等。CEA表达水平与宫颈癌3D细胞对吉西他滨的敏感性呈负相关(r=-0.541,P<0.05),相关程度中等。Ki-67、p63表达与顺铂或卡铂单药的敏感性未得到相关性结果,可能的原因是样本数量过小(5例)。本研究中,CK5/6、CK7、p16、p53的表达与宫颈癌3D细胞对紫杉醇+顺铂、紫杉醇+卡铂、奈达铂、吉西他滨的敏感性均无相关性。
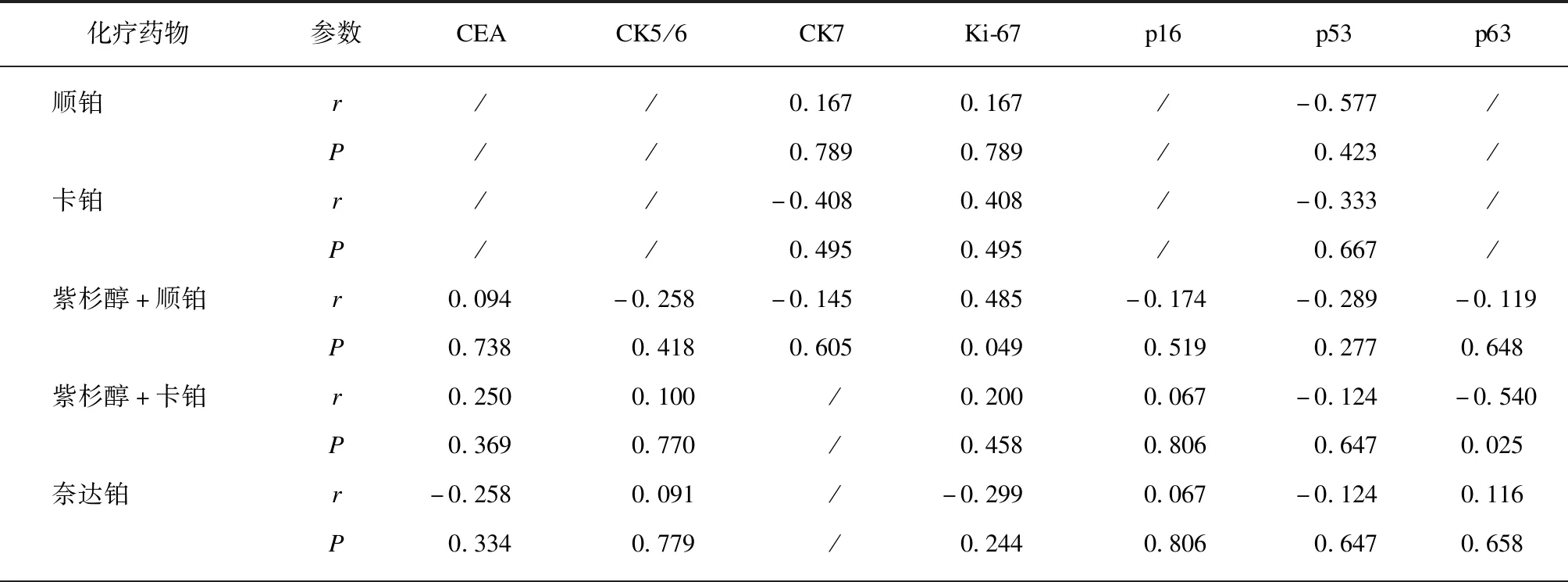
表3 宫颈癌免疫组化指标与化疗药物敏感性的相关性分析结果Tab.3 Correlation analysis between immunohistochemistry indices and chemosensitivity of cervical cancer
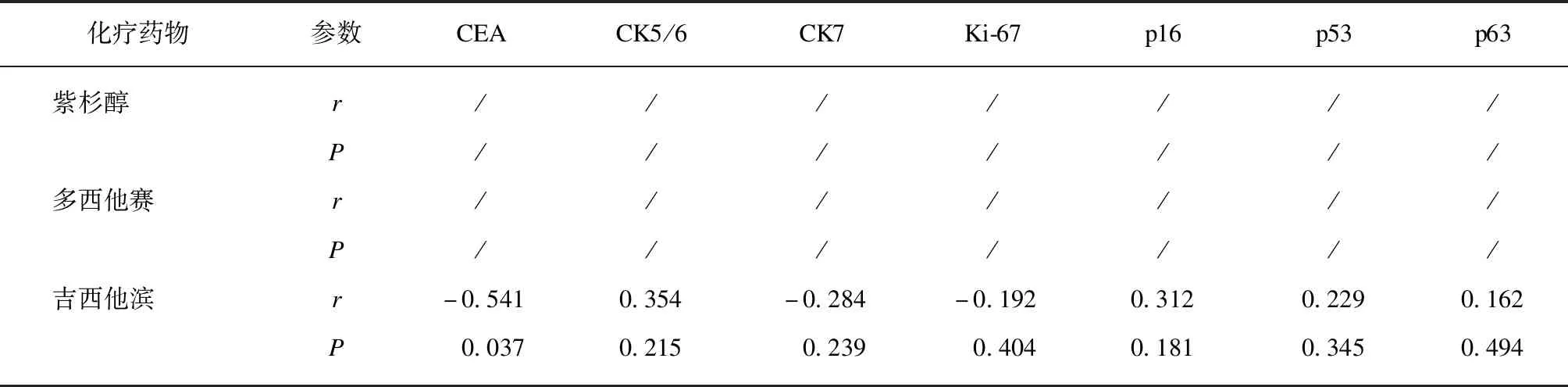
续表
3 讨 论
研究发现,采用ATP-TCA对多种肿瘤进行体外化疗药物敏感性检测,其结果与临床疗效具有良好的相关性[13-15]。采用类器官模型可进一步提高检测结果的预测度。3D多细胞肿瘤球是一种简单的类器官,其核心因缺氧而坏死、外围层较高的增殖率、内部细胞外基质的沉积、基因表达和表型,都与体内肿瘤中观察的现象非常相似[16]。本试验运用液体覆盖技术培养3D多细胞肿瘤球,联合ATP-TCA,药物敏感性结果接近于宫颈癌患者体内肿瘤对化疗药物的反应。
本试验中,宫颈癌3D细胞对化疗药物表现为强敏感比例极少,中度敏感比例不高,不敏感比例较大,可推测宫颈癌3D细胞具有抵抗药物毒性的机制。试验检测宫颈癌3D细胞对紫杉醇+顺铂的敏感率为65%,与Lorusso等[17]荟萃分析结果相符(基于顺铂的方案对晚期和复发性宫颈癌的缓解率为29.1%~67%)。试验检测宫颈癌3D细胞对吉西他滨的敏感率为38%,高于对紫杉醇+卡铂的敏感率(6%),显示出吉西他滨对铂类耐药宫颈癌的治疗潜力。有待更大规模试验对以上结果进行验证。
临床上很多宫颈癌患者未进行肿瘤药物敏感性检测,本研究旨在探索免疫组化指标能否预测宫颈癌对铂类化疗药物的敏感性。Ki-67是一种反映细胞增殖的核DNA结合蛋白,研究发现Ki-67高表达的晚期宫颈癌患者对顺铂化疗反应更好、生存率更高[18]。p63是p53抑癌基因家族成员,Zhou等[9]发现p63的表达产物可提高宫颈鳞癌细胞对顺铂化疗的敏感性。癌胚抗原CEA是一种广谱肿瘤标志物,Abbas等[3]发现高水平CEA与胃癌患者对顺铂联合抗血管生成化疗效果欠佳相关。
相关性分析显示,基于3D细胞类器官模型,免疫组化指标Ki-67表达水平与宫颈癌对紫杉醇+顺铂的敏感性呈正相关,p63表达水平与宫颈癌对紫杉醇+卡铂的敏感性呈负相关,CEA表达水平与宫颈癌对吉西他滨的敏感性呈负相关。因此,可通过Ki-67、p63、CEA表达水平初步预测宫颈癌患者对紫杉醇+顺铂、紫杉醇+卡铂和吉西他滨化疗的敏感性。Ki-67高表达(≥60%)预测宫颈癌患者可能对紫杉醇+顺铂化疗敏感性高,Ki-67低表达(<60%)预测患者可能对紫杉醇+顺铂化疗敏感性低。p63高表达(阳性或强阳性)预测宫颈癌患者可能对紫杉醇+卡铂化疗敏感性低,而p63低表达(阴性或少量表达)预测患者可能对紫杉醇+卡铂化疗敏感性高。CEA高表达预测宫颈癌患者对吉西他滨化疗敏感。当然,还需要扩大样本例数并进行临床前瞻性研究,以评估这种预测方法的准确性。
此外,本研究结果为宫颈癌化疗药物机制的研究提供了一些证据和线索。Ki-67高表达宫颈癌对紫杉醇+顺铂的敏感性较高,反映Ki-67可能参与紫杉醇+顺铂对宫颈癌细胞的抗癌机制。p63高表达宫颈癌对紫杉醇+卡铂的敏感性较低,反映p63或相关分子可能诱导宫颈癌细胞对紫杉醇+卡铂耐药。CEA可能通过某种途径调节吉西他滨对宫颈癌的药理作用。Ki-67、p63和CEA等肿瘤相关蛋白涉及复杂的调控途径,受到微小核糖核酸(microribonucleic acid,miRNA)等非编码RNA调节[19],在宫颈癌化疗中参与的信号通路有待进一步试验探索。
