氨基酸转运蛋白SLC6A14在大肠癌中的表达特征及其促癌功能研究
2021-03-08罗轶玮符雪莲王恺京李芳漪
罗轶玮,符雪莲,马 钻,王恺京,李芳漪,陆 英
(1.同济大学附属东方医院全科教研室,上海 200120;2.同济大学附属东方医院转化医学研究中心,上海 200120)
大肠癌(colorectal cancer,CRC)是世界排名第4位致死性癌症,近年来发病率和死亡率都在逐渐上升[1]。在我国,大肠癌患者的中位发病年龄比欧美发达国家提前约10年,且死亡率也高于世界平均水平。大肠癌的治疗仍是以早期发现并手术切除为主,而大肠癌术后复发转移后的治疗手段仍有限,目前的靶向治疗药物仅对不到20%的转移性大肠癌有作用[2-3]。可见,发现大肠癌靶向治疗的新靶点将具有非常重要的意义。基因芯片、蛋白芯片和近年来对肿瘤代谢组学的研究均是找寻肿瘤标志物和新的靶向治疗的重要手段[4-5]。
肿瘤细胞的快速增殖需要大量的营养物质,其中氨基酸是蛋白质和核酸合成的必需物质。但是氨基酸不能直接穿过细胞膜进入胞内,需要通过胞膜上特异的氨基酸转运蛋白摄取后才能进入细胞内被生物利用,因此不同细胞根据对不同氨基酸的需求,细胞表面表达的氨基酸转运蛋白的水平也不同[6]。最近的研究已发现多个氨基酸转运蛋白在不同肿瘤细胞中表达异常。其中氨基酸转运蛋白SLC6A14可以转运18种氨基酸,在健康成人组织中几乎检测不到,但在部分实体肿瘤中表达明显增加,如胰腺癌、三阴性乳腺癌等[7-8]。虽然,Gupta等[9]的研究发现SLC6A14在大肠癌中表达升高,但是对于SLC6A14在大肠癌中的生物学功能及临床意义未知。因此本研究中通过检测SLC6A14在CRC组织样本中的表达水平并分析其与临床病理特征的关系,以及阻断SLC6A14对CRC细胞生长的影响,旨在进一步明确SLC6A14作为CRC治疗靶点的临床应用价值。
1 资料与方法
1.1 一般资料
选取2017年11月—2019年5月于同济大学附属东方医院行手术治疗的大肠癌患者为研究对象纳入标准:经病理学诊断确诊为大肠癌;术前未接受过任何放疗、化疗;临床资料完整;按伦理要求患者签署知情同意书。本项目经同济大学附属东方医院伦理委员会批准(DF2016-003)。共收集108例大肠癌癌组织。患者资料为:男性60例,女性48例;年龄35~77岁,中位年龄为54岁;临床分期Ⅰ期16例,Ⅱ期36例,Ⅲ期51例,Ⅳ期5例。
1.2 细胞培养及主要试剂
人大肠癌细胞株HT-29和SW620购自中科院上海细胞库;胎牛血清(FBS)、L-15培养基、0.25%胰蛋白酶购自美国Gibco公司,McCOY’s 5A培养基、SLC6A14抑制剂α-甲基色氨酸(α-methyltryptophan,α-MT)购自美国Sigma公司。HT-29大肠癌细胞接种于含10%FBS、青霉素100IU/mL、链霉素100μg/mL的McCOY’s 5A培养基中,SW620大肠癌细胞接种于含10%FBS、青霉素100IU/mL、链霉素100μg/mL的L-15培养基,置于37℃、5%CO2细胞培养箱中培养。根据细胞生长情况,每2~3d更换培养基。
1.3 总RNA提取和实时定量荧光PCR
手术切除的新鲜大肠癌组织及癌旁组织置于RNAlater®Solution(美国Ambion公司)溶液中保存。组织块加入TRIzol(美国Invitrogen公司)裂解后提取总RNA。采用日本TaKaRa反转录试剂盒,总RNA 0.5μg,总体积为10uL。反转录反应,37℃,15min。反转录酶失活反应,85℃,5s。将得到的RT反应液加入到下一步的实时定量荧光PCR反应体系中。采用TaKaRa Real Time PCR试剂盒,ABI 7500 Real Time PCR仪,根据说明书推荐的反应条件进行扩增。引物序列如下。以GAPDH为内参,正向引物为5′-GAGTCAACGGATTTGGTCGTATTG-3′,反向引物为5′-CTCCTGGAAGATGGTGATGGGAT-3′。SL-C6A14正向引物:5′-TGGATTTATGGAGGG-AA-CAGATT-3′;反向引物:5′-ATCATACACCAGC-CTAAAGCAAC-3′。采用相对定量法(ΔΔCt法)分析mRNA在大肠癌癌组织和癌旁组织中的表达差异:ΔCt=Ct(SLC6A14)-Ct(GAPDH),ΔΔCt=ΔCt癌组织-ΔCt癌旁组织组,以N=2-ΔΔCt表示癌组织中SLC6A14的mRNA表达水平相对于癌旁组织的改变倍数。大于1.5倍认为表达增高,低于2/3倍认为表达降低。
1.4 免疫组织化学染色及H值计算标准
手术切除的新鲜癌组织样本置于10%的中性甲醛溶液中,4℃保存,制成蜡块,切片后用于免疫组化染色。组织切片脱蜡后,在修复溶液(丹麦Dako公司)中95℃加热20min完成抗原修复。经3% H2O2封闭,加入SLC6A14抗体(1∶200,美国Abcam公司,兔抗人)4℃孵育过夜。PBS洗涤3次,每次15min,然后用辣根过氧化物酶(horseradish peroxidase,HRP)连接的鼠抗兔IgG二抗(美国Santa Cruz公司)室温孵育30min。最后,使用二氨基联苯胺(diaminobenzidine,DAB)底物试剂盒进行显色。结果用Quant Center软件在Pannoraminc查看器(3D HISTECH,Pannoramic MIDI)上扫描。组织化学评分(H评分)按下式计算[10]:H评分=(弱染色细胞百分比×1)+(中等强度染色细胞百分比×2)+(强染色强度细胞百分比×3)。
1.5 Western印迹法
HT-29、SW620和Huh7细胞裂解在RIPA缓冲液中,蛋白浓度通过BCA分析测定(上海碧云天生物技术有限公司)。取30μg总蛋白经10% SDS-PAGE凝胶电泳分离后,转移到PVDF膜上。室温下经5%牛奶(g/mL)封闭1h,加入抗SLC6A14抗体(1∶1000,英国Abcam公司,兔抗人),4℃孵育过夜。β-actin(1∶1000,美国Santa-Cruz公司,鼠抗人)作为内参。PBST缓冲液洗涤3次,每次15min。用HRP标记二抗(1∶2000,美国Santa-Cruz公司,鼠抗兔IgG和山羊抗鼠IgG)室温下孵育1h。使用Odyssey成像系统(美国LiCOR公司)检测,ImageJ软件分析蛋白灰度。
1.6 RNAi
使用RNA干扰技术下调HT-29和SW620细胞中SLC6A14的表达,将细胞接种于六孔板,每孔接种25×104个细胞。置于37℃、5%CO2培养箱过夜;使用Lipofectamine-2000 (购自美国Invitrogen公司)转染试剂,按照说明书进行转染。转染前1h将培养基更换为Opti-MEM无血清培养基,转染后培养6h后,更换新鲜培养基继续培养24h。
1.7 MTT检测细胞增殖实验
将siRNA转染后的HT-29和SW620细胞,用0.25%胰酶消化,离心吹打成单细胞悬液,用红细胞计数板计数,取平均值。在96孔板中接种细胞悬液(100μL/孔,约1000个细胞)。未转染的对照组细胞分别加入不同浓度的SLC6A14抑制剂α-MT(分别为0.62、1.25、2.5mmol/L)。在加药后0、24、48、72h,更换为无血清培养基200μL,向每孔加入10μL MTT试剂(美国Sigma公司),将培养板放回培养箱中继续培养2~4h,观察颜色变化情况,使用酶标仪测定570nm处的吸光度(A570)。
1.8 流式细胞术检测细胞凋亡
将HT-29和SW620细胞接种于六孔板,每孔接种25×104个细胞,体积为1.5mL,分别加入终浓度为0.62、1.25、2.5mmol/L的α-MT。将培养板置于37℃、5%CO2培养箱中培养。24h后收集细胞,使用Annexin-Ⅴ/PI凋亡试剂盒(美国BD公司):每管加400μL Binding Buffer,5μL Annexin-Ⅴ-FITC和5μL PI。混匀,避光孵育15min,上流式细胞仪检测凋亡情况。流式细胞仪激发光波长用 488nm,用一波长为515nm的通道检测FITC荧光,另一波长大于560nm的滤器检测PI,数据分析使用Diva软件。
1.9 统计学处理
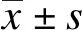
2 结 果
2.1 SLC6A14 mRNA在大肠癌组织中高表达
通过实时定量荧光PCR方法检测35对大肠癌及配对癌旁组织中SLC6A14 mRNA的表达,结果显示SLC6A14在癌组织中表达是癌旁组织的(3.98±1.1)倍,差异具有统计学意义(P<0.05);SLC6A14在68.57%(24/35)的大肠癌组织中mRNA表达水平高于癌旁组织1.5倍以上,见图1。
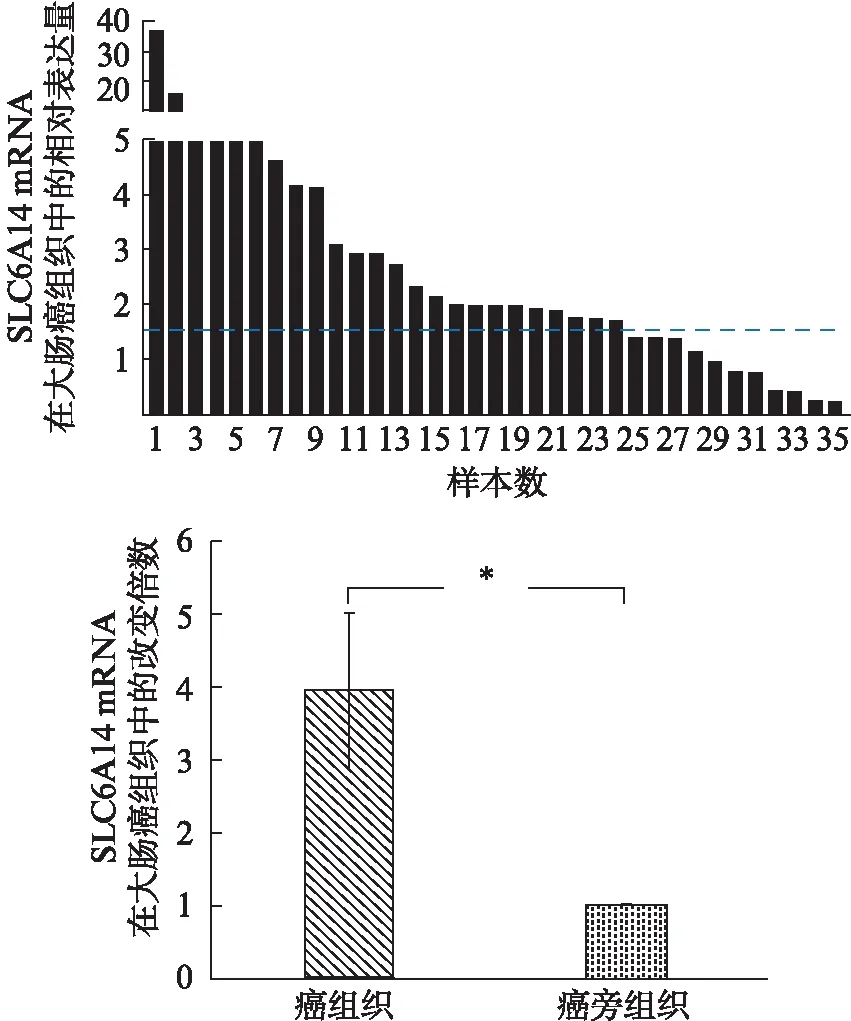
图1 SLC6A14 mRNA在大肠癌组织中的表达特征Fig.1 Expression of SLC6A14 mRNA in colorectal cancer*P<0.05
2.2 SLC6A14在大肠癌细胞株中蛋白表达增高
通过Western印迹法,检测SLC6A14在大肠癌细胞株HT-29、SW620和肝癌细胞株Huh7中的蛋白表达情况,结果显示SLC6A14在HT-29和SW620中的表达明显高于Huh7。通过灰度计算,SLC6A14在HT-29和SW620中的蛋白表达强度分别是Huh7的(4.31±1.46)倍和(3.14±0.93)倍,差异具有统计学意义(P<0.05),见图2。

图2 SLC6A14在大肠癌细胞株中的蛋白表达特征Fig.2 Expression ofSLC6A14 protein in colorectal cancer cell lines*P<0.05
2.3 SLC6A14蛋白表达强度与大肠癌临床病理特征的关系
通过免疫组化染色,检测SLC6A14在大肠癌组织中的表达强度,经H值积分半定量分析,结果显示SLC6A14表达强度与临床分期密切相关,分期越往后,SLC6A14表达越强(P<0.05),见表1和图3。而SLC6A14表达强度与年龄、性别、肿瘤大小之间的关系差异无统计学意义。

表1 SLC6A14在大肠癌组织中的表达强度与患者临床病理特征的关系Tab.1 Relationship between clinicopathological characte-ristics and SLC6A14 expression in patients with CRC
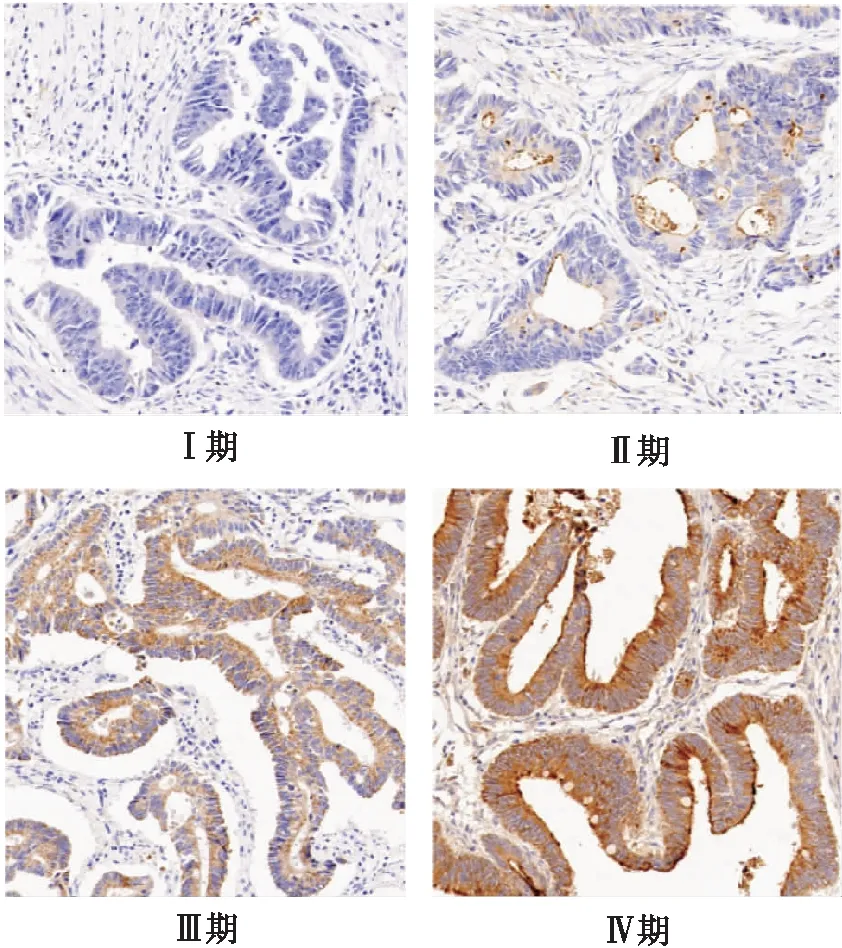
图3 SLC6A14在不同分期CRC患者癌组织中的表达Fig.3 The expression of SLC6A14 at the protein level in CRC cancer tissues with different clinical stages
2.4 SLC6A14对大肠癌细胞增殖能力的影响
为了研究SLC6A14对大肠癌细胞增殖能力的影响,本研究使用siRNA下调HT-29和SW620细胞中SLC6A14的表达,或使用特异性抑制剂α-MT(0.62、1.25和2.5mmol/L 3个浓度)抑制SLC6A14的功能,通过MTT法检测下调或抑制SLC6A14的表达或功能对大肠癌细胞增殖的影响。结果显示,下调或抑制SLC6A14能明显抑制HT-29、SW620的增殖能力(P<0.05),并且随着α-MT浓度的增加,抑制效果也增加,见图4。

图4 下调SLC6A14的表达或抑制SLC6A14功能对大肠癌细胞增殖的影响Fig.4 The role of SLC6A14 in the proliferation of CRC cancer cell lines
2.5 SLC6A14对大肠癌细胞凋亡的影响
进一步研究SLC6A14对大肠癌细胞凋亡的影响,通过使用不同浓度SLC6A14抑制剂α-MT(0.62、1.25、2.5mmol/L)给药24h后,使用AnnexinV-FITC/PI凋亡检测试剂,通过流式细胞仪检测细胞的凋亡情况。结果显示,抑制HT-29、SW620中SLC6A14后,细胞凋亡(Annexin-Ⅴ+/PI-)增加,存活细胞(Annexin-Ⅴ-/PI-)明显减少,P<0.05,见图5;并且随着α-MT浓度的增加,凋亡细胞明显增加(P<0.05)。
图5 SLC6A14抑制剂对大肠癌细胞凋亡的影响Fig.5 The role of SLC6A14 in the apoptosis of CRC cancer cell lines*P<0.05
3 讨 论
由于快速增殖的癌细胞需要吸收大量的营养物质来支持其明显增加的生物合成需求,从而在其细胞表面表达大量的营养物质转运蛋白,因此代谢重编程现在被认为是癌细胞的一个重要标志[11-13]。选择在恶性肿瘤中高表达而在正常组织中低表达甚至不表达的转运蛋白是抗癌治疗的理想靶点[14]。氨基酸转运蛋白SLC6A14,又名ATB0,+,具有最广泛的转运氨基酸的能力:转运20种基本氨基酸中的18种,包括所有中性氨基酸和两种阳离子氨基酸,覆盖所有必需氨基酸。SLC6A14是Na+/Cl-偶联氨基酸转运体,有3种不同的驱动力参与该转运蛋白的转运过程:Na+梯度、Cl-梯度和膜电位。由于其转运功能与Na+和Cl-紧密偶合,Na+∶Cl-∶氨基酸的化学转运比为2∶1∶1,因此SLC6A14介导的转运几乎是单向的。从理论上讲,3种不同的驱动力参与SLC6A14的转运功能,能使其将细胞内的氨基酸浓缩到约1/1000。已有研究证实在胰腺癌、大肠癌和雌激素受体阳性(ER+)乳腺癌中表达明显增加,但在健康成人组织中表达很低甚至检测不到,因此SLC6A14有可能是一种癌症特异性氨基酸转运蛋白[8,15]。α-MT是一种靶向SLC6A14的竞争性小分子阻断剂,研究表明α-MT是SLC6A14的转运底物,转运过程也依赖于Na+/Cl-,Na+/Cl-/α-MT化学转运比亦为2∶1∶1。在乳腺癌异种动物移植模型中,已证实能明显抑制SLC6A14的转运功能,并且经α-MT处理后能明显抑制SLC6A14阳性乳腺癌细胞株的体外和小鼠体内异种移植瘤的增殖,但是对SLC6A14阴性乳腺癌细胞株的增殖没有影响[16]。因此这些结果都提示SLC6A14能否成为潜在的肿瘤靶点取决于其在肿瘤中的表达情况。
本研究表明,在大肠癌组织中,SLC6A14的mRNA和蛋白水平明显升高,SLC6A14的表达水平与大肠癌的临床分期密切相关,肿瘤患者分期越往后,SLC6A14的表达水平越高。在人大肠癌细胞株中亦证实SLC6A14在大肠癌细胞株中的表达明显高于肝癌细胞株,但是SLC6A14在两种大肠癌细胞株HT29和SW620中的表达差异无统计学意义。随后,通过siRNA和α-MT下调及抑制SLC6A14后,发现大肠癌细胞的增殖能力明显受到抑制,凋亡细胞明显增多,并且这种变化与α-MT呈浓度依赖性,但α-MT的抑制能力与SLC6A14的表达程度之间未显示有明显相关性。综合上述结果,本研究认为SLC6A14可能是治疗大肠癌的有效分子靶点。
阻断营养物质转运蛋白是治疗癌症的一种新的方法——“饿死肿瘤细胞”[17],因此引领人们去寻找靶向SLC6A14,但是毒性要较小的小分子抑制剂。α-MT已成功应用于SLC6A14阳性乳腺癌异种移植动物模型,并能明显抑制肿瘤生长。本结果显示α-MT抑制了大肠癌细胞系(HT-29 和SW620)的增殖,促进了细胞凋亡,并且这种抑制增殖的能力与α-MT的浓度成正相关。然而,α-MT是否可以作为大肠癌治疗的新方法,还需要进一步研究SLC6A14在多种癌症中的作用。另外,虽然单一使用α-MT取得了良好的效果,但联合用药是否会获得更大的抑制效果以及如何防止抑制剂耐药性的产生还需要更多的实验研究和临床试验加以论证。
综上所述,本研究表明,SLC6A14在大肠癌组织及细胞株中表达增加,通过siRNA或抑制剂α-MT 阻断SLC6A14可降低大肠癌细胞的生长能力。因此,SLC6A14可能成为大肠癌的新治疗靶点,同时为大肠癌的防治提供新的思路。
