缺氧诱导因子 1调控卵泡发育的研究进展
2021-03-08傅夏燕陈其臻王炎秋
傅夏燕,陈其臻,尹 喆,王炎秋
(1.同济大学附属同济医院生殖医学中心,上海 200065;2.同济大学医学院,上海 200092)
人卵母细胞生长在被基底膜包围的卵泡液中,基底膜和卵泡液中缺乏血管系统[1]。卵泡发育过程中,卵泡发育前的窦状卵泡期氧浓度处于正常水平。伴随着卵泡由无腔卵泡发育为有腔卵泡,被卵泡液包裹的卵丘颗粒细胞和卵母细胞周围的血管系统分布迅速减少,导致卵母细胞供血迅速下降,形成低氧环境;排卵过程中脉管系统的脱落以及重塑均会降低局部氧浓度。因此卵泡的发育、成熟、排卵以及随后的黄体早期均处于局部低氧或缺氧的环境中[2],这一过程主要通过缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)实现对氧应激的平衡。本文就HIF-1在卵泡发育、排卵过程中的表达、作用机制以及意义等方面进行综述。
1 HIF-1的结构及活性调节
HIF-1是由α亚基和β亚基组成的异二聚体(图1),编码HIF-1α和HIF-1β的基因分别位于人类第14号染色体21~24区和第1号染色体的q2l区。其中HIF-1α(相对分子质量120000)作为调节亚基,决定了HIF-1的功能,主要表达于细胞核中,含量受外界氧浓度的影响;HIF-1β(相对分子质量91000~94000)则稳定的表达于细胞核和细胞质中,不受外界环境的影响,主要与稳定HIF-1及其二聚化有关。HIF-1α和HIF-lβ均为基本螺旋-环-螺旋(basic helix-loop-helix,bHLH)转录因子家族成员,并具有Per-ARNT-Sim(PAS)结构域。而HIF-1α除了以上2个结构域之外,还具有氧依赖降解结构域(oxygen dependent degradation domain,ODDD)以及2个转录活化所需的反式激活结构域(N-TAD,C-TAD)。
HIF-1的稳定性受脯氨酰羟化酶结构域(prolyl hydroylase domain,PHD)蛋白的调节[3],见图1。HIF-1表达与氧分压密切相关。在正常氧浓度下,HIF-1α很不稳定,通常其半衰期<5min,容易被降解,因此,常氧条件下,HIF-1通常不起转录调节作用。在这个过程中,PHD对HIF-1α中的脯氨酸残基402和564进行氧依赖的羟基化,致使其与肿瘤抑制蛋白VHL结合,进而通过氧依赖降解结构域介导的泛素蛋白酶体被降解,ARD1乙酰基转移酶对赖氨酸残基532的乙酰化也可促进HIF-1α与VHL的结合。
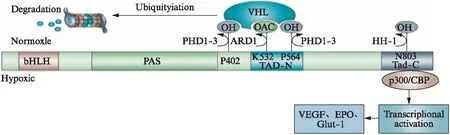
图1 HIF-1结构及调节过程[4]Fig.1 HIF-1 structure and regulation process[4]
而在相对缺氧条件下,PHD活化受抑制,组蛋白乙酰转移酶p300与CREB结合蛋白(CREB binding protein,CBP)与未经羟基化的HIF-1α结合,致HIF-1α不能被降解,从而在细胞核内大量积聚,与HIF-lβ结合形成HIF-l,与低氧反应元件(hypoxic response element,HRE)结合后启动相关低氧基因的表达。HIF-1的常见靶基因有血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、促红细胞生成素(erythropoietin,EPO)、葡萄糖转运蛋白和糖酵解酶等[5]。在HeLa细胞中,缺氧4h后,HIF-1α的表达在氧浓度为0.5%时达到最大,在1.5%~2%时达到最大值的一半[6]。HIF-1的DNA结合活性随氧浓度的降低而呈指数增加,决定了HIF-1的DNA结合活性水平[7]。
2 HIF-1与卵泡结构的关系
2.1 HIF-1与各级卵泡发育
卵泡的发育始于胎儿(人类)或新生儿(啮齿类动物),此时原始卵泡形成[8]。一旦卵泡启动生长,激活的原始卵泡,包括卵母细胞及其周围的一层扁平的颗粒细胞,发育成初级、次级并最终发育成有腔卵泡。卵泡发育和排卵与卵泡分泌功能、完善的血管网络发育密切相关。在这个过程中,腔前卵泡的发育依赖于细胞因子及颗粒细胞。当发育为有腔卵泡时,颗粒细胞及血管系统进一步发育,卵泡腔形成并扩大。
Boonyaprakob等[9]发现,HIF-1在优势卵泡中的表达水平高于闭锁前卵泡,且在闭锁卵泡中几乎没有HIF-1 mRNA的表达,提示HIF在卵泡发育中可能起着重要作用。杜学海等[10]发现,HIF-1α在初级卵泡和次级卵泡内表达不显著,只有当卵泡发育至有腔卵泡时,HIF-1α才开始呈显著表达,且随着卵泡腔增大,其表达量呈增加趋势,推测为卵泡腔增大后卵母细胞血供减少,缺氧的环境诱导HIF-1表达的增加。Kim等[11]发现,对超促排卵小鼠使用HIF抑制剂棘霉素,在注射HCG 10h后HIF-1α表达明显降低,11h 后即卵泡即将破裂时几乎检测不到,注射HCG 20h后仍有大量成熟卵泡未破裂。以上研究均提示,HIF-1α为调节排卵的关键因子。
2.2 HIF-1与颗粒细胞分化及卵丘发育
人卵泡液的氧浓度为1.3%~5.5%[12]。颗粒细胞是卵泡内的主要细胞类型,具有改变其形态和功能以适应和支持发育中的卵母细胞的作用。在卵泡发育过程中,颗粒细胞逐渐分化为围绕卵泡壁的壁颗粒细胞以及围绕卵母细胞的卵丘细胞。由于卵母细胞表面缺乏促性腺激素受体,因此卵母细胞生发泡的破裂依赖于FSH与卵丘颗粒细胞的结合。氧气是卵丘-卵母细胞复合体环境中的重要组成部分,当卵丘细胞的发育环境受到干扰时,卵丘细胞的功能和基因表达均会发生改变。
HIF-1表达于不同发育及分化阶段的颗粒细胞及卵泡中,通过与颗粒细胞表面FSH受体调控颗粒细胞分泌E2等复杂相互调节作用,而促进不同阶段卵泡的发育。动物实验表明,伴随卵泡发育,颗粒细胞与卵母细胞相辅相成,呈共生关系[10]。在颗粒细胞的分化过程中,HIF-1表达逐渐增强,与卵母细胞中HIF-1表达一致,具有时间限制性。Kind等[13]的Western印迹法结果表明,HIF-1α蛋白在低氧暴露的卵丘细胞中稳定表达。Tsafriri等[14]将未成熟卵母细胞与卵丘-颗粒细胞分别培养后,发现二者均未生长,而将二者混合培养时,则会与卵泡中的空间结构相似,主动形成缝隙连接,这显著提高了卵母细胞的成熟率。Shiratsuki等[15]在对牛的颗粒细胞进行体外培养时,分别将其分为低氧组(5%)和高氧组(21%),在培养24h后,低氧组颗粒细胞HIF-1基因和蛋白表达均高于高氧组。此外,Shiratsuki等[15]还检测了HIF-1α相关基因的表达。在低氧条件下培养的GCs中,140个HIF-1调控基因中有39.23%的表达显著增加,而7.25%的基因表达降低。Zhang等[16]的免疫组织化学和Western印迹法分析结果显示,HIF-1α在颗粒细胞中有特异性表达,其可能是通过调节增殖细胞核抗原的表达来促进卵泡发育。以上研究结果均表明,HIF-1α可能通过调节卵巢颗粒细胞增殖与分化来参与卵泡发育。
3 HIF-1诱导卵泡发育的作用机制
3.1 PI3K/AKT-mTOR通路
在细胞增殖过程中,蛋白激酶B(protein kinase,AKT)和哺乳动物雷帕霉素靶点(manmanlian target of rapamycin,mTOR)信号级联是有力的调节因子[17]。AKT通过结节性硬化症复合物2(turberous sclerosis complex,TSC2)的磷酸化上调mTOR复合物1(mTORC1)的活性[18]。mTORC1激酶活性通过磷酸化靶蛋白如p70S6激酶(P70S6K)和真核细胞翻译起始因子4E结合蛋白1(4E-BP1)来刺激蛋白质合成和细胞生长。AKT还强烈诱导细胞中的糖酵解酶活性[19],提示AKT-mTOR和糖酵解活性增高可能有助于GCs在低氧条件下的细胞增殖。Zhang等[20]的研究表明,PI3K/mTOR通路的激活增加了牛黄体细胞中HIF-1α的稳定性和VEGF的表达。Shiratsuki等[15]认为缺氧诱导的HIF-1激活通过VEGF增强AKT-mTOR信号,从而激活颗粒细胞增殖。也有研究报道,缺氧通过PI3K激活AKT来调节细胞增殖,而PI3K是通过胰岛素样生长因子和促性腺激素刺激牛颗粒细胞激活的[21],具体机制见图2。
3.2 FSH/VEGF对HIF-1的调节
FSH通过G蛋白偶联的FSH受体发挥作用,为卵泡成熟提供主要刺激,使卵泡从腔前状态成熟到排卵前状态[22-24]。FSH与其受体结合导致cAMP水平升高。当cAMP反应元件结合蛋白p300被募集到其C末端时,诱导HIF-1表达。此过程不仅需要PI3K/AKT介导的哺乳动物雷帕霉素靶标的激活[25],同时需要Forkhead转录因子[26]和MDM2的磷酸化。HIF-1与靶基因(如促红细胞生成素、葡萄糖转运蛋白、各种糖酵解酶、VEGF受体flt-1和VEGF)在低氧浓度下与共同的缺氧反应元件(core-ACGTG-)结合,从而激活其活性,而这一过程也可通过激活PD98059敏感的蛋白(激酶)活性直接实现[27],具体机制见图2。
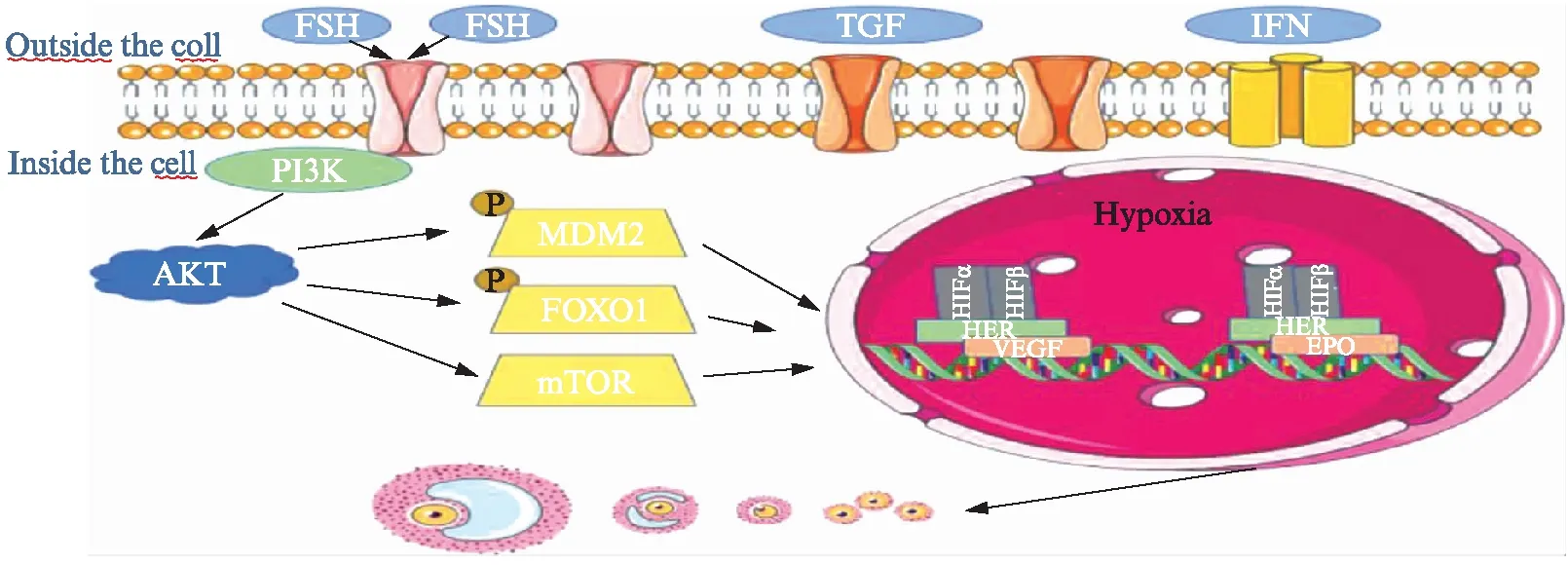
图2 HIF-1参与卵泡发育机制图Fig.2 The mechanism of HIF-1 involvement in follicular development
Zhou等[28]的研究表明,体内、外注射卵泡刺激素均可明显增加HIF-1α的表达。原始卵泡及早期腔前卵泡均无独立的血管系统,而是依赖周围基质中的血管。伴随着卵泡的发育,窦状卵泡逐渐形成个性化的血管供应,而这一过程主要受VEGF调节。Fisher等[29]的研究表明,生长中的卵泡(慢生长组和快生长组)产生大量的VEGF,特别是在卵泡腔形成后,而无生长卵泡则未检测到VEGF。
3.3 其它激素对HIF-1的调节
HIF-1的表达同时受到其他激素的调节[30]。研究表明,hCG为卵巢HIF-1蛋白丰度的重要调节因子[1]。在低氧状态下,用hCG刺激卵泡,结果表明,HIF-1蛋白水平明显增加。当Hep3B细胞在低氧条件下培养时,转化生长因子-1也能刺激HIF-1水平升高,诱导VEGF mRNA丰度增加[31]。虽然缺氧被认为是细胞内HIF-1反应的主要诱因,但其他刺激,如炎症细胞因子、生长因子同样可能诱导常氧细胞中HIF-1及其靶基因的表达[32-35]。
4 HIF-1在临床诊断和治疗中的应用
目前对HIF-1的研究集中在基础研究方面,在临床应用方面,研究主要涉及肿瘤诊治中的应用[36],与卵泡发育障碍的相关性报道较少。
4.1 HIF-1表达与卵巢储备功能
刘春喜等[37]的研究发现,多囊卵巢综合征(polycystic ovary syndrome,PCOS)患者血清中HIF-1α表达上调,卵巢储备功能下降者则呈低表达,故认为,HIF-1α的表达水平可以用于卵巢储备功能的预测,其作用机制尚不清楚,推测其与促性腺激素、雌激素、低氧环境之间的复杂相互调节机制相关[2]。
4.2 HIF-1与卵巢早衰
在小鼠生理性卵巢早衰模型中,随着超促排卵及臭氧吸入,卵巢储备功能下降,窦状卵泡缺氧程度加重,而引起氧化应激及HIF-1α增高。故推测,HIF-1α的表达量可作为预测卵巢早衰的指标之一[38],HIF-1α可能通过调节卵泡中血管发育而参与卵泡发育过程。
4.3 HIF-1与超促排卵
近年来,越来越多的证据表明,缺氧与超促排卵所获卵子的质量关系密切。在动物实验中,HIF-1α表达量与卵子质量呈反比[38]。应用FSH对小鼠进行超促排卵时,由于多个卵泡发育致单个卵泡周围血流量减少,局部氧浓度降低,使HIF-1α大量积聚,影响卵子的减数分裂,从而导致卵母细胞非整倍体发生率升高,降低了卵子质量[39-40]。London等[41]用克罗米芬对小鼠进行促排卵时,也发现了卵母细胞非整倍体概率升高。Gao等[42]对67名IVF助孕患者的研究结果显示,血清及卵泡液中的VEGF水平与卵母细胞质量呈负相关,其原因可能是促排卵过程中卵泡供氧不足,导致HIF-1表达增加,VEGF代偿性升高,使缺氧卵泡对促性腺激素反应性减弱,造成卵母细胞成熟受阻[43]。据上,HIF-1α表达量可作为促排治疗中,卵母细胞质量的评价指标之一。
4.4 HIF-1在卵泡发育障碍治疗中的应用
张鸿升等[44]对脊髓损伤大鼠进行电针干预后发现,HIF-1α及VEGF表达均上调,表明其在神经损伤再生修复中可能起着重要作用。雷公藤多苷致卵泡发育障碍大鼠模型中,促凋亡因子FOXO3a表达升高,而HIF-α、IGF-1R表达则下降,补肾活血中药复方新加归肾丸可能通过上调HIF-1α的表达,下调FOXO3a的表达,从而抑制卵泡过度闭锁,促进卵泡正常生长发育[45]。有望通过检测卵泡发育过程中HIF-1的变化,预测卵巢功能障碍性疾病,从而施行中西药结合的干预治疗。
5 展 望
HIF-1参与各级卵泡的发育及排卵过程,然而卵泡发育的过程为多因素参与的复杂生理过程,卵巢内的激素变化如何调节低氧分子机制以及二者如何发挥相互作用,尤其是临床应用方面仍待进一步研究。解决以上问题,有助于全面理解卵泡发育、排卵过程及相关的病理生理过程,从而为HIF-1的临床应用提供坚实的理论基础。
