尿石素A改善高糖致血管内皮损伤的作用与机制
2021-03-07邓智琴杨永健
邓智琴,杨永健,2
(1.西南交通大学医学院,成都 610000;2.西部战区总医院心血管内科,成都 610083)
糖尿病是一种慢性进展性内分泌疾病,持续高糖及长期代谢紊乱可致血管病变[1],而动脉粥样硬化的加速形成是血管病变的基础,其中血管内皮细胞损伤是动脉粥样硬化发生、发展的关键。研究表明,氧化应激是糖尿病血管并发症发生的重要致病机制[2],高糖可造成活性氧簇的大量积累,超过内源性抗氧化酶的清除能力,形成氧化应激状态并损伤血管内皮细胞。因此,保护内皮细胞免受氧化应激损伤是防治糖尿病血管病变的关键途径[3]。
腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是参与细胞脂蛋白代谢的关键酶,与糖尿病患者的氧化应激、胰岛素抵抗和自噬等密切相关[4-5],其失调在氧化应激诱导的血管内皮功能障碍中起关键作用[6-7]。尿石素A(uro⁃lithin A,UA)是人体摄入主要由富含鞣花单宁的食物(石榴、草莓、核桃等)经体内肠道代谢产生,除了在抗炎、诱导自噬方面发挥积极的生物功效[8-10],其抗氧化作用在急性肾损伤[11]、心肌缺血再灌注损伤[9]、神经退行性疾病[12]等相关研究中也已明确证实,并且可以通过激活AMPK 发挥对阿尔兹海默病神经元的保护作用[13]。但UA 在糖尿病血管病变中的作用,以及其作用是否与AMPK/内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)通路的激活有关暂无报道。为此,本研究通过高糖培养基处理人脐静脉内皮细胞株模拟高糖损伤,以研究UA 对高糖介导的氧化应激水平和血管内皮功能的影响,并初步探讨了其相关的机制,为糖尿病血管病变的防治提供新的理论依据和治疗药物。
1 材料与方法
1.1 实验材料及试剂
人脐静脉内皮细胞株CRL-2922EA.hy926 购于美国ATCC 细胞库;DMEM 低糖培养基、胎牛血清(美国Gibco 公司);D-(+)-葡萄糖溶液(美国Sigma 公司);UA、Dorsomorphin(Compound C,Com C)dihydrochloride(美国Abmole 公司);CCK8 检测试剂盒(索莱宝生物科技公司);人细胞上清内皮素(endothelin-1,ET-1)酶联免疫吸附分析(enzyme linked immunosorbent assay,ELISA)试剂盒(上海酶联生物公司);一氧化氮检测试剂盒、总超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒及二氢乙锭(dihydroethidium,DHE)荧光探针(上海碧云天生物科技公司);细胞内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)抗体、AMPK抗体、p-eNOS(Ser1177)抗体及p-AMPK(Thr172)抗体(Affinity 公司);GAPDH(武汉三鹰公司)。
1.2 方 法
1.2.1 细胞培养 内皮细胞用含10%胎牛血清的DMEM 完全培养基于37℃,5%二氧化碳恒温培养箱中进行培养。当细胞融合生长达到约90%,用0.25%胰酶消化按1∶2传代,取对数生长期细胞接种24 h 后换液,进行后续实验。
1.2.2 实验分组 为探讨不同浓度UA 对高糖下内皮细胞存活的影响,UA 干预做浓度梯度分别为(0.1、1、10、50 μmol)。实验分组处理如下:(1)正常对照组(normal glucose,NG:含5.5 mmol 葡萄糖DMEM 培养基);(2)高糖对照组(high glucose,HG:含33 mmol 葡萄糖的高糖培养基);(3)高糖+UA 组(HG+UA:高糖培养基+UA 10 μmol 孵育);(4)高糖+UA+Compound C 组(HG+UA+Com C:高糖培养基+UA 10 μmol+Com C 1 μmol 孵育);干预时间为24 h。
1.2.3 CCK8 检测细胞存活 96 孔板贴壁细胞干预完后,向每孔加入10 μL CCK8 溶液,将培养板在培养箱内孵育1~4 h,用酶标仪在450 nm 处测定吸光度,实验重复3次,计算并评价细胞相对存活。
1.2.4 细胞上清一氧化氮浓度检测 待细胞处理结束,培养基1 000g离心10 min取上清备用。96孔板中加入标准品和样品,与NADPH(2 mmol)、FAD和Nitrate Reductase 混匀后,37 ℃孵育30 min;加入乳酸脱氢酶缓冲液和乳酸脱氢酶混匀后,37 ℃孵育30 min;加入Griess Reagent I 和Griess ReagentⅡ混匀后,室温(20 ℃~30 ℃)孵育10 min 后立即用酶标仪在540 nm 波长处测定各孔的光密度值并分析数据。
1.2.5 细胞上清内皮素-1浓度检测 ET-1浓度采用酶联免疫吸附试验法检测,样品制备同1.2.4。将标准品和样品分别加入反应孔中,与亲和链酶素-HRP 混匀后在37℃温育60 min;洗板5 次;加入底物A、B 后37℃避光温育15 min;加入终止液后立即用酶标仪在450 nm 波长处测定各孔的吸光度并分析数据。
1.2.6 二氢乙锭染色检测活性氧簇生成 细胞干预完后,以5 μmol 的DHE 染色液37 ℃避光孵育30 min,磷酸盐缓冲液溶液洗涤,经荧光显微镜观察并拍照。
1.2.7 超氧化物歧化酶活性检测 实验结束后按照试剂盒说明书推荐的操作步骤收集细胞,氮蓝四唑(NBT)显色法测定SOD 活性(U/mL),37 ℃孵育30 min 后用酶标仪在波长560 nm 处测定各孔吸光度值并计算SOD 相对活性。
1.2.8 蛋白免疫印迹 细胞加入裂解液,提取总蛋白,BCA 法测定蛋白浓度。将30 μg 变性好的蛋白进行十二烷基硫酸纳-聚丙烯酰胺凝胶,利用半干转法将蛋白转移至硝酸纤维素膜上,封闭1 h后,一抗4℃孵育过夜,TBST 洗膜3 次,二抗室温孵育1 h,TBST 缓冲液洗膜3 次,扫膜成像。
1.3 统计学分析
采用SPSS 16.0 统计软件进行数据录入及统计分析,GraphPad Prism 6.0 软件制图。计量资料用()表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 尿石素A 明显提高高糖诱导条件下内皮细胞存活
CCK8 实验结果显示,与正常对照组相比,高糖明显降低了细胞存活(P<0.05),UA(1 μmol~10 μmol)呈剂量依赖性提高内皮细胞的存活。10 μmol 和50 μmol 无明显差异(P>0.05)(图1),后续实验UA 干预浓度取10 μmol。
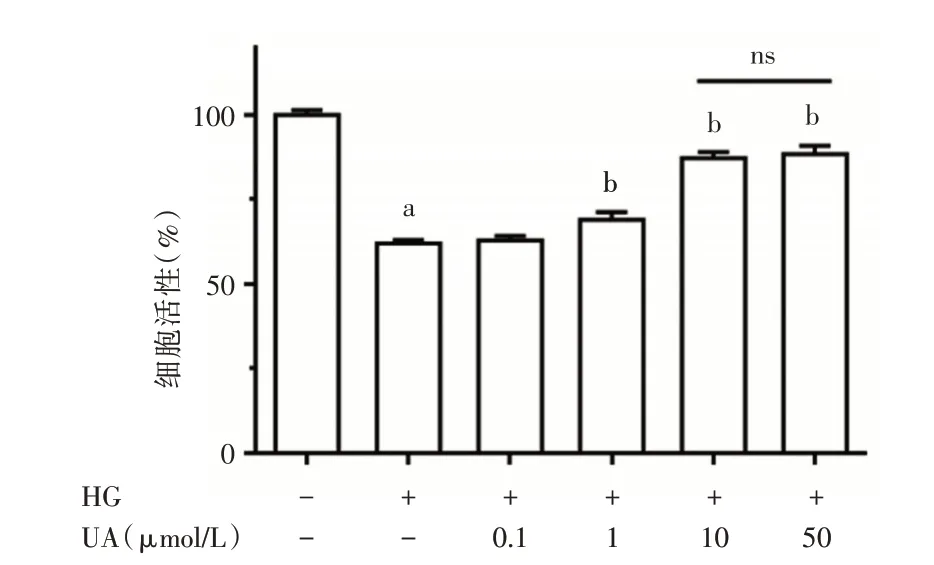
图1 不同干预分组下内皮细胞存活比较(HG:高糖培养基处理;UA:处理高糖组与正常组相比,aP<0.05;UA 处理组与高糖组相比,bP<0.05,ns:P>0.05)
2.2 尿石素A 改善高糖环境所致血管内皮功能障碍
通过检测各组内皮细胞分泌NO 和ET-1 的分泌量,我们评估了UA 对高糖环境下血管内皮功能的影响。与正常对照组比较,高糖明显降低NO 的分泌量(P<0.05),提高ET-1 的分泌量(P<0.05);加入UA(10 μmol)后,NO 的分泌量明显升高(P<0.05),ET-1 的分泌量降低(P<0.05)。而UA 的调节作用在同时给予AMPK 的抑制剂后消失(图2)。
2.3 尿石素A 降低高糖诱导血管内皮细胞的氧化应激水平
从DHE 荧光染色[检测活性氧(reactive oxygen species,ROS)生成]结果及荧光定量分析和SOD活性结果来看,与正常对照组比较,高糖环境使血管内皮细胞ROS 水平显著升高,SOD 活性降低(P<0.05);UA孵育明显减少ROS的水平和增加SOD活性(P<0.05);上述作用在同时给予AMPK 的抑制剂Com C后明显减弱(P<0.05)(图3)。
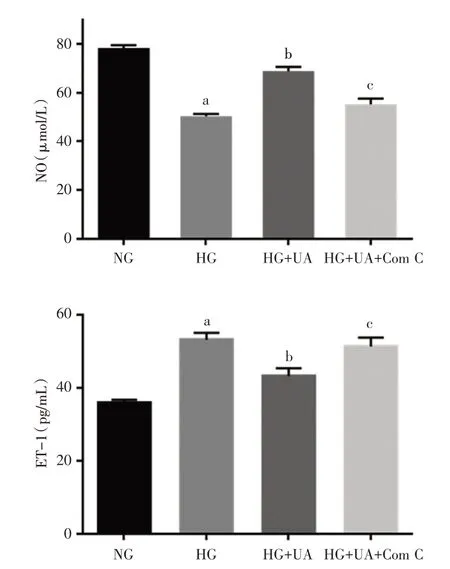
图2 UA对内皮细胞分泌NO和ET-1的影响(A:内皮细胞上清NO 浓度,B:内皮细胞上清ET-1 浓度)注:HG 组与NG 组相比,aP<0.05;HG+UA 组与HG 组相比,bP<0.05;HG+UA+Com C 组与HG+UA 组相比,cP<0.05
2.4 尿石素A 激活AMPK/eNOS 通路改善高糖所致内皮细胞损伤
在进一步的机制探讨中,我们通过蛋白免疫印迹检测UA 对AMPK/eNOS 信号通路的影响,相应蛋白磷酸化水平由p-AMPK/AMPK、p-eNOS/eNOS体现。结果显示与正常组比较,高糖干预的内皮细胞中AMPK、eNOS 磷酸化水平明显降低(P<0.05);UA 则可以有效逆转AMPK、eNOS 磷酸化水平改变(P<0.05);但该作用可被AMPK 的抑制剂所拮抗(P<0.05),见图4。以上结果表明,UA 可能通过激活AMPK/eNOS 通路改善高糖诱导的内皮细胞损伤。
3 讨论
近年来,我国糖尿病发病率逐年上升,糖尿病诱发的血管病变严重危害着糖尿病患者后期的生存质量。糖尿病的发生伴有糖脂代谢紊乱,而血糖的增高和游离脂肪酸的增多均可损伤血管内皮细胞。因此,保护内皮细胞免受高糖损伤至关重要。
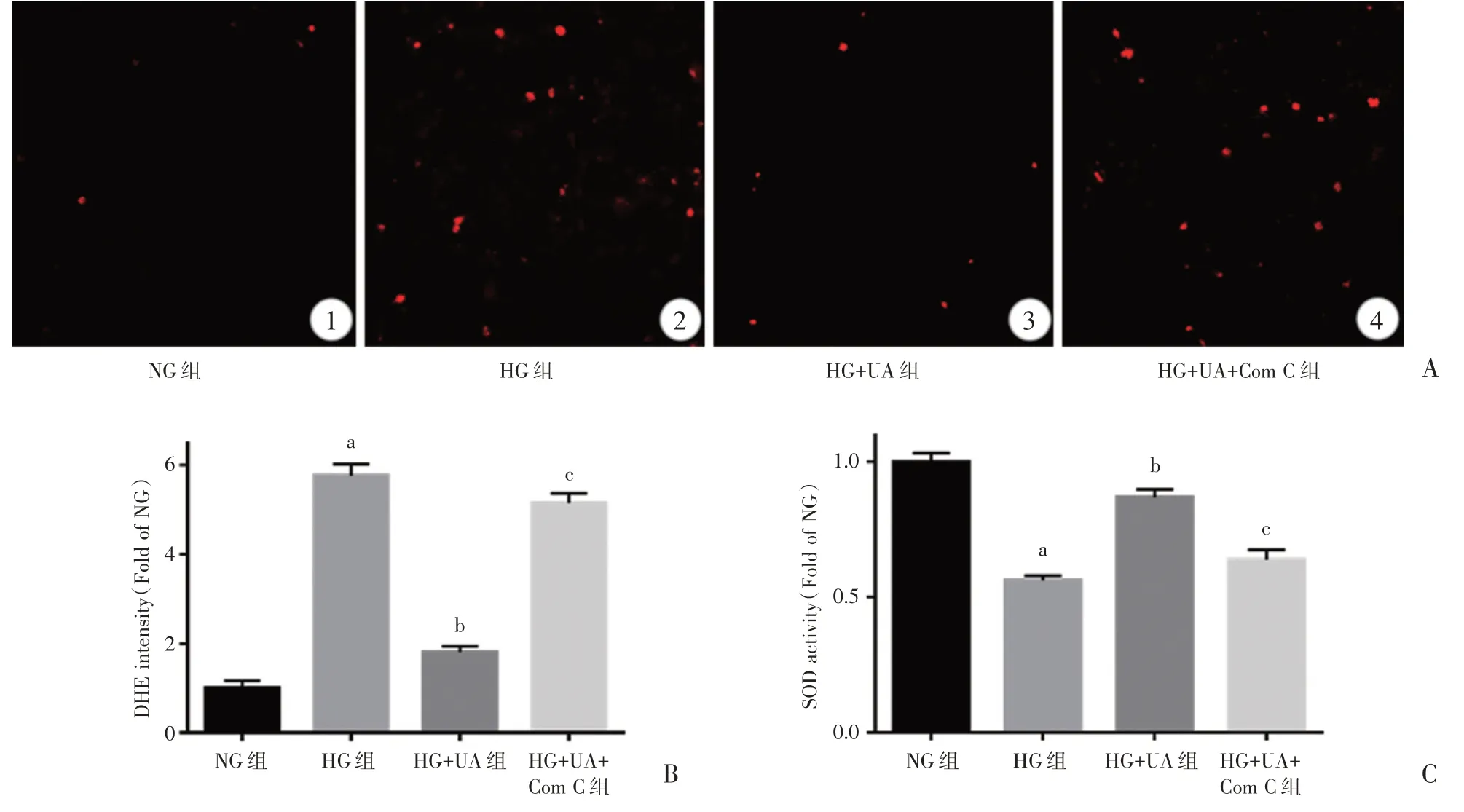
图3 各组内皮细胞ROS 水平及SOD 活性比较(A:DHE 荧光染色,×400;B:相对荧光强度定量;C:SOD 相对活性)注:HG 组与NG组相比,aP<0.05;HG+UA 组与HG 组相比,bP<0.05;HG+UA+Com C 组与HG+UA 组相比,cP<0.05
高糖环境下,内皮细胞线粒体膜电位震荡,NADPH 氧化酶活性增高,生成大量的ROS,破坏线粒体,使其功能严重失调,加剧氧化应激状态。血管内皮细胞能分泌多种活性物质来发挥舒缩血管、调节血管通透性、抗凝抗血栓等重要功能[14-15],其中NO 具有舒张血管、抗血小板聚集的作用;ET-1具有收缩血管,促血小板黏附的作用,是内皮依赖性血管舒缩作用的关键调节因子。生理情况下,NO 与ET-1 处于动态平衡水平,维持血管张力。在高糖环境下,其平衡被打破,ET-1 可以通过激活ETA/ETB 受体,增加内皮细胞氧自由基的生成[16],内皮细胞进一步损伤,引发血管病变。
AMPK 在许多信号通路的占核心地位[17-18],在内皮细胞中,AMPK/eNOS通路的激活,通过Ser1177位点激活eNOS 磷酸化,增加NO 的释放量,提高内皮细胞功能[19-20],还通过拮抗ET-1 浓度升高导致的氧化应激,发挥保护作用。此外,已经研发用于治疗2 型糖尿病的药品,如二甲双胍[21],噻唑烷二酮(TZD)[22]和胰高血糖素样肽-1 受体激动剂[23],均能激活AMPK,证明可用于预防糖耐量降低,延缓2 型糖尿病的进展。
UA 是经肠道菌群代谢生成的一类具有不同酚轻基的二苯并喃-6-酮衍生物,具有较高的生物利用度,对于多种疾病模型发挥积极的生物功效。Ryu 等[24]报道,UA 通过诱导线粒体自噬改善线粒体蛋白稳态,口服UA 可以延长线虫寿命和改善小鼠骨骼肌功能。石榴汁可改善患有冠状动脉粥样硬化性心脏病(冠心病)患者应激诱导的心肌缺血[25]并抑制巨噬细胞胆固醇和氧化脂质的积聚,减缓动脉粥样硬化进展以及控制其随后的心血管事件的发生[26]。最新研究证实,UA 可以直接清除自由基,保护Neuro-2a(神经-2a)细胞免于氧化应激损伤,发挥氧化酶抑制剂的效果,清除氧自由基,明显改善抗氧化酶(SOD、谷胱甘肽还原酶、过氧化氢酶等)的活性[22],提示UA在对抗氧化应激方面有非常大的潜在价值。UA可以通过激活AMPK信号蛋白,促进髓核(NP)细胞线粒体自噬,抑制凋亡,减弱椎间盘退行性变[27];在阿尔兹海默病模型中,通过增强脑神经元AMPK激活,产生抗炎和神经元保护作用,改善认知能力[13]。
以上研究表明,UA 具有抗氧化应激的活性,且其发挥生物功效与AMPK 的激活相关联,但其在糖尿病血管病变中的作用,以及其作用是否与AMPK的激活有关,国内外目前无相关的报道。
本研究证实,UA 可显著减轻高糖介导的血管内皮细胞ROS 水平的升高,促进eNOS 的磷酸化,通过维持NO/ET-1 的平衡而对血管舒缩、血小板聚集等生理活动具有调节作用,对抗高糖致内皮细胞的损伤;上述UA 的所有保护作用几乎都被AMPK 的抑制剂Com C 所消除,提示UA 的保护作用可能通过激活AMPK/eNOS 通路,上调其磷酸化有关。
综上所述,UA 能够抑制高糖介导的氧化应激,改善血管内皮功能障碍,显著拮抗高糖介导的血管内皮损伤,有望成为糖尿病血管并发症的防治提供新的干预手段,亦可为日后的相关研究提供思路。