腹腔镜下“淋巴引流区”前哨淋巴结清扫直肠癌根治术的疗效及对COX-2、PGE2、β-catenin信号通路的影响
2021-03-06张磊邵峰李丽军
张磊 邵峰 李丽军
随着经济社会进步,我国直肠癌的发病率和死亡率一直呈上升状态。2015 年中国癌症统计数据显示:我国结直肠癌发病率、死亡率在全部恶性肿瘤中均居第5 位[1],直肠癌根治术是治疗该病最有效的途径之一,术中淋巴结的清扫对手术后病灶转移及患者生存期有一定程度的决定作用,因此有效清扫淋巴结是很有必要的,本次研究观察腹腔镜下“淋巴引流区”前哨淋巴结清扫直肠癌根治术的疗效及对环氧化酶-2(cyclooxygenase-2,COX-2)、前列腺素E2(prostaglandin E2,PGE2)、β-连环蛋白(β-catenin)信号通路的影响。现报道如下。
1 资料与方法
1.1 一般资料 选择2018 年5月至2020 年5月东阳市人民医院确诊为直肠癌患者93例,其中男性72例、女性21例;年龄51~72岁,平均年龄(61.05±8.89);病程3个月~2 年,平均(0.92±0.23)年。纳入标准包括:①经病理学检查明确诊断为直肠癌;②手术方式为腹腔镜下直肠癌根术;③手术由同一名主治医师完成;④经伦理委员会审批及患者或者家属签署知情同意书。排除标准包括:①其他原发肿瘤转移至直肠,如胃癌等;②既往有其他恶性肿瘤切除病史;③近期使用过免疫增强或者抑制剂。随机分为观察组和对照组。两组患者一般资料比较见表1。两组比较,差异均无统计学意义(P均>0.05)。
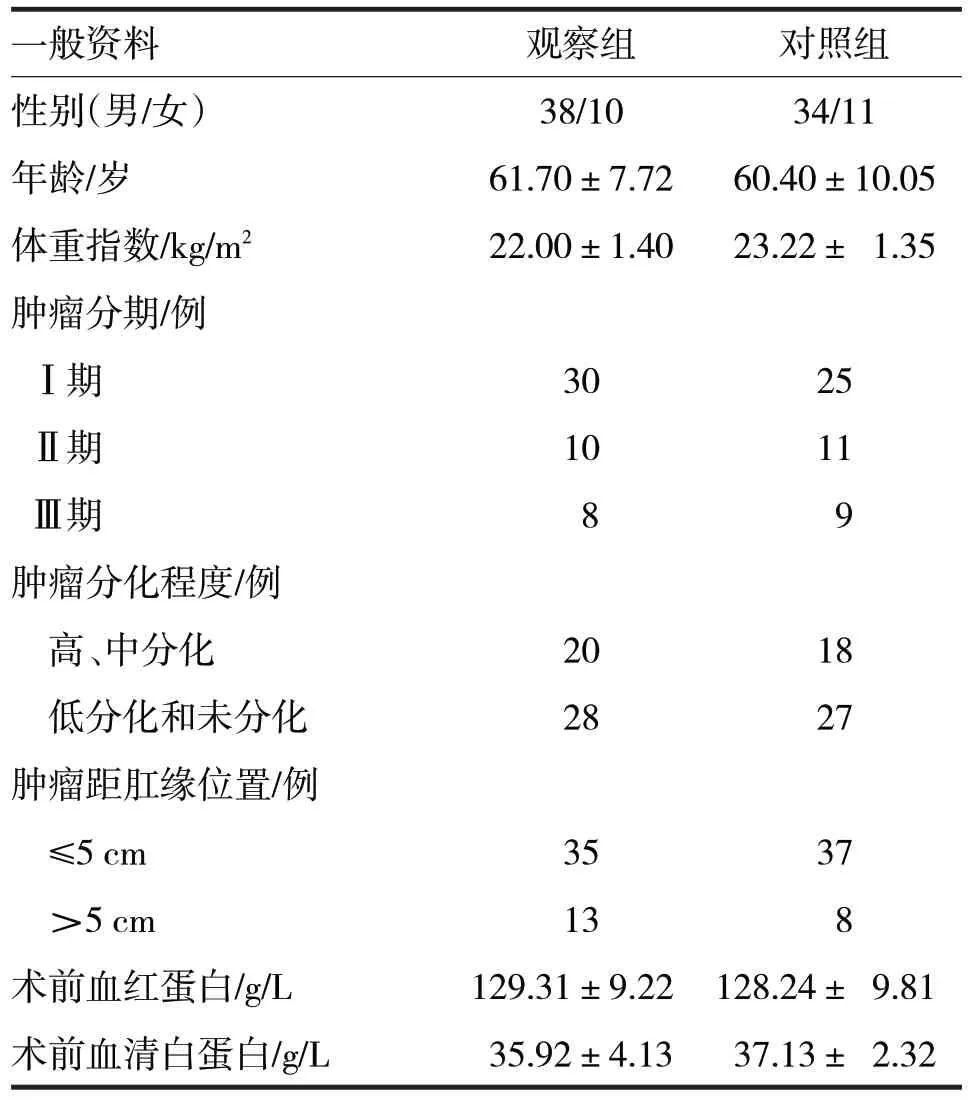
表1 两组患者一般资料比较
1.2 方法 两组患者术前均给予常规预防感染、营养支持,并进行常规肠道支持。
对照组在三方核对确认无误,全麻平稳,头低截石位,符合腹腔镜手术体位,常规消毒铺巾,连接腹腔镜各设备,于脐孔上缘作一1 cm 长皮肤切口,置入一次性直径12 mm Trocar,充CO2气体使腹腔压力达12 mmHg,并插入腹腔镜进入腹腔。在腹腔镜直视下分别于左侧及右侧腹直肌外缘置入直径5 mm Trocar2 枚,右下腹麦氏点旁置入一次性直径12 mm 的Trocar,左下腹反麦氏点旁置入直径5 mm 的Trocar,并插入腹腔。首先分离乙状结肠与侧腹膜粘连,提起直肠上血管投影处系膜,超声刀切开腹中线处腹膜,沿Toldt 筋膜和Gerota 筋膜间隙分离,向上游离肠系膜下动脉,注意保护腹下神经丛,HEMO-LOCK 夹闭肠系膜下动、静脉,离断血管,清扫根部淋巴结。沿解剖间隙向下向外分离,保护左输尿管避免损伤,向下沿直肠后间隙分离,注意保护腹下神经分支,参照TME 手术原则游离至肿瘤下方2 cm 处使用腔镜下直线切割闭合器离断直肠,于左下腹做一长约4 cm 纵行切口,切开皮肤、皮下组织,逐层进腹,切口周围放置切口保护套,然后将游离的肠段取出,距肿瘤上方约10 cm处离断并移去标本。接着于乙状结肠残端用2-0 prolin做荷包,置入29 mm 吻合器钉座结扎固定,然后将乙状结肠放回腹腔,鱼钩线缝合关腹,重建气腹,将29 mm 吻合器经肛门直肠断端前壁穿出,与钉座结合后旋紧吻合并击发,轻轻将吻合器连同钉座旋出。检查明确上下切缘完整,吻合后乙状结肠无张力,指检吻合口一圈完整,测漏试验无漏气。冲洗创面、彻底止血,清点器械纱布无误后,吻合口旁置盆底引流管一根并引出壁外并固定,逐层缝合皮肤。
观察组在对照组基础上于术前或术中注射纳米碳示踪剂对“淋巴引流区”前哨淋巴结进行清扫,具体注射方法:①腹腔镜手术术中将纳米碳注入距离肿瘤边缘0.5~1 cm 处浆膜下。②术前通过内镜将纳米碳示踪剂注入距离肿瘤边缘0.5~1 cm 处黏膜下(腹膜返折线以上的直肠段用此法)。③低位直肠癌(腹膜返折线以下的直肠段),于麻醉后手术前经肛门镜将纳米碳示踪剂注入距离肿瘤边缘0.5~1 cm处黏膜下,分3~4点注射(0.25 ml/点)。
1.3 观察指标 ①比较两组患者术中及术后一般情况。指标包括手术时间、术中出血量、淋巴结数量、术后排气时间和住院时间。②比较两组入组时和手术1周后的COX-2、PGE2、β-catenin 表达量:采用酶联免疫吸附测定法测定,所有试剂盒均由上海BG 生物工程公司生产。具体检测标准按照说明书指示。
1.4 统计学方法 采用SPSS 21.0 统计学软件进行数据分析。正态分布计量资料以均数±标准差()表示,组间比较采用t检验;非正态分布计量资料采用中位数(四分位数)表示,组间比较采用非参数检验。计数资料比较采用χ2检验。设P<0.05为差异有统计学意义。
2 结果
2.1 两组患者术中及术后一般情况比较见表2
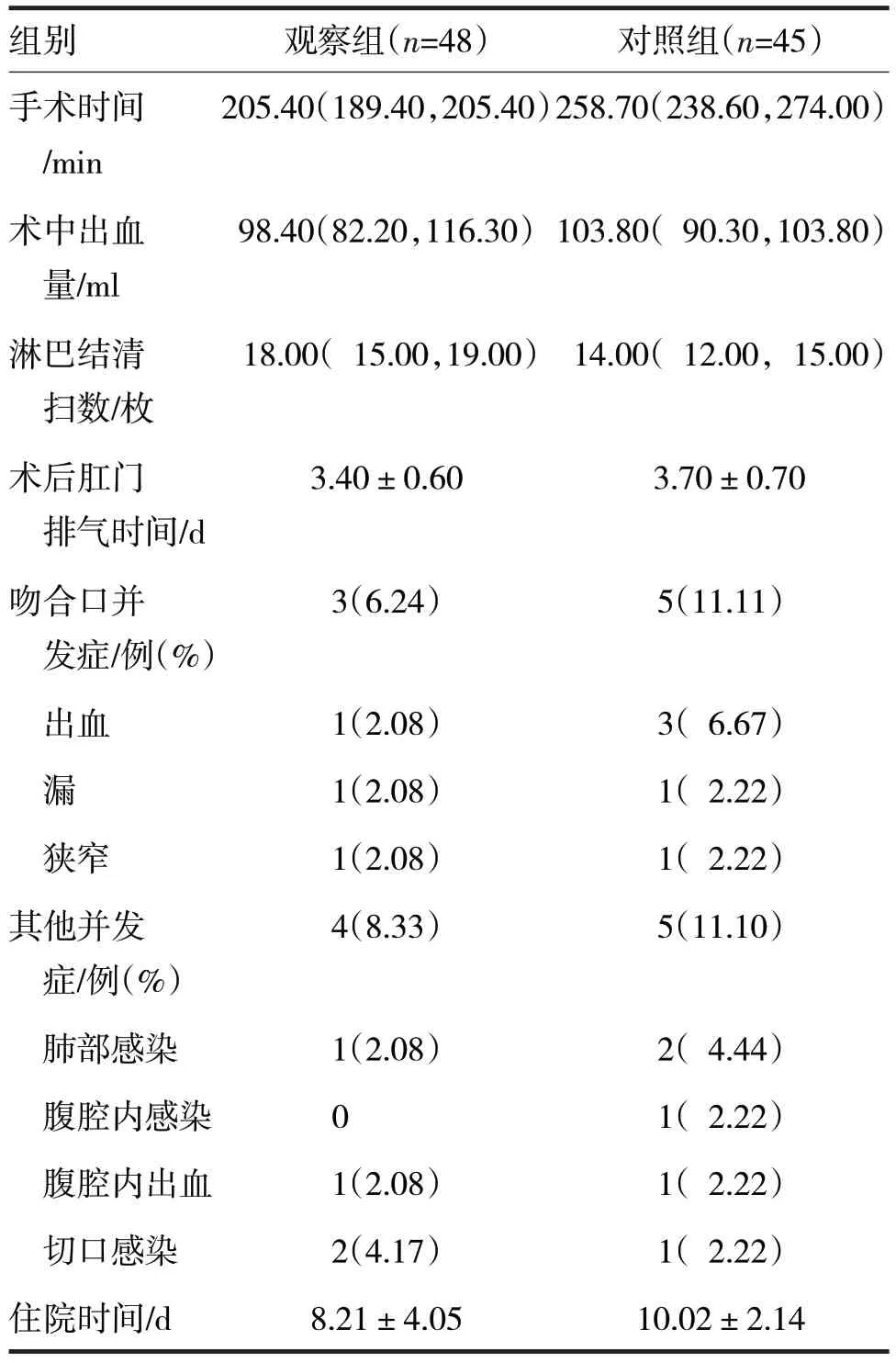
表2 两组术中及术后一般情况比较
由表2 可见,观察组患者的手术时间低于对照组,术中出血量少于对照组,淋巴结清扫数量多于对照组,术后肛门排气时间短于对照组,差异均有统计学意义(Z分别=-7.19、-2.17、6.85,t=-2.12,P均<0.05);两组患者吻合口并发症、其他并发症及住院时间比较,差异均无统计学意义(χ2分别=0.53、1.58,t=1.58,P均>0.05)。
2.2 两组治疗前后的COX-2、PGE2、β-catenin 表达量比较见表3
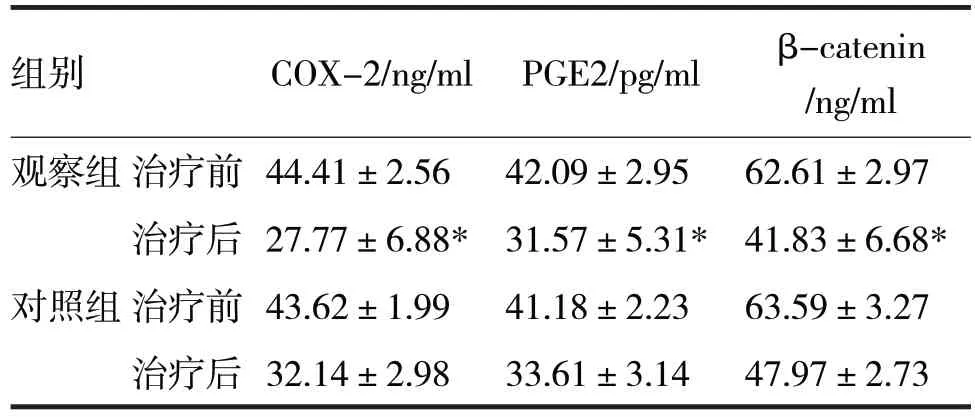
表3 两组COX-2、PGE2、β-catenin表达量比较
由表3 可见,治疗前,两组的COX-2、PGE2、β-catenin 表达量比较,差异均无统计学意义(t分别=-1.71、-1.67、1.49,P均>0.05)。治疗后,观察组COX-2、PGE2、β-catenin 表达量均低于对照组,差异均有统计学意义(t分别=3.92、2.27、5.73,P均<0.05)。
3 讨论
直肠癌是常见的恶性肿瘤之一,治疗手术方案也有多种,可以有传统开腹手术及腹腔镜手术,腹腔镜手术又可以分为传统2D腹腔镜及新兴的3D腹腔镜手术。有研究得出传统开腹手术增加了术后血栓的形成[2],腹腔镜手术可以降低并发症及复发率,直肠癌术后复发可能与术中淋巴结清扫不完全有一定程度关系[3],手术既要在遵循规范化原则的基础上保证原发灶和区域淋巴结的完整切除,避免切除不彻底造成残留给患者带来复发的危险,又要实施符合患者自身的个体化治疗方案,避免手术过程中盲目扩大切除和清扫范围给患者带来不必要的伤害。因此,确定合理的病灶切除及淋巴结清扫范围是直肠癌手术过程中必须解决的重要问题之一。常用的淋巴结示踪剂有“甲蓝、印度墨水”,与之相比,纳米碳示踪剂有染色明显,示踪效果良好的优势,本次研究也发现通过纳米碳示踪剂染色“淋巴结引流区”前哨淋巴结清扫后患者的淋巴结数量也明显更少,并且患者的手术时间也更短,减少了患者的术中出血量,此方案应用的安全性和可行性较高,这与刘津杉等[4]研究结果相吻合。
与诸多恶性肿瘤一样,直肠癌发病的最主要诱因之一也是长期慢性炎症刺激,COX-2 是机体内炎症调节因子,其是催化花生四烯酸形成PG 的限速酶之一,一般情况下COX-2 不表达,当发生炎症及癌变时呈现高表达[5],COX-2 在恶性肿瘤中的作用机制纷繁复杂,包括促进肿瘤免疫、增加肿瘤微血管形成,肖忠盛等[6]研究发现COX-2 可以促进肠癌的发生。PGE2 是COX-2 下游炎症因子,通过血管形成、细胞增殖,抑制细胞的免疫功能和凋亡,参与肿瘤的发生及发展[7]。Wnt、β-catenin 信号通路能够促进肠癌细胞中血管内皮生长因子的表达水平,从而增加肿瘤中血管的生成,促进肿瘤的进展[8,9]。本次研究发现治疗后观察组COX-2、PGE2、β-catenin信号通路的相应炎症因子表达量明显低于对照组(P均<0.05),说明采用腹腔镜下“淋巴引流区”前哨淋巴结清扫直肠癌根治术能够降低COX-2、PGE2、β-catenin信号通路的表达。
综上所述,腹腔镜下“淋巴引流区”前哨淋巴结清扫直肠癌根治术临床有效,并能够减少COX-2、PGE2、β-catenin 的表达量。但是具体的机制仍需要大量的临床或者实验通过基因测序手段验证。
