放线菌对酿酒微生物调控的初步解析
2021-03-06杨康卓廖勤俭乔宗伟刘多涛
施 思,张 霞,杨康卓,廖勤俭,乔宗伟,2,郑 佳,刘多涛
(1.宜宾五粮液股份有限公司,四川宜宾 644007;2.固态发酵资源利用四川省重点实验室,四川宜宾 644007)
白酒酿造是一项生物工程,特定白酒产区会在长期的驯化过程中孕育出一个较为稳定的“微生物圈”,而这个“微生物圈”与白酒酿造的整个过程密切相关。因此,白酒微生物的研究历来都是重要的讨论课题。在这个圈子里,细菌、酵母和霉菌是优势菌,大量的研究也主要集中于这些菌群在各个酿造区系中的分离鉴定、功能性物质分析和相关应用等方面[1-4]。在传统白酒酿造微生态的研究中,放线菌数量较少,对于这类菌群的研究并不充分,目前少量的生物调节机理阐释也主要集中在酱香和清香型白酒酿造环境中[5-6]。众所周知,放线菌具有产生大量次级代谢产物的能力,极强的生物调控作用,在生物医药领域中放线菌的研究已相对成熟。鉴于放线菌强大的生物调控能力,很有必要继续发掘其在独特的酿造环境中对发酵过程的生物调节作用及价值。
本研究立足五粮液特有的酿造资源,将已获得的放线菌株在实验室条件下充分发酵,以获得大量的代谢产物。通过纯菌株复配液态发酵试验探索放线菌在代谢调控方面的潜力;从新的角度来进一步揭示浓香型白酒的发酵机理,为白酒品质提升提供更多的基础理论和技术储备。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 菌株来源
实验室保存菌株:链霉菌Streptomyces sp.JP12(分离于窖皮泥,气生菌丝为长链弯曲)、链霉菌Streptomyces sp.RZ1(分离于糟醅,气生菌丝为初级松环)、小单胞菌Micromonospora sp.JD3(分离于窖底泥);酿酒酵母S.cerevisiaeJ7 和芽孢杆菌Bacillus sp.X6均分离于糟醅。
1.1.2 试剂
菌株复配液态共酵培养基成分为(参考粮食中碳氮质量比约为6.5∶1)[7]:葡萄糖17.5 g/L,细菌学蛋白胨2.7 g/L,氯化钠0.5 g/L。培养基相关试剂均为国产分析纯,色谱分析相关试剂均为进口色谱纯。
1.1.3 设备与仪器
离心机(5810),德国Eppendorf 公司;pH 计(inoLabpH740),德国WTW;生化培养箱(LRH)、恒温振荡器(THZ-98C),上海一恒科技;顶空固相微萃取(CAR/DVB/PDMS 纤维萃取,50 μm),美国Supelco 公司;气相色谱-质谱联用仪(GC-MS,7890B-5977B),高效液相色谱仪(1100),美国Agilent公司;色谱柱(Venusil ASB C184.6 mm×250 mm,5 μm),天津博纳艾杰尔公司。
1.2 试验方法
1.2.1 放线菌发酵物的提取
将放线菌培养物置于28 ℃摇床,120 r/min,培养5 d 获取发酵液;发酵液12000 r/min 离心15 min取上清液;上清液经0.2 μm 微孔滤膜过滤,收集得到本试验所用发酵产物。
1.2.2 发酵力测定
发酵力:1 mL 酵母菌液发酵72 h 利用蔗糖产生二氧化碳的毫升数,即mL/(mL·72 h),底物为8 %的蔗糖溶液。本试验采用的发酵温度为28 ℃和33 ℃,试验组添加1 mL 酵母菌液和1 mL 放线菌发酵产物,以不添加放线菌发酵产物的纯酵母发酵液为对照组,其他溶液配制参数不变[8]。
1.2.3 菌株复配液态共酵
1.2.3.1 芽孢杆菌与放线菌复配发酵
试验组培养基中添加2 %的细菌X6 种子液和2 %的放线菌发酵产物,以不添加放线菌发酵产物的纯细菌培养液为对照组,置于33 ℃静止培养5 d。发酵结束后,测pH值,并用0.45 μm微孔滤膜过滤,收集5 mL过滤液供有机酸检测备用。
1.2.3.2 酿酒酵母与放线菌复配发酵
试验组培养基中添加2 %的酵母J7 种子液和2%的放线菌发酵产物,以不添加放线菌发酵产物的纯酵母培养液为对照组。将其中一组用乳酸调节pH5.5,置于28 ℃静止培养5 d;另一组用乳酸调节pH4.5,置于33 ℃静止培养5 d。发酵结束后,用0.45 μm 微孔滤膜过滤,收集1 mL 过滤液供挥发性香气物质检测备用。
1.2.4 色谱分析
有机酸含量检测采用HPLC法测定[9],标准曲线为:y=0.284x-3.0446,R2=0.9999。挥发性香气物质检测采用顶空固相微萃取-气质联用法测定[10]。
1.2.5 代谢物路径分析
为进一步阐释放线菌调控产生的代谢物差异的生物学意义,使用MetaboAnalyst4.0 中路径分析模块,将相应的代谢物分别富集到酿酒酵母和芽孢杆菌的代谢途径上,使用超几何分布法计算,解析其调控路径。
2 结果与分析
2.1 发酵力检测
酵母与不同放线菌发酵产物在28 ℃和33 ℃共酵时发酵力的变化情况结果如图1所示。
由图1 可知,与对照组相比,3 组放线菌发酵产物具有程度不同地促进发酵作用。在不同温度下,链霉菌JP12 发酵产物均能极大提升酿酒酵母J7 的发酵水平。

图1 不同组别发酵力检测结果
2.2 发酵液pH值变化及有机酸检测
将实验室保存的1 株产酸的芽孢杆菌X6 与放线菌产物进行复配发酵,初始pH 6.95,33 ℃静止培养5 d 后,各发酵组pH 值变化情况分别为:对照组5.4、JP12 组5.74、JD3 组5.29,RZ1 组5.86。初步判断,JP12 和RZ1 组产物具有抑制产酸的趋势。通过对发酵液中四大酸的分析表明,JP12 和RZ1 组产物对细菌的产酸调控主要是抑制了乳酸的代谢,与此同时激活了少量己酸的生成。发酵液中四大酸的分析结果见表1。
2.3 挥发性香气物质检测
挥发性香味物质对于白酒的感官评价具有重要影响,本试验检测了低温低酸A 组(28 ℃、pH5.5)和高温高酸B组(33 ℃、pH4.5)发酵情况下,挥发性物质的代谢情况,如表2所示。
由表2 可知,3 株放线菌对各香味物质生成的影响程度不一。如异丁醇在低温低酸的发酵条件下,3 组试验组与空白组相比,产量分别提高了238.9%、225%和249%;而在高温高酸的发酵条件下,试验组中的异丁醇与对照组相比产量偏低,影响不显著。在己酸乙酯的生成影响中,JP12 和JD3试验组在两种发酵条件下都能促进己酸乙酯的生成,尤其是JP12 组在33℃、pH4.5 的试验条件下,将己酸乙酯的含量提高了669.4%。苯乙醇一般认为是具有玫瑰香的一类风味物质[11-12],试验结果显示,3 株放线菌产物复配试验组中,苯乙醇的含量在两种发酵条件下都显著升高。从苯乙醛的检测结果来看,初步推测是放线菌的发酵产物促进了苯乙醛的还原反应生成了苯乙醇,同时通过酯化作用生成了乙酸苯乙酯。从综合指标来看,菌株JP12 具有生产应用的潜能。
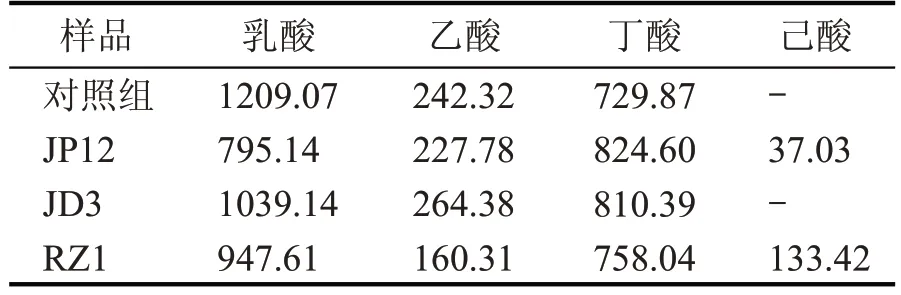
表1 发酵液中四大酸的分析结果 (mg/L)
2.4 代谢路径分析
为了探索放线菌产物在复配发酵中潜在的代谢调控途径,试验使用MetaboAnalyst4.0 对相关的代谢途径进行解析。上述试验结果显示,放线菌发酵产物具有降乳增己以及促进蔗糖代谢和生成苯乙醇的调控潜能,研究将乳酸、己酸、蔗糖、苯乙醛、苯乙醇分别富集到对应的芽孢杆菌及酿酒酵母的代谢途径,得到途径分析图见图2。
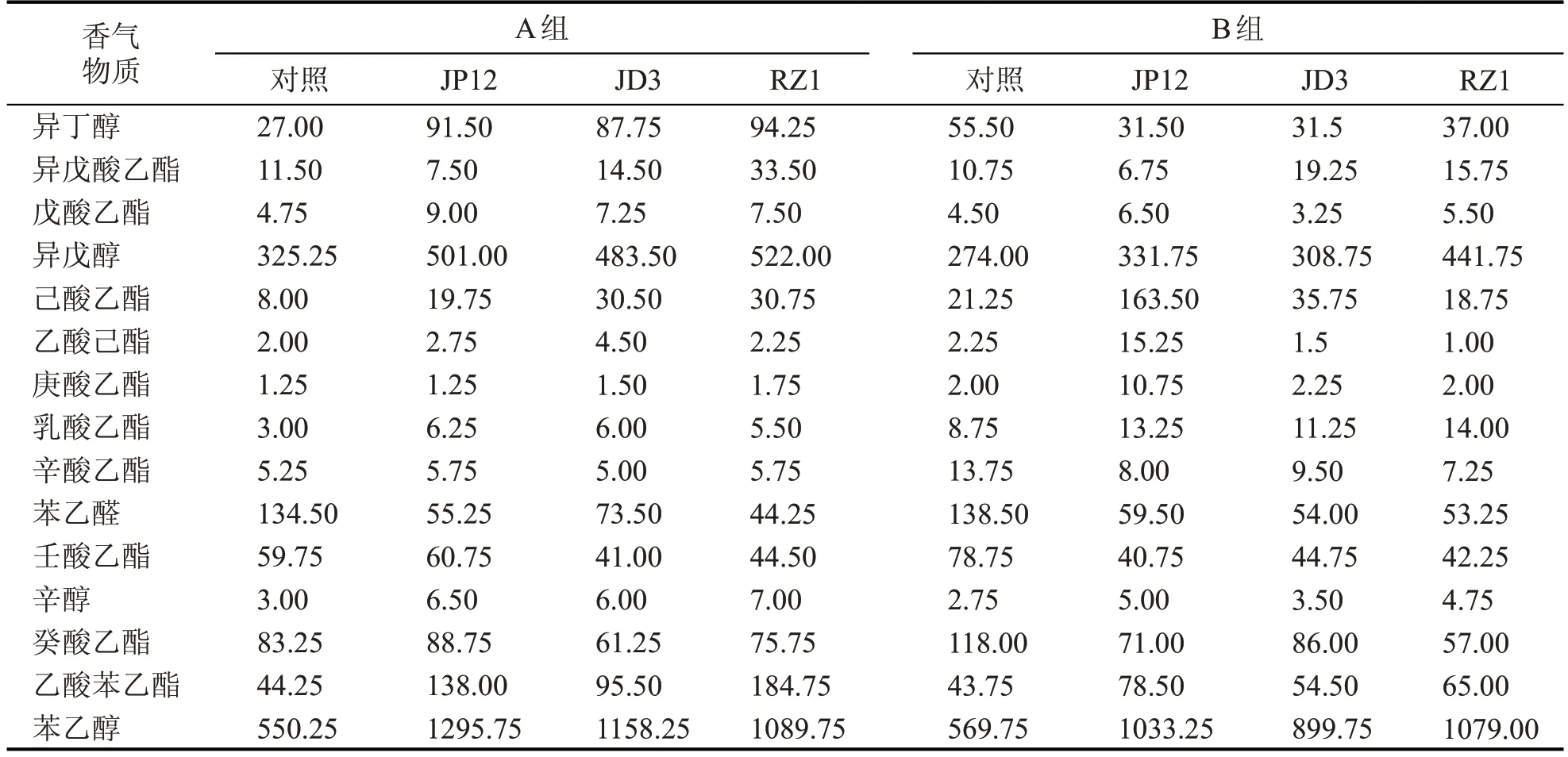
表2 挥发性香气物质检测结果 (μg/L)
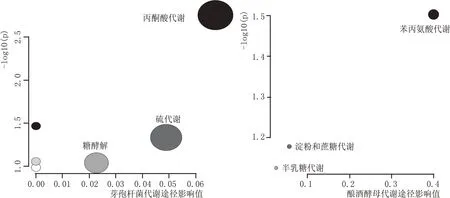
图2 代谢途径分析
图2 芽孢杆菌代谢通路分析结果显示共获得6条途径,基于影响值大于0.01 对关键代谢途径进行筛选[13],结果发现有3 条关键代谢途径分别是丙酮酸代谢、硫代谢和糖酵解途径。在模块中点击途径图中的相应圆圈,可以得到途径解析:在糖酵解途径中葡萄糖在葡萄糖激酶的作用下生成6-磷酸葡萄糖,再经果糖-6-磷酸激酶-1、醛缩酶、磷酸丙酮异构酶、丙酮酸激酶等酶作用下生成丙酮酸;在硫代谢中,硫酸盐等物质通过生成甲磺酸、L-同型半胱氨酸、O-乙酰基-L-丝氨酸、L-高苏氨酸等物质,并最终代谢生成烷磺盐酸、亚硫酸盐、半胱氨酸、乙酸盐和琥珀酸酯;在芽孢杆菌的丙酮酸代谢途径中,并无乙醇的生成,主要涉及乙醛代谢,生成乳酸、乙酸盐、丙酮酸、草酰乙酸及乙酰辅酶A 等代谢产物。这3 条代谢途径中影响值较高的物质为乙酸盐和乳酸。
图2 酿酒酵母代谢途径分析结果显示共获得3条途径,这3 条关键代谢途径分别是苯丙氨酸代谢、淀粉和蔗糖代谢及半乳糖代谢,其影响值依次为0.4、0.05669 和0.02564。在苯丙氨酸代谢途径中,苯乙醛影响值最高,由苯丙酮酸代谢生成;在半乳糖代谢中,蔗糖分别生成D-葡萄糖和D-果糖;在淀粉和蔗糖代谢中,淀粉与蔗糖的最终代谢物为D-葡萄糖。
3 讨论
放线菌是产生次生代谢产物最多的微生物,且大多具有生物调控作用。在实验过程中,相关放线菌产物并未对酵母和芽孢杆菌的生长繁殖产生破坏,只是对相关的代谢途径进行了不同的调控,如促进酵母蔗糖代谢、“控乳增己”和增强己酸乙酯、苯乙醇等风味物质。通过对放线菌生物调控的研究,可以将其中合理的调控应用到生产工艺的改善,同时通过对其代谢途径的解析,可以得到一些关键的中间代谢物,以便为进一步完善发酵机理提供更多的研究选择。研究也将在下一步对相关放线菌的代谢产物进行分离鉴定,为精准调控提供更多的可能。
