多模态磁共振成像在评估宫颈鳞癌病理分级和分期中的价值
2021-03-06刘济人胥毅郭丽美司鹏郭娟
刘济人,胥毅,郭丽美,司鹏,郭娟*
作者单位:1.山西医科大学第三医院(山西省白求恩医院山西医学科学院)肿瘤中心,太原030032;2.山西医科大学第二医院影像科,太原030001;3.山西医科大学第三医院(山西省白求恩医院山西医学科学院)影像中心,太原030032
子宫颈癌是女性生殖系统最常见的恶性肿瘤,严重威胁女性的生命安全,且发病年龄趋于年轻化[1,2]。其中鳞癌是最常见的病理分型,约占70%。恶性肿瘤的分期是评价其严重程度、判断预后和转归、选择合适的初始治疗模式以及个体化手术方案最重要的影响因素。对于不同分期的宫颈癌,采用的治疗方案也均有不同。早期(Ⅰ-ⅡA)宫颈癌患者首选手术治疗,而根治性同步放化疗是中晚期(ⅡB-ⅣA)宫颈癌患者的首选治疗方式[3-5]。此外,病理分级也是评价宫颈癌生物学行为及预后的重要指标,低分化宫颈鳞癌较中高分化宫颈鳞癌更易产生放化疗抵抗,且具有更高的转移率、复发率[6,7]。因此术前准确评估宫颈鳞癌的病情,对临床制订个性化精准诊疗计划及提高预后具有重要意义[8]。
磁共振成像具有较高的软组织分辨率,并可通过多方位、多参数成像对肿块位置、大小等形态学特点进行全面观察,是诊断宫颈癌的首选影像学检查[9]。但常规MRI 缺乏标准的可视化参数,因此在宫颈癌的病理分级及分期评估中存在一定的局限性。随着磁共振技术的发展,定量磁共振技术可在无创性观察组织或器官解剖结构的同时获得反映肿瘤组织功能状态的定量指标,对疾病进行更全面、客观的评估。以往研究表明扩散加权成像(diffusion weighted imaging,DWI) 和动态对比增强MRI(dynamic contrast enhanced MRI,DCE-MRI)在评估宫颈癌病理分级、分期以及预后方面具有一定的价值[10-12]。Winfield 等[13]报道低分化宫颈癌的表观扩散系数(apparent diffusion coefficient,ADC)明显低于中高分化宫颈癌。但是ADC 仅反映与组织细胞密度相关的水分子扩散受限程度等信息,不能全面反映肿瘤异质性信息。DCE-MRI 可通过细胞外顺磁性示踪剂的分布获得容积转运常数(Ktrans)和速率常数(Kep),用于评估肿瘤新生血管与微血管通透性等组织微循环特点[14]。但是需要注射对比剂且图像后处理较复杂,在临床应用方面具有一定的限度。近年来,磁共振弛豫定量技术逐渐应用于临床。T1 mapping 是描述组织纵向弛豫时间的定量技术,通过对组织的固有特性的测量获得反映组织成分及病理学信息,可对疾病进行更客观的评价,为肿瘤评估提供了新的技术手段[15]。T1 值已被用于前列腺癌与炎性病变的鉴别[16]以及脑胶质瘤病理分级的评估[17]。然而,T1 值对于宫颈鳞癌的病理分级及分期的预测少有报道。本研究目的是以DWI 和DCE-MRI 为参考,定量分析T1值对评估宫颈鳞癌病理分级及分期的应用价值,以期为宫颈癌提供更多依据指导治疗。
1 材料与方法
1.1 一般材料
回顾性分析2020 年3 月至2021 年2 月于山西医科大学第二医院就诊的宫颈病变患者病例。纳入标准:(1)病理诊断为鳞癌;(2)患者术前行T1 mapping、DWI 及DCE-MRI 序列扫描。排除标准:(1)图像伪影重;(2) MRI 扫描检查前接受与肿瘤相关的治疗。最终符合上述标准患者65 例。其中高分化组11 例,年龄34~75 岁,平均年龄为60.0 岁;中分化组32 例,年龄30~78 岁,平均年龄为56.9 岁;低分化组22 例,年龄38~74 岁,平均年龄为55.9 岁。根据FIGO(International Federation of Gynecology and Obstetrics) 2018[18]分期如下:ⅠB1 5 例,ⅠB2 11 例,ⅠB3 6例,ⅡA 15例,ⅡB 7例,ⅢA 8例,ⅢB 6例,ⅢC 5例,Ⅳ2例,其中早期组(ⅠB-ⅡA期) 37例,晚期组(ⅡB-Ⅳ期) 28例。本研究获得山西医科大学第二医院伦理委员会批准(伦理批件号:2021YXD024)并免除受试者知情同意。
1.2 数据采集
使用3.0 T MRI 扫描仪(GE Pioneer)及腹部相控阵表面线圈进行扫描。患者膀胱适度充盈,自由呼吸,腹带加压以减少呼吸伪影。先行常规MRI 扫描,包括轴位T1WI、T2WI、脂肪抑制T2WI,矢状位T2WI以及冠状位T2WI。矢状位扩散加权成像参数:TR/TE 4800 ms/73.9 ms;层厚/层间距4 mm/1 mm;矩阵140×70;FOV 24 cm×12 cm;b 值50,800 s/mm2。矢状位多对比度一站式弛豫定量技术扫描参数:TR 4000 ms;TE1/2 21.59/96.4 ms;TI 210,610,1810,3810 ms;翻转角90/110°;层厚/层间距4 mm/1 mm;FOV 26 cm×26 cm;矩阵320×192。矢状位动态增强扫描参数:TR 6.4 ms;TE 1.9 ms;层厚2.5 mm;FOV 26 cm×26 cm;矩阵260×224,共采集50 次,增强扫描对比剂为钆双胺(Gadodiamide,GE),高压注射器以3 mL/s 速率注射,剂量为0.1 mmol/kg,并配合20 mL生理盐水助推。
1.3 图像分析
通过后处理工作站的相关软件对图像进行后处理获得T1、ADC、Ktrans和Kep定量参数图。两名影像科医师分别独立勾画ROI 并取测量的平均值作为最终测量值。以矢状位T2WI 作为参考图像,选取肿瘤最大层面,沿肿瘤边界手动勾画感兴趣区(region of interest,ROI),避开坏死、囊变区,获得相应的定向参数:纵向弛豫时间(T1,ms)、ADC (mm2/s)、容积转运常数(Ktrans,min-1)和速率常数(Kep,min-1)值。
1.4 统计学分析
应用SPSS 21.0 进行统计学分析。采用组内相关系数(intraclass correlation efficient,ICC)评价两位放射科医师各参数测量结果的一致性,ICC>0.75 认为具有良好的一致性。正态分布计量资料采用均数±标准差(±s)表示。应用单因素方差分析评估不同病理分级之间定量参数值的差异,两两比较采用LSD 法。应用独立样本t检验分析早期组与晚期组间的差异。采用受试者工作特征(receiver operating characteristic,ROC)曲线确定诊断宫颈鳞癌病理分级以及分期的诊断效能,计算曲线下面积(area under the curve,AUC),根据约登指数确定各参数的最佳诊断界值、敏感度和特异度。P<0.05表示差异有统计学意义。
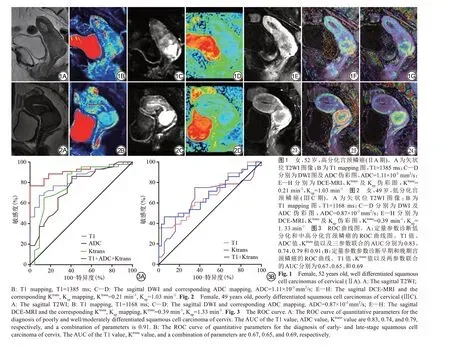
2 结果
2.1 多模态定量参数评估宫颈鳞癌病理分级和分期
T1、ADC、Ktrans和Kep测量值的ICC 分别为0.973(95%CI:0.956~0.984)、0.984 (95%CI:0.974~0.990)、0.990 (95%CI:0.984~0.994) 和0.947(95%CI:0.915~0.968)。低分化组、中分化组以及高分化组的T1 值分别为(1163.64±63.82) ms、(1273.27±116.46) ms、(1331.95±97.81) ms,ADC值分别为(0.91±0.15)×10-3mm2/s、(1.04±0.13)×10-3mm2/s、(1.07±1.78)×10-3mm2/s,Ktrans值分别为(0.43±0.15) min-1、(0.30±0.11) min-1、(0.28±0.05) min-1,Kep值分别为(1.28±0.39) min-1、(1.16±0.42) min-1、(1.19±0.45) min-1。单因素方差分析结果表明,3组之间的T1、ADC、Ktrans值差异存在统计学意义(P均<0.05),Kep值差异无统计学意义(P=0.550),见表1,图1、2。在比较早期组与晚期组宫颈鳞癌中,T1 和Ktrans值的差异有统计学意义(P<0.05),ADC 和Kep值的差异均无统计学意义(P>0.05),见表1。
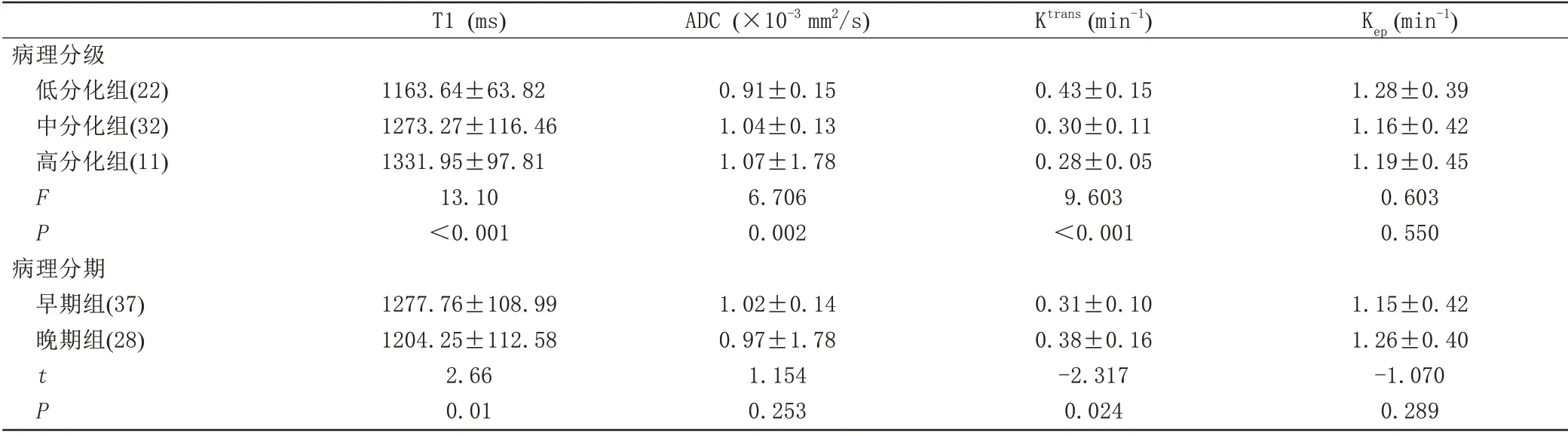
表1 宫颈鳞癌不同病理分级和分期定量参数比较Tab.1 Comparison of quantitative parameters among different histologic grade and stage of cervix squamous cell carcinoma
2.2 定量参数鉴别宫颈鳞癌病理分级及分期的诊断效能
以T1、ADC 和Ktrans值作为诊断指标绘制ROC 曲线,诊断低分化宫颈癌鳞的AUC 分别为0.83、0.74 和0.79,诊断界值分别为1226.25 ms、0.91×10-3mm2/s和0.30 min-1。三个参数联合的诊断效能最高,AUC值为0.91,见表2、图3A。以T1和Ktrans值作为诊断指标绘制ROC 曲线,诊断早期宫颈鳞癌的AUC 分别为0.67 和0.65,诊断界值分别为1149.25 ms 和0.29 min-1。T1和Ktrans联合后诊断效能为0.69,见表2、图3B。

表2 定量参数对宫颈鳞癌病理分级及分期的诊断效能分析Tab.2 Diagnostic performance of quantitative parameters for histologically grading and staging squamous cell carcinoma of cervix
3 讨论
本研究以DWI 和DCE-MRI 的定量参数为参考探讨了定量参数T1值在预测宫颈鳞癌病理分级及分期的价值。研究结果显示随着分化程度的降低以及分期的升高,宫颈鳞癌的T1 值降低,且诊断效能高于ADC和Ktrans值,说明T1值在评估宫颈鳞癌病理分级及分期中具有一定的意义。此外研究发现三参数联合的诊断效能高于单个参数,表明多参数联合能够进一步提高宫颈鳞癌病理分级和分期术前评估的准确性。T1 值可作为一种有效的影像学手段对宫鳞癌的病理分级和分期进行评估,多参数联合可为临床医师选择治疗方案提供更全面、准确的信息。
3.1 定量参数预测宫颈鳞癌病理分级及分期
纵向弛豫时间(T1-relaxation time)是磁共振软组织对比度的关键来源之一,是反映组织固有物理特性的参数值。其最早应用于心血管成像,在心肌水肿、纤维化及浸润性疾病的诊断、治疗及预后过程中都发挥了极大的作用[15,19]。T1 值受细胞组织密度、蛋白质、多肽等大分子含量、组织含水量及微坏死等多种因素影响,可以从分子水平反映组织的生理学和病理学变化,有助于对疾病发生、发展的病理状态进行更客观的评估[20]。因此近年来逐渐应用于定量评价前列腺癌[21]、乳腺癌[22]、脑胶质瘤[23]等恶性肿瘤。Adams 等[24]研究结果表明T1 值可作为反映肾透明细胞癌病理分级的内在标志物,且与肿瘤组织细胞外基质呈正相关。Peng等[25]利用T1值评估肝细胞癌的分化程度,结果显示低分化肝细胞癌的T1 值明显低于中高分化肝细胞癌。本研究结果与以往研究结果一致,发现随着分化程度的降低,宫颈鳞癌T1 值降低。分析原因为宫颈鳞癌组织中,肿瘤的分化越差,细胞增殖越快,细胞核越大,核异质性明显,核浆比会越大,细胞间隙缩小,水含量减少,导致组织T1 弛豫时间缩短[26]。此外,肿瘤细胞的快速增殖导致组织微坏死增多,伴随着微坏死出现的复杂的顺磁性原子及蛋白质也会导致T1弛豫时间缩短[27]。张斐斐等[28]利用T1 mapping评估宫颈癌分化程度,结果显示低分化宫颈癌T1 值低于中高分化宫颈癌,但是差异无显著统计学意义。这可能与研究对象同时包括鳞癌和腺癌有关。由于不同病理组织类型宫颈癌之间的T1值可能存在差异,所以本研究只纳入了鳞癌,未将腺癌纳入分析。在评估宫颈鳞癌分期中,T1 值与分期呈反比,随着分期的升高,T1 值有所降低。这可能是由于不同分期肿瘤间大分子浓度、水结合状态和组织含水量等多种生物学因素影响所致[28]。以上结果说明,T1 值能够评估宫颈鳞癌的恶性程度。与T1 mapping 不同,DWI 和DCE-MRI 通过反映组织内水分子扩散状态和血液灌注信息,用于良恶性病变的鉴别、恶性肿瘤分化程度的评估。本研究中的ADC值随着宫颈鳞癌分化程度的降低和分期的升高呈降低趋势[11],Ktrans则相反[29]。
3.2 定量参数评估宫颈鳞癌病理分级及分期的诊断效能
对比ADC和Ktrans值,T1值在预测宫颈鳞癌病理分级和分期方面具有更高的诊断效能,表明T1 值优于ADC 和Ktrans值,但仍需大样本研究验证。不同的定量参数从不同方面反映生物组织特性,因此多参数联合较单个参数能够提供更全面的肿瘤病理特征的详细信息。Baur 等[30]在评估前列腺良恶性肿瘤发现结合T1 和ADC 值的诊断效能优于单个参数。同样,在胰腺炎和导管腺癌鉴别诊断中,T1、T2 和ADC 值多参数联合较单个参数获得了更高的AUC、敏感度、特异度和准确度,且差异具有统计学意义[31]。本研究结果也表明三种参数联合诊断效能高于单独参数值,说明多参数联合改善了单独使用一种技术的缺点,能更加全面、准确及定量诊断和评估宫颈鳞癌的病理分级及分期。
3.3 本研究的局限性
本研究存在一定的局限性。第一,本研究样本量较小,需要更大的样本量来验证我们的结果。第二,参考既往文献,为避免不同病理类型宫颈癌之间的差异的影响,本研究仅选用宫颈鳞癌作为研究对象。未来还需纳入更多的宫颈癌病理学类型进行研究。第三,本研究未讨论T1 值与组织细胞外体积分数等内在病理生理学指标的相关性。计划在未来的扩展研究中,纳入病理指标进行分析。
综上所述,T1 mapping 技术可获得反映组织纵向弛豫时间的定量数据,在一定程度上反映宫颈鳞癌的病理分级及分期,有助于预测其恶性程度,联合DWI 和DCE-MRI 参数能够进一步提高评估的准确性,为临床治疗方案的选择和预后评估提供更可靠的影像学信息。
作者利益冲突声明:全部作者均声明无利益冲突。