MRI纹理分析预测心肌淀粉样变有无延迟强化的价值初探
2021-03-06伍希唐露邓巧吴韬刘念张天静陈玉成黄小华孙家瑜
伍希,唐露,邓巧,吴韬,刘念,张天静,陈玉成,黄小华,孙家瑜*
作者单位:1.川北医学院附属医院放射科,南充637000;2.四川大学华西医院放射科,成都610041;3.飞利浦(中国)投资有限公司,广州510180;4.四川大学华西医院心内科,成都610041
淀粉样变是一种由不溶性纤维原蛋白沉积在心脏、肾脏等器官的系统性疾病[1]。不溶性复合物聚集于心肌细胞外间隙,称为心肌淀粉样变性(cardiac amyloidosis,CA)。CA 是心脏疾病中较为少见的限制型心肌病,会引起心肌增厚、心室功能降低、心律失常、最终可能引起心力衰竭等一系列形态和功能障碍。且CA病情进展迅速,在早期缺乏特异性,导致CA 患者较高的病死率[2]。因此,早期准确诊断CA,从而提供更精准的临床治疗对改善预后有重要的意义[3]。心内膜下心肌活检是诊断CA的金标准,但因其有创、风险较高且价格昂贵等原因不能作为常规检查。心脏磁共振(cardiovascular magnetic resonance,CMR)作为一种无创影像检查方法,能够提供心脏形态、功能以及组织学和血流动力学信息,是CA多模态成像评估的一个重要工具[4,5]。传统的CMR 对CA 的诊断主要基于钆对比剂延迟增强(late gadolinium enhancement,LGE)序列典型的心内膜下环形强化或透壁强化,对于CA伴随肾功能不全的患者,在一定程度上限制了LGE 序列的应用。心肌延迟强化与CA 患者死亡率增加有关,早期识别心肌有无延迟强化并进行危险分层,对CA 患者的治疗和预后有重大价值[6]。因此,我们尝试用影像组学方法对CA 患者的native T1 mapping图像进行纹理分析。
纹理是图像的一个固有属性,其特征是描述图像像素分布特点及灰阶强度,能够反映图像中肉眼不可见的微观信息。纹理分析作为一种新的医学图像分析技术,现已广泛应用于各种疾病的研究中。通过磁共振成像(magnetic resonance imaging,MRI)纹理分析提取客观数据能够增加疾病诊断可信度和预测临床结果,同时能够减少扫描序列缩短检查时间[7]。目前,纹理分析在CMR 中的研究也越来越广泛,既往多个研究[8-10]已经证明非对比增强的MRI纹理分析在梗死样急性心肌炎、高血压性心脏病和肥厚型心肌病等心脏疾病的诊断或鉴别诊断中能提供有用信息,而采用native T1 mapping心肌纹理特征来预测淀粉样变心肌有无延迟强化的研究暂未检索到。因此本研究旨在探讨心肌MRI 纹理分析在鉴别无延迟强化淀粉样变心肌与健康心肌的差异及在预测CA 患者心肌有无延迟强化中是否有潜在的价值。
1 材料与方法
1.1 临床资料
本研究回顾性分析2013 年8 月至2021 年5 月四川大学华西医院经病理证实的132 例轻链型CA 患者的临床及影像学资料。按照CMR 有无延迟强化分为无延迟强化组(45 例)和延迟强化组(87 例),同时纳入年龄和性别与无延迟强化组匹配的健康对照组66 例。CA 患者纳入标准:(1)有完整的临床资料和手术病理结果,能够明确诊断;(2)未合并其他心脏疾病。(3)序列至少包括电影磁共振成像(cine magnetic resonance imaging,cine-MRI)序列、native T1 mapping序列及LGE序列。排除标准:(1)在CMR检查前接受过放射治疗和药物治疗。(2)图像质量欠佳,不能满足图像分割和影像诊断要求。健康对照组纳入标准:(1)正常心脏形态及功能;(2)无高血压、高脂血症和糖尿病等心血管风险因素;(3)无个人及家族心血管病史。
本研究通过四川大学华西医院伦理委员会批准(批准文号:2019年审381号),免除受试者知情同意。
1.2 检查方法
采用3.0 T 核磁共振扫描仪(Siemens Magnetom Tim Trio),32 通道专用心脏线圈进行检查。主要扫描序列包括:(1) cine-MRI序列。采用回顾性心电门控的平衡稳态自由进动序列在屏气状态下完成采集,扫描方位包括连续短轴位(从左心室基底部到心尖)和单层长轴位(两腔心、三腔心和四腔心)。扫描参数如下:重复时间3.4 ms;回波时间1.2 ms;扫描视野300~360 mm;矩阵256×144;层厚8 mm;层间距0 mm;翻转角36°~50°;时间分辨率42 ms。(2) native T1 mapping序列。通过前瞻性心电门控技术,使用经运动校正后的LOOK-LOCKER反转恢复序列进行采集,扫描方位包括三层短轴位(左心室基底层、中间层、心尖层)和单层长轴位(四腔心)。扫描参数如下:重复时间2.9 ms;回波时间1.12 ms;矩阵193×144;翻转角35°;首次反转时间为100 ms,往后每次增加80 ms;并行采集因子2;带宽930 Hz/像素;层面空间分辨率:2.1 mm×1.4 mm,共采集11 个心动周期。(3) LGE序列。采用二维相位敏感反转恢复序列,扫描方位与cine-MRI 序列一致,在注射钆对比剂5 min 左右进行扫描。扫描参数如下:重复时间613 ms;回波时间3.4 ms;扫描视野300~360 mm;矩阵256×144;层厚8 mm;层间距0 mm;翻转角20°;在扫描LGE 序列之前,通过扫描反转时间侦察(inversion time scout,TI-scout)序列,找到心肌过零点的TI 值用于LGE扫描。
1.3 心功能参数测量
将采集的短轴电影序列使用西门子Argus 软件进行分析,逐层勾画舒张末期左心室心内膜和心外膜及右心室心内膜轮廓,收缩末期左、右心室心内膜轮廓,得到左右心室射血分数、舒张末期容积指数、收缩末期容积指数和左室心肌质量指数等心功能参数。
1.4 图像分割与特征提取
由两位分别有4 年和6 年工作经验的放射科医生采用手动分割法进行图像分割。将所有受试者的MRI 图像以DICOM 格式进行保存,图像分割采用ITK-SNAP 软件。选择native T1 mapping 序列短轴位上心肌中间层面的map图像载入软件,在左室中间层心肌勾画感兴趣区(region of interest,ROI),如图1B所示。ROI的勾画需要避开血池和乳头肌,防止产生噪声和部分容积效应。将勾画的ROI 图像及原始图像以.nii 格式进行保存,选择FeAture Explorer (FAE,V0.3.7)软件[11]进行特征提取。提取特征包括形状特征、一阶直方图特征及灰度共生矩阵(gray level co-occurrence matrix,GLCM) 和灰度游程矩阵(gray level run-length matrix,GLRLM)等二阶特征。
1.5 特征筛选与建立模型
1.5.1 无延迟强化组与健康对照组
通过R 软件(Version:4.0.4),对两位放射科医生进行图像分割后所提取的特征矩阵采用组内相关系数(intraclass correlation coefficient,ICC)来评价纹理特征的一致性,筛选出ICC≥0.8 的纹理特征,增加特征的鲁棒性;并选择有6 年工作经验的医生提取的纹理特征矩阵进一步特征筛选并建立模型。将数据以7∶3 的比例在保持正负样本比例一致的情况下随机拆分为训练集与测试集,训练集用于特征筛选和构建模型,测试集用于测试模型的泛化性。通过FAE 软件对训练集利用合成少数类过采样技术(synthetic minority oversampling technique,SMOTE)平衡阴性和阳性样本,对数据进行Z-score 标准化处理,通过皮尔森相关系数(pearson correlation coefficient,PCC)进行预处理,对PCC≥0.99 的特征删除其中一个,使每个特征相互独立。并进行十折交叉验证,通过递归式特征消除法(recursive feature elimination,RFE)选择最优特征子集建立无延迟强化组与健康对照组的支持向量机(support vector machine,SVM)模型A。
1.5.2 无延迟强化组与延迟强化组
采用上述同样的特征提取、筛选和建模方法,构建无延迟强化组与延迟强化组的SVM模型B。本研究影像组学流程如图1.
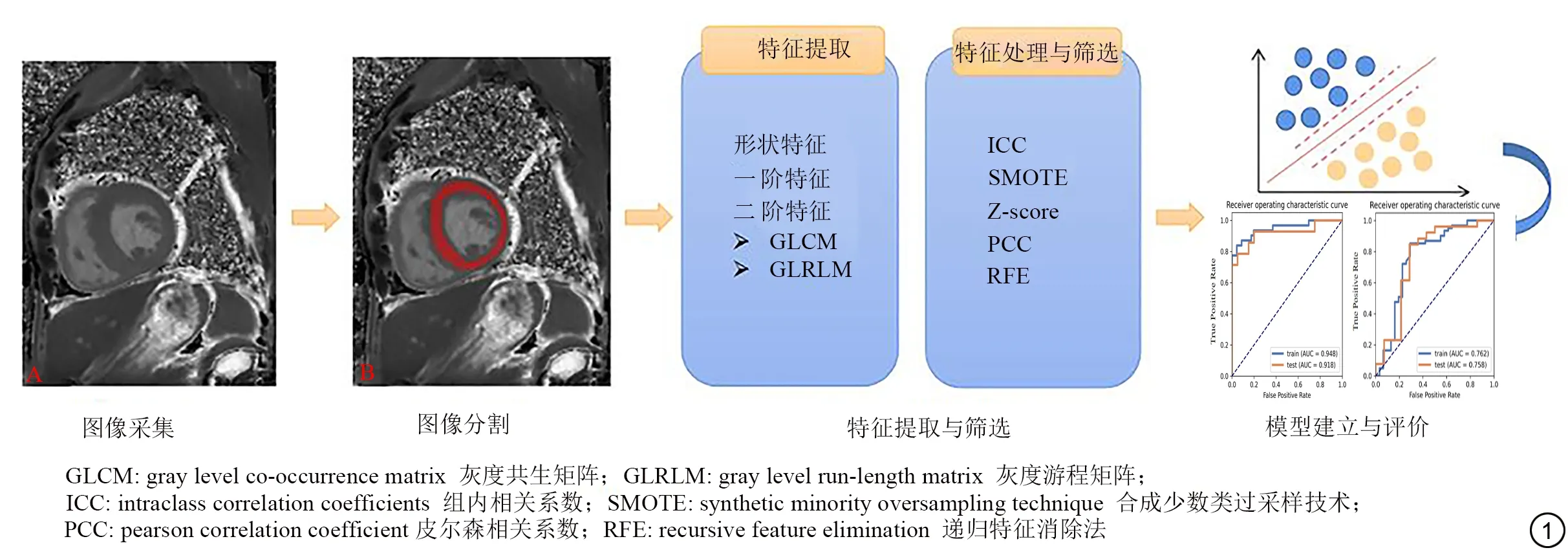
图1 影像组学流程图Fig.1 The workflow of radiomics in this study.
1.6 统计分析
采用SPSS 25.0 软件对临床资料和影像数据进行统计分析。采用Kolmogorov-Smirnov 检验对连续变量进行正态性检验,符合正态分布的连续变量以(±s)表示,组间比较采用独立样本t检验;不符合正态分布的连续变量使用中位数和四分位间距(P25-P75)表示,采用Mann-WhitneyU检验;两组间的分类变量比较采用成组设计χ2检验。
通过R 软件(Version:4.0.4)进行纹理特征的一致性检验,以及利用基于python (3.7.6)的FAE 软件对影像组学数据进行统计分析。根据约登指数得出敏感度、特异度、阳性预测值、阴性预测值和准确度,采用受试者操作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC)分别评价两个模型的分类效能,所有统计结果以P<0.05表示差异有统计学意义。
2 结果
2.1 一般资料
按照严格的纳入排除标准,排除5 例缺临床资料、12 例影像数据不完整、4 例合并其他心脏疾病、3 例接受过放射和药物治疗和15 例图像质量差的患者,最后纳入CA 患者132 例,其中无延迟强化组男22 例,女23 例,年龄58±10 岁;延迟强化组男52 例,女35 例,年龄57±11 岁。同时纳入健康对照组66例,男32例,女34例,年龄53±14岁。心肌无延迟强化的CA患者与健康对照组的性别、年龄、身体质量指数、舒张压、左室舒张末期容积指数、左室收缩末期容积指数及左右心室射血分数差异均无统计学意义(P>0.05);心肌无延迟强化的CA 患者的收缩压、右室舒张末期和收缩末期容积指数均低于健康对照组,差异有统计学意义(P<0.05),而左室心肌质量指数显著高于健康对照组(P<0.01)。
而在所有CA患者中,无延迟强化组的左、右心室收缩末期容积指数及左室心肌质量指数均低于延迟强化组,差异具有统计学意义(P<0.01);无延迟强化组的左、右心室射血分数均高于延迟强化组,差异具有统计学意义(P<0.01);而两组的性别、年龄、身体质量指数、收缩压、舒张压及左右心室舒张末期容积指数差异均无统计学意义(P>0.05)。所有受试者的临床及MRI参数的比较见表1。
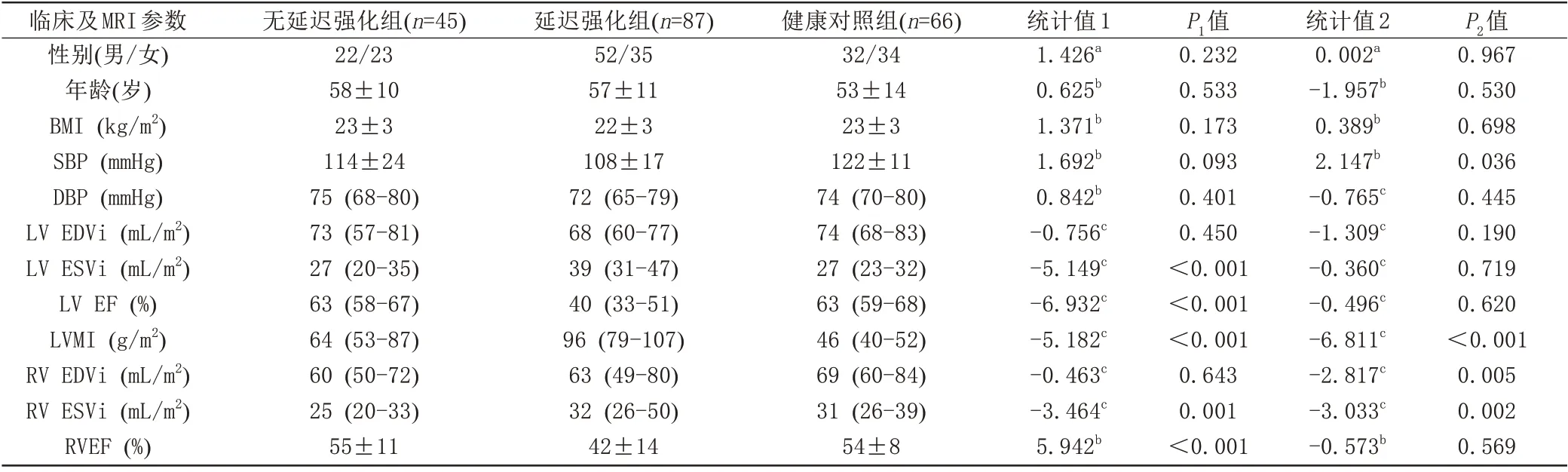
表1 所有受试者的临床及MRⅠ参数比较Tab.1 Comparion of clinical and MRⅠparameters among all subjects
2.2 特征筛选与模型建立结果
提取的特征包括形状特征、一阶特征、二阶特征(GLCM、GLRLM)共70个影像组学特征。
2.2.1 无延迟强化组与健康对照组
对两位医生提取的无延迟强化组与健康对照组的特征集经过一致性检验(ICC≥0.8)筛选出41 个特征。将数据按照7∶3 的比例随机分为训练集(77 例)和测试集(34 例),训练集经过SMOTE、Z-score标准化、PCC、RFE以及十折交叉验证,最后得出8个最优特征子集,形状特征有1个:MinorAxisLength;一阶特征有3个,分别为90Percentile、Maximum、Mean;GLCM特征有2 个,分别为Correlation、Imc1;GLRLM 特征有2 个,分别为RunLengthNonUniformityNormalized、RunPercentage;各特征及其相应系数如表2。通过选出的8个特征构建SVM模型A鉴别无延迟强化的淀粉样变心肌与健康心肌的差异。
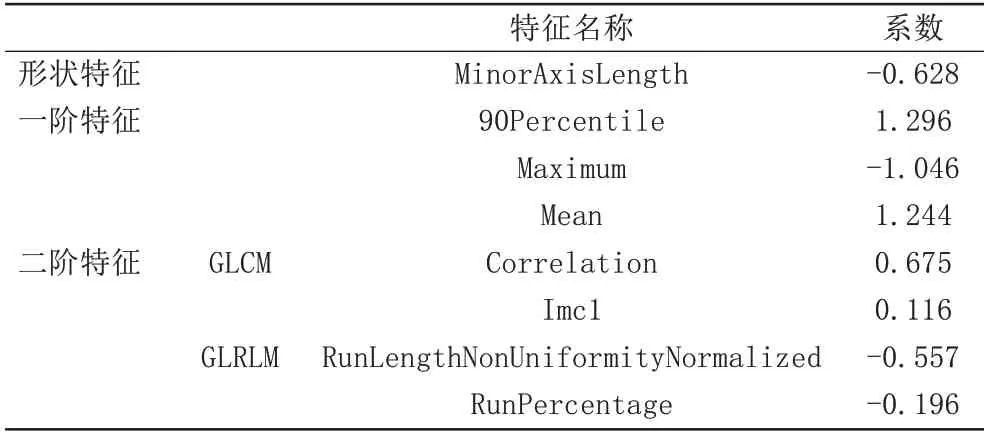
表2 SVM模型A最优特征子集及其系数Tab.2 Optimal feature subsets and its coefficients of the model of SVM A
2.2.2 无延迟强化组与延迟强化组
对两位医生提取的无延迟强化组与延迟强化组特征集经过一致性检验(ICC≥0.8)筛选出41 个特征,数据按照7∶3 的比例随机分为训练集(92 例)和测试集(40 例),训练集特征经过同样的降维方式,最后得出9 个最优特征子集,其中形状特征有2 个,分别为MajorAxisLength、SurfaceVolumeRatio;一阶特征有2 个,分别为Mean、Median;GLCM 特征有3 个,分别为Correlation、Id、InverseVariance;GLRLM 特征有2 个,分别为RunLengthNonUniformityNormalized、RunPercentage。各纹理特征及相应系数如表3。最后基于这9个特征子集及其对应的系数构建SVM模型B,预测CA患者心肌有无延迟强化。
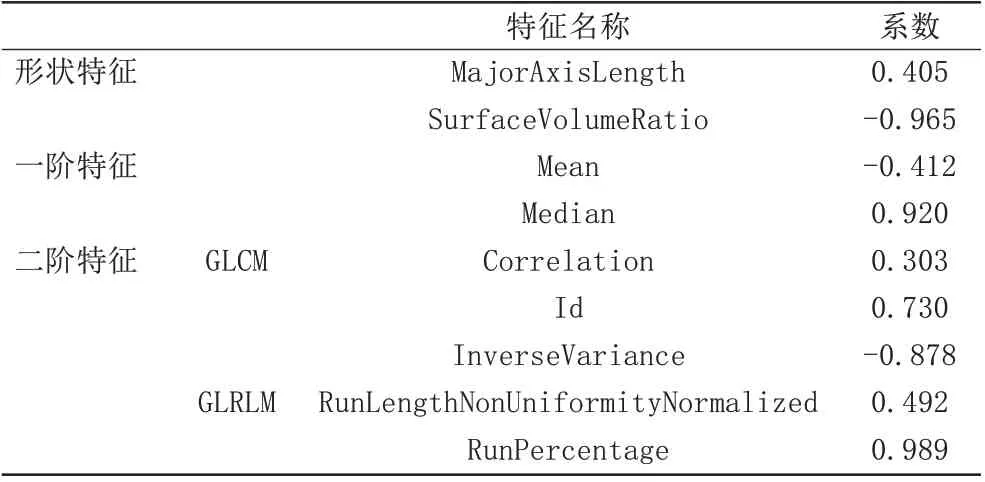
表3 SVM模型B最优子集及系数Tab.3 Optimal feature subsets and its coefficients of the model of SVM B
2.3 模型的诊断效能
鉴别无延迟强化组与健康对照组的SVM 模型A (图2A),其训练集与测试集的敏感度、特异度、阳性预测值、阴性预测值、准确度分别为:0.839、0.957、0.929、0.898、0.909 和0.786、0.950、0.917、0.864、0.882;训练集与测试集的AUC 分别为:0.948 (95%CI:0.890~0.991)、0.918 (95%CI:0.780~1.000)。鉴别CA 患者有无延迟强化的SVM 模型B (图2B),其训练集与测试集的敏感度、特异度、阳性预测值、阴性预测值及准确度分别为:0.853、0.710、0.853、0.710、0.804 和0.846、0.714、0.846、0.714、0.800;训练集与测试集的AUC 分别为:0.762 (95%CI:0.639~0.875)、0.758 (95%CI:0.565~0.937),两个SVM模型均表现出较好的鉴别能力。
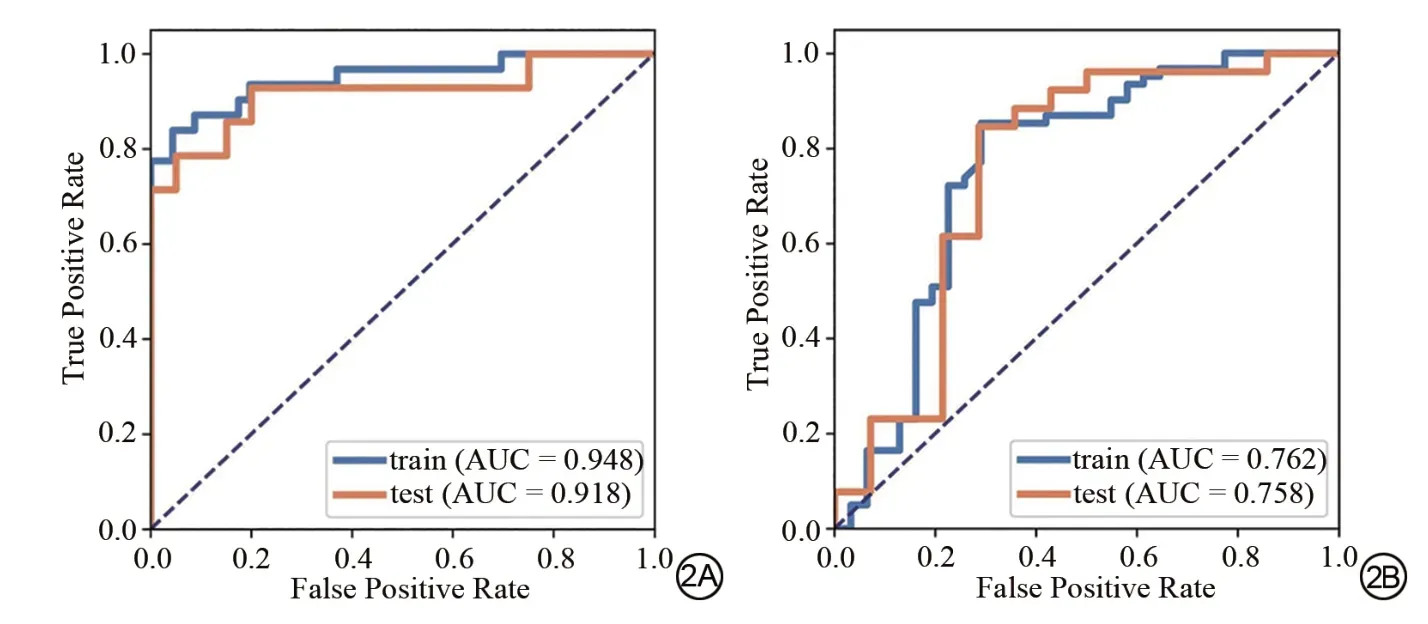
图2 鉴别无延迟强化的CA 患者心肌与健康心肌的SVM模型A训练集与测试集的ROC曲线图(图A);预测CA 患者心肌有无延迟强化的SVM模型B训练集与测试集的ROC曲线图(图B)Fig. 2 ROC curves of the training and test set of the model of SVM A, which differentiated the myocardium of patients with CA without LGE from healthy myocardium (A); ROC curves of the train and test set of SVM model B, which predicted the presence or absence of LGE in patients with CA(B).
3 讨论
本研究通过提取native T1 mapping 心肌纹理特征,经特征筛选后分别构建SVM模型鉴别无延迟强化淀粉样变心肌与健康心肌的差异及预测CA患者心肌有无延迟强化。本研究结果显示:构建的影像组学SVM 模型A 能够准确识别无延迟强化心肌,AUC 高达0.948;鉴别CA 患者心肌有无延迟强化的SVM 模型B 在训练集与测试集中均表现了良好的鉴别结果。这表明通过平扫MRI 纹理分析能够识别早期CA 肉眼不可见的病理改变,以及能对淀粉样变心肌有无延迟强化进行预测,其优势在于利用增强前序列联合新的医学图像分析技术,不仅减少患者对比剂的摄入和缩短扫描时间,也为早期评价CA 实现患者个性化精准诊疗提供新的途径。
3.1 MRI 纹理分析鉴别无延迟强化淀粉样变心肌和健康心肌的临床价值
本研究结果显示,心肌没有延迟强化的CA患者,左右心室射血分数与健康对照组差异也不具有统计学意义(P>0.05),但是通过纹理分析发现,CA患者虽然心肌无延迟强化,但纹理特征已发生改变,分析原因可能是早期CA 患者缺乏特异性表现,肉眼无法观察其发生的病理变化。早期的诊断困难有可能导致患者错失最佳治疗时机,发生心脏不可逆性损伤。纹理分析挖掘高通量数字化信息可以为早期识别CA提供有效参考,有利于患者早期诊疗和改善预后。同样,也有许多研究将未增强MRI纹理分析应用于识别其他心脏疾病,如Baessler等[8]发现梗死样急性心肌炎患者与健康对照有5 个纹理特征存在显著性差异,单独基于纹理特征T2 gray-level nonuniformity构建的诊断模型其AUC 为0.9;Shi 等[9]表明,基于native T1 mapping 的影像组学模型鉴别患者(肥厚型心肌病及高血压性心肌病)和健康志愿者心肌,其AUC 高达0.969;也有研究者[10]基于不使用对比剂的T1加权图像进行MRI纹理分析,区分无延迟强化的肥厚型心肌病与健康对照组的敏感度和特异度高达100%和90%。此外,Wu 等[12]曾基于native T1 mapping序列对健康志愿者的心肌纹理进行研究,发现心肌的纹理特征受年龄和性别两种生理因素的影响,本文考虑到年龄和性别会对结果造成偏倚,均选取年龄和性别相匹配的对照组进行研究,增加研究的准确性。
3.2 MRI 纹理分析预测CA 患者心肌有无延迟强化的临床价值
本研究利用native T1 mapping序列联合心肌纹理分析预测CA 患者心肌有无延迟强化,并得到了良好的预测表现。推测原因是当心肌细胞外间隙沉积不溶性纤维原蛋白,心肌发生异质性变化,纹理特征也发生相应改变,从而提供更多有用信息。有文献表明[6],心肌出现延迟强化的CA患者每年总死亡率明显高于无延迟强化的CA 患者,因此,尽早诊断CA 患者心肌有无延迟强化,价值重大。能够定量反映心肌组织特征的native T1 mapping序列,已被证明在CA 的诊断和预后评估中具有重要价值[13,14]。而纹理分析通过图像分割、特征提取、特征筛选和建立模型等挖掘人眼无法识别的高通量数字化特征,提供更丰富的信息增加诊断效能。传统常依据LGE 序列典型的心肌延迟强化表现来进行判断,而对伴有肾功能不全的患者受到一定限制,所以利用平扫MRI纹理分析来预测CA患者心肌有无延迟强化也扩大了适应人群范围,并降低患者对比剂摄入风险。
目前我们尚未检索到采用native T1 mapping图像的纹理特征来预测淀粉样变心肌有无延迟强化的研究,但在早期有研究者[15]发现二维超声的定量纹理分析对于CA 的诊断有潜在价值。而平扫MRI 纹理分析的应用价值在其他心脏病中已得到了初步探究和验证。如Neisius等[16]基于native T1 mapping图像结合纹理分析,通过构建SVM 模型,能够准确区分高血压性心脏病和肥厚型心肌病;Wang 等[17]同样基于native T1 mapping 心肌纹理分析区分MYH7 与MYBPC3 基因相关的肥厚型心肌病,其准确度高达92%;Baessler 等[18]发现结合T1 和T2 mapping 的纹理特征对急性和慢性心力衰竭样心肌炎也有较高预测价值;也有学者[19]基于cine-MRI 心肌纹理分析,预测肥厚型心肌病患者心肌有无延迟强化,以期减少心肌无延迟强化患者对比剂的摄入。此外,基于不使用对比剂的MRI 影像组学在预测ST 段抬高型心肌梗死患者的心肌损伤情况[20]、诊断亚急性和慢性心肌梗死[21]、评估慢性心肌梗死患者心肌活性[22]、预测takotsubo 综合征患者预后结果[23]中均显示有较高的应用价值。
3.3 本研究的局限性
第一,本研究为小样本、单中心和回顾性研究,尚需要增大样本量,设计多中心和前瞻性研究,提高模型的鲁棒性和泛化能力。第二,CA 虽然多为弥漫性病变,但ROI 只勾勒了native T1 mapping 短轴位的中间层,不能完全代表整个心肌的特征,有可能存在层面选择偏倚,下一步研究会考虑增加多层面分析,提供更全面信息。
综上所述,基于MRI的纹理分析可量化心肌组织特征,在不使用对比剂的情况下通过SVM模型能够鉴别无延迟强化的CA患者与健康志愿者心肌之间的异质性,也可预测淀粉样变心肌有无延迟强化,为临床早期评估CA及指导个性化治疗提供新的方案。
作者利益冲突声明:全部作者均声明无利益冲突。