产多元醇酵母对酱香型白酒发酵的强化应用
2021-03-05王晓丹白晓燕朱国军雷安亮班世栋邱树毅
王晓丹 ,白晓燕 ,朱国军,雷安亮,班世栋 ,邱树毅 *
1. 贵州大学贵州省发酵工程与生物制药重点实验室(贵阳 550025);2. 贵州大学酿酒与食品工程学院(贵阳 550025);3. 贵州珍酒酿酒有限公司(遵义 563000)
随着消费口味的变化,越来越多的白酒专家和学者提出淡化香型的概念。行业的关注点逐渐从重香型向香气及口味并重转变,因此对白酒中呈味物质的研究显得更加重要。甜味是一种让人比较愉悦的口感,尤其是在酒精度高的白酒中,适当的甜味能使酒体更显绵柔醇厚[1-2]。而白酒缺少醇甜的风格特征,一些生产企业为了改善白酒口感,降低成本获取经济利益,向其中违规添加甜味剂(糖精钠、甜蜜素、甜味素等)[3],有研究发现糖精钠、甜蜜素等一些人工甜味剂具有潜在致癌、致畸、损害肾功能的副作用,给消费者带来安全隐患[4]。为满足市场的这一需求,有必要对醇甜型酒进行研究。
多元醇是酒醅中的酵母菌在生成酒精的同时通过发酵还原糖生成的,由于糖不能进入白酒中,多元醇是形成白酒甜味的主要来源[5]。多元醇属于难挥发性醇类,但是用甑蒸馏酒醅时,有一小部分会随着水蒸气被带入酒中,形成白酒甜味和醇厚感的重要组成成分,且甜度随羟基数的增加而增加。白酒中的多元醇种类繁多,主要包括丙三醇、阿拉伯糖醇、核糖醇、赤藓糖醇、木糖醇、山梨醇、甘露醇、半乳糖醇、麦芽糖醇等[6]。对于白酒中多元醇的研究大都是白酒、酒醅或大曲中多元醇的检测分析。韩兴林等[7]采用离子色谱定量方法对清香型白酒大茬酒、二茬酒不同发酵阶段中多元醇的构成及含量进行分析,探讨提高清香型白酒中多元醇含量工艺方案。宋林林等[6]采用离子色谱方法测定枝江大曲中多元醇含量,对浓香型白酒酒体风味构成有更清晰的认识。孙洁等[5]用高效离子色谱方法-积分脉冲安培色谱分析方法测定芝麻香型白酒酒醅中多元醇,探讨芝麻香型白酒酒醅在发酵过程中多元醇的变化规律和生成机理。石亚林等[8]采用衍生化法-气相色谱方法对浓香型、清香型和酱香型大曲进行多元醇含量的测定,探究发酵中多元醇的变化机理。
对于白酒中产多元醇的菌株筛选和应用的研究较少,而将产多元醇的菌株应用到酱香型白酒生产过程中的研究报道更少。通过微生物的强化应用,将产多元醇功能菌株应用到酱香型白酒酿造过程中的还鲜见相关报道,这可能与酱香型白酒特殊的生产环境和独特的生产工艺相关。因此,如何将这类功能性菌株应用到酱香型白酒生产过程中有待进一步探索。
试验从酱香型白酒酿造过程大曲和酒醅中筛选得到的功能性菌株进行模拟窖池酒醅发酵,前期对酱香型大曲和酒醅中筛选出产多元醇种类和含量最多的2株酵母菌株——FBKL2.0130(Debaryomyces coudertii)和FBKL2.0310(Trichosporon coremiiforme)[8]。通过接入功能菌株的不同添加量考察菌株应用到酱香型酒醅中发酵后产多元醇的情况,初步探究功能性菌株在固态发酵的特定环境下是否能提高酒醅中多元醇的产量,为提高酱香型白酒的酒体质量奠定基础。
1 材料与方法
1.1 材料与试剂
菌株(从酱香大曲和酒醅筛选出的德巴利酵母FBKL2.0130和Trichosporon coremiiformeFBKL2.0310);酒醅(贵州省珍酒酿酒有限公司的下沙堆积后酒醅);麸曲、糖化酶(贵州省珍酒酿酒有限公司)。
所用试剂均为分析纯。
1.2 仪器与设备
THZ-92B台式恒温振荡器(上海浦东物理光学仪器厂);DHG-9123A电热恒温鼓风恒温干燥箱(天津市泰斯特仪器有限公司);FA1004电子天平(上海箐海仪器有限公司);YXQ-LS-75G立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂);JJCJ-IFD超净工作台(苏州市金净净化设备科技有限公司);57330-U密理博超纯水仪Milli-Q Academic(密理博(上海)贸易有限公司);Agilent 1260高效液相色谱仪、Agilent G4260B蒸发光检测器、SPE C18固相萃取小柱(200 mg,3 mL)、Agilent Hi-plexCa液相色谱柱(7.7 mm×300 mm,8 μm)(安捷伦科技(中国)有限公司)。
1.3 试验方法
1.3.1 丢糟续粮入池发酵
在无菌条件下,从保藏的FBKL2.0130(德巴利酵母)和FBKL2.0310(Trichosporon coremiiforme)的斜面中将2株菌株接种到YEPD培养基上活化,置于28 ℃培养箱中倒置培养48 h,分别挑取单菌落接种到50 mL种子培养基的三角瓶中,28 ℃摇床培养24 h后得到107~108CFU/mL的2株酵母菌悬液,备用[10]。
应用试验方法参考胡宝东[11]方法,粹沙窖池开窖取酒后,按照粹沙工艺加入一定量新粮、糖化酶和麸曲,搅拌均匀,将制备好的功能酵母菌悬液分别按2%,4%,6%,8%,10%和12%的接种比例分别接种到1 kg酒醅中。接种混匀完成后密封放入培养箱,以0.5 ℃/d从28 ℃升温至38 ℃静置培养。空白组为接入不含功能性菌株的液体培养液,培养方法相同。发酵1个月后,对酒醅中微生物计数,并对理化指标和多元醇含量进行测定。
1.3.2 酒醅中微生物计数
酒醅中微生物计数参照文献[12]测定方法。
1.3.3 酒醅理化指标的测定
酒醅水分和酸度测定参照QB/T 4257—2011《酿酒大曲通用分析方法》[13],还原糖测定方法参照GB/T 5009.7—2016《食品中还原糖的测定》[14],淀粉测定方法参照GB/T 5009.9—2016《食品中淀粉的测定》[15]。
1.3.4 酒醅中多元醇的测定
酒醅中多元醇含量的测定参照白小燕等[9]试验方法,采用HPLC-ELSD法对酒醅中的多元醇进行含量测定。
样品处理:取50 g酒醅,研磨充分后,加入50 mL超纯水置于摇床振荡30 min,取出用滤纸过滤,吸取上清液,以6 000 r/min离心10 min,然后用旋转蒸发仪浓缩2倍,用C18固相萃取柱过滤,弃去最初约1 mL的滤液,收集其他滤液,用0.22 μm的水系膜过滤,直接进样分析。
液相条件:Agilent Hi-plex Ca柱(300 mm×7.7mm),柱温80 ℃,进样量4 μL,流动相采用纯水,雾化温度60 ℃,蒸发温度60 ℃,增益2,流速0.5 mL/min,氮气流速1.6 SLM。用多元醇标准品的保留时间和加标定性同时对发酵液中多元醇进行定性,用外标峰面积进行定量分析。
2 结果与分析
2.1 接种量对酒醅中微生物数量的影响
对发酵前和不同接种量的发酵后的酒醅进行微生物计数,结果如表1所示。结果表明,添加不同接种量的FBKL2.0130菌悬液和FBKL2.0310菌悬液发酵后,与发酵前相比,各不同接种量的酒醅中微生物数量总体变化一致,细菌和酵母数量均显著下降;细菌数量维持在102g-1左右,大多数试验组发酵后酒醅中酵母数量在103g-1左右,这可能是由于试验所用原料是下沙阶段的酒醅,酒醅中高粱大多呈整粒或粉碎不细,微生物很难利用,导致微生物代谢原料不足数量逐渐减少。此外,添加2株功能性菌株的酒醅中均未检测到霉菌。
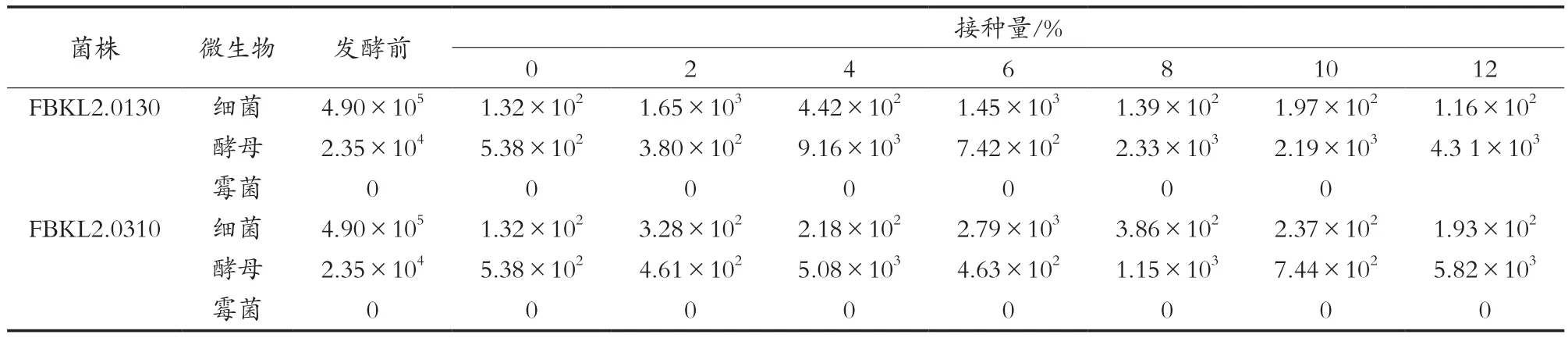
表1 不同接种比例试验组微生物计数结果 单位:CFU/g
2.2 酒醅理化指标的测定
对发酵前和不同接种量的发酵后酒醅的理化指标进行测定,水分试验结果如图1(A)所示。随着接种量增加,酒醅中水分呈上升趋势,这可能是由于通过种子液添加功能性菌株的方式所导致,由于在接入种子液时带入水分,随着接种量增加,带入水分增多。酸度试验结果如图1(B)所示,添加FBKL2.0130、FBKL2.0310菌悬液的酒醅经发酵后,未添加功能性菌株菌悬液的空白组发酵后酸度最高,试验组酒醅的酸度均比发酵前高,但均低于未添加功能性菌株的空白组,且酸度没有明显变化趋势,酸度的形成主要来源于生酸微生物进行的有机酸代谢,以及脂肪、淀粉和蛋白质的降解[16]。
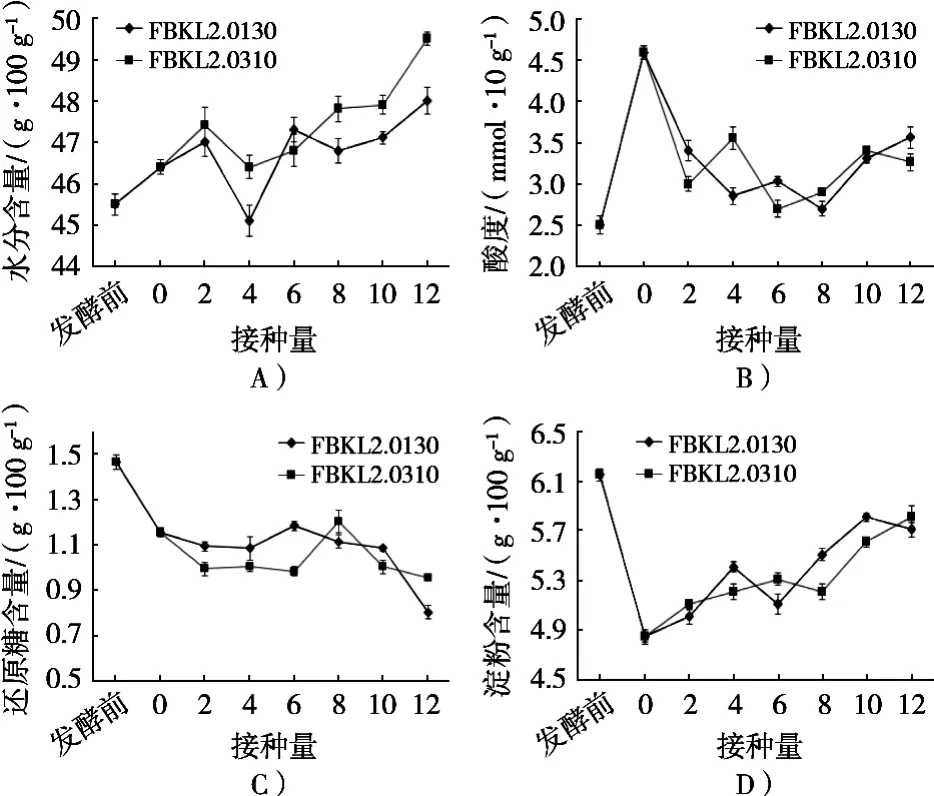
图1 酒醅中理化指标的测定
酒醅中还原糖和淀粉含量试验结果如图1(C)和图1(D)所示。随着接种量增加,酒醅中微生物数量增多(表1),酒醅中还原糖含量呈降低趋势,酒醅中酵母菌加快对还原糖的利用;接种酵母发酵后,酒醅中淀粉降解速度减缓,可能接入的酵母过多调解酒醅中降解淀粉的细菌结构。窖池发酵过程中乳酸菌可达80%以上[17-18],乳酸菌主要产生乳酸,降低窖池酸度,抑制其他微生物生长[19]。接入功能酵母发酵后,酸度降低25%~42%,说明产乳酸的乳酸菌生物量降低,而且淀粉降解速度降低,乳酸菌可利用淀粉、脂肪和蛋白代谢[20]。
2.3 酒醅中多元醇的测定
采用高效液相色谱-蒸发光散射检测法对发酵前酒醅和添加不同接种量功能性菌株的发酵后酒醅进行分析,检测酒醅中多元醇的含量。
对发酵前和不同接种量的发酵后酒醅中多元醇含量进行测定,如表2和表3所示。发酵前酒醅中多元醇含量较低,D-阿拉伯糖醇和山梨醇总量为1.183 mg/g,发酵后无论是空白组还是试验组,多元醇总量都有所增加,但增加的量很小。
从表2中看出,试验组D-阿拉伯糖醇的含量普遍高于空白组,说明加入产D-阿拉伯糖醇的功能性菌株FBKL2.0130能使酒醅中D-阿拉伯糖醇的产量提高;试验组山梨醇的含量与空白组相比几乎没有变化,这可能是由于加入的菌株不产山梨醇。比较试验组功能性菌株的不同接种量发现,多元醇含量与添加量没有一定的线性关系,不是随着添加量的增大多元醇含量就增大,接种量不同,含量变化不大,接种量10%时,多元醇总量最高,为1.418 mg/g。
从表3中看出,试验组D-阿拉伯糖醇和山梨醇含量均普遍高于空白组,说明加入功能性菌株后,D-阿拉伯糖醇和山梨醇的产量都有所提高,这可能与FBKL2.0310本身具有产这两种物质的能力有关。比较试验组功能性菌株的不同接种量发现,多元醇含量随着添加量增加大致呈上升趋势,但增加幅度不大,接种量12%时,多元醇总量最高,为1.461 mg/g。前期研究报道[9],FBKL2.0310菌株液态发酵可以代谢产生木糖醇,但是在试验组酒醅中并未检测到木糖醇的存在,说明固态发酵和液态发酵具有差异性,液态发酵下生长好的菌株在固态发酵条件下,由于还原糖含量较少以及微生物之间的相互作用,使得酵母的生长代谢受到影响,不能产生与单纯的液态发酵一样的产物。
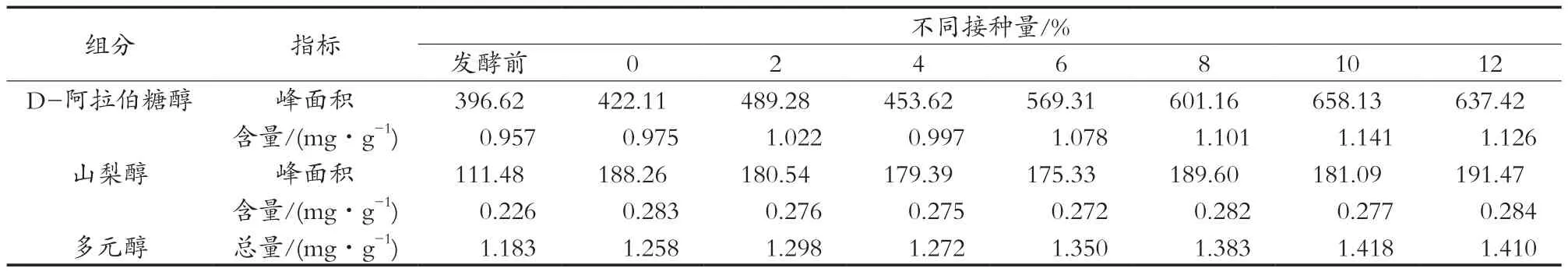
表2 FBKL2.0130酒醅中多元醇含量测定结果
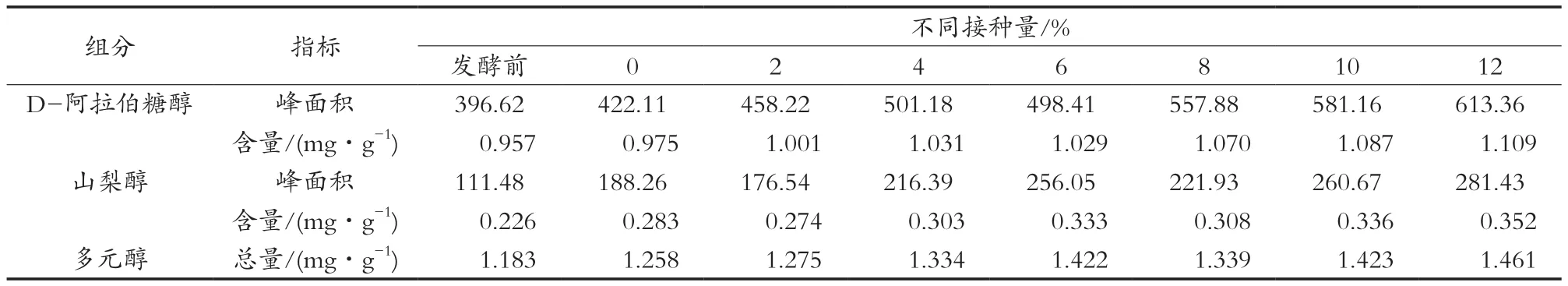
表3 FBKL2.0310酒醅中多元醇含量测定结果
3 结论
从酱香型白酒酿造过程大曲和酒醅中筛选出的2株产多元醇较好的酵母菌株FBKL2.0130(Debaryomyces coudertii)和FBKL2.0310(Trichosporon coremiiforme)添加到酒醅中进行模拟窖池发酵研究,考察发酵前、不同接种量酵母菌悬液后酒醅的微生物数量、理化指标及多元醇含量。发酵后酒醅中细菌数量在102CFU/g;酵母数量大都在103CFU/g;并未检测到霉菌的存在。随着接种量增加,酒醅中水分呈现上升趋势,这与添加菌株时带入的水分有关;酸度并没有明显变化趋势,试验组酸度均低于空白组;酵母加快对还原糖的利用,还原糖含量逐渐降低;酵母接种量加大一定程度上抑制细菌生长,原料利用率降低,导致淀粉含量相对较多。
采用HPLC-ELSD法对酒醅中多元醇含量进行分析发现,添加功能性菌株FBKL2.0130和FBKL2.0310均能使酒醅中多元醇含量增加。考察接种量对功能菌株产多元醇的影响,随着接种量增加,多元醇含量呈现上升趋势,但是并没有精准的线性关系。菌株FBKL2.0130接种量10%时,多元醇总量最高,为1.418 mg/g;菌株FBKL2.0130接种量12%时,多元醇总量最高,为1.461 mg/g。
