阻塞性睡眠呼吸暂停低通气综合征相关肺动脉高压与血清炎性因子水平的相关性
2021-03-05尹雪霞周祥武陈晓毅
尹雪霞,周祥武,陈晓毅
(南方医科大学南方医院白云分院综合内科,广东广州 510420)
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome ,OSAHS)指的是患者在睡眠状态下出现反复上气道塌陷阻塞、间歇低氧血症、睡眠紊乱等为主要特征的睡眠呼吸障碍性疾病。有临床研究资料显示,OSAHS 属于多种全身疾病的独立危险因素与源头性疾病,是心脑血管疾病的独立危险因子[1]。对于OSAHS 患者来讲,由于其机体长期处于反复慢性间歇性缺氧状态中,可引起肺动脉高压(pulmonary arterial hypertension, PAH)的发生,增加患者的死亡风险[2]。相关临床研究指出,OSAHS患者机体内有系统性的炎症存在,且炎症反应与PAH的发生、发展存在密切的关系[3]。基于此,本研究旨在探讨OSAHS 相关PAH 与血清炎性因子水平的相关性,现将研究结果报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2018 年11 月至2021 年3 月南方医科大学南方医院白云分院收治的88 例OSAHS 患者的临床资料,将其作为A 组,另回顾性分析88 例OSAHS 相关PAH 患者的临床资料,将其作为B 组,并回顾性分析同期健康体检的88 例健康体检者的临床资料,将其作为健康对照组。A 组患者中男性49 例,女性39 例;年龄42~76 岁,平均(55.93±2.64)岁;病程5 个月 ~ 2 年,平均(1.29±0.26)年;体质量指数(BMI)23~36 kg/m2,平均(29.26±1.18)kg/m2。B组患者中男性47 例,女性41 例;年龄41~78 岁,平均(56.47±2.85)岁;病程4 个月 ~ 2 年,平均(1.27±0.28)年;BMI 21~35 kg/m2,平均(28.37±1.25)kg/m2。健康对照组研究对象中男性42 例,女性46 例;年龄40~81岁,平均(57.42±2.57)岁;BMI 22~25 kg/m2,平均(22.94±0.57)kg/m2。诊断标准:A、B 组患者均参照《阻塞性睡眠呼吸暂停低通气综合征治疗指南(2011 修订版)》[4]中的相关诊断标准。纳入标准:纳入患者均符合上述诊断标准者,B 组患者同时符合《肺动脉高压筛查诊断与治疗专家共识》[5]中的相关诊断标准,且经心脏彩色超声多普勒超声检查估测显示肺动脉收缩压≥ 40 mmHg(1 mmHg = 0.133 kPa)者;近6 个月未服用过影响免疫反应药物者。排除标准:合并感性疾病、风湿性免疫疾病者;合并心、肝、肾等重要脏器严重障碍者;由慢性肺部疾病、风湿结缔组织等疾病引起的相关PAH 者等。研究经南方医科大学南方医院白云分院医学伦理委员会审核批准。
1.2 检测方法 抽取3 组研究对象清晨空腹状态下肘静脉血液5 mL,采用乙二胺四乙酸(EDTA)抗凝后进行离心处理,离心机转速设置为3 000 r/min,时间10 min,然后提取分离处理后的上层血清,再放置于 -80℃冰箱保存,采用酶联免疫吸附实验法检测肿瘤坏死因子 -α(TNF-α)、白细胞介素 -6(IL-6)、C- 反应蛋白(CRP)水平。
1.3 观察指标 ①对比3 组研究对象血清TNF-α、IL-6、CRP、肺动脉收缩压水平。②比较血清TNF-α、IL-6、CRP 单项及联合检测对OSAHS 相关PAH 的诊断价值,采用受试者工作特征(ROC)曲线分析血清TNF-α、IL-6、CRP 单项及联合检测对OSAHS 相关PAH 的诊断效能。③分析肺动脉收缩压与血清TNF-α、IL-6、CRP 水平的相关性,采用Pearson相关系数法进行分析。
1.4 统计学分析 采用SPSS 22.0 统计软件处理数据,计量资料以(±s)表示,两组间比较采用t检验,多组间比较采用重复测量方差分析;相关性采用Pearson相关系数法进行分析;采用ROC曲线分析TNF-α、IL-6、CRP 单项与联合检测对OSAHS 合并PAH 的诊断效能。以P<0.05 表示差异有统计学意义。
2 结果
2.1 血清TNF-α、IL-6、CRP 及肺动脉收缩压水平 B 组患者血清TNF-α、IL-6、CRP 水平及肺动脉收缩压均高于A 组、健康对照组,且A 组均高于健康对照组,差异均有统计学意义(均P<0.05),见表1。
表1 3 组研究对象血清TNF-α、IL-6、CRP 及肺动脉收缩压水平比较(±s)
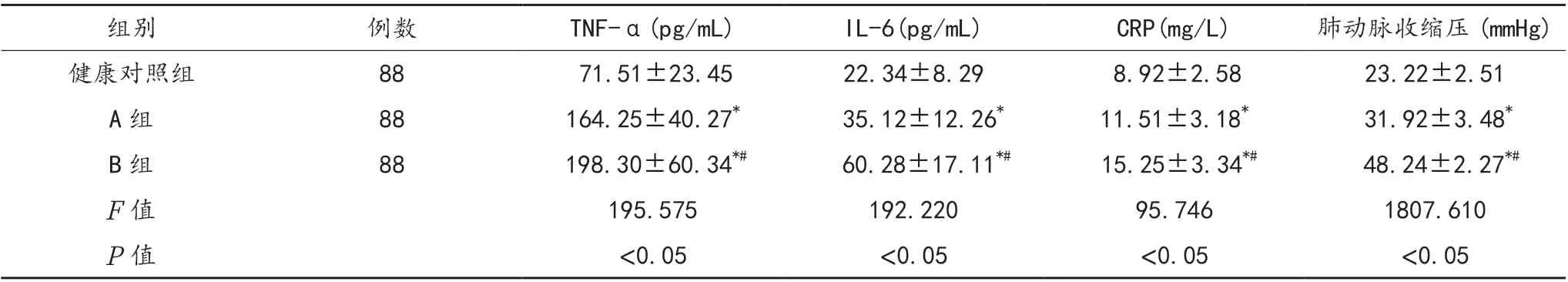
表1 3 组研究对象血清TNF-α、IL-6、CRP 及肺动脉收缩压水平比较(±s)
注:与健康对照组比,*P<0.05;与A 组比,#P<0.05。TNF-α:肿瘤坏死因子 -α;IL-6:白细胞介素 -6;CRP:C- 反应蛋白。1 mmHg =0.133 kPa
组别例数TNF-α(pg/mL)IL-6(pg/mL)CRP(mg/L)肺动脉收缩压(mmHg)健康对照组88 71.51±23.4522.34±8.29 8.92±2.5823.22±2.51 A 组88164.25±40.27* 35.12±12.26*11.51±3.18* 31.92±3.48*B 组88 198.30±60.34*# 60.28±17.11*# 15.25±3.34*# 48.24±2.27*#F 值195.575192.22095.7461807.610 P 值<0.05<0.05<0.05<0.05
2.2 血清TNF-α、IL-6、CRP 单项及联合检测的诊断价值 血清TNF-α、IL-6、CRP 水平联合检测诊断OSAHS 相关PAH 的灵敏度、特异度均高于单项检测,差异均有统计学意义(均P<0.05),见表2。

表2 血清TNF-α、IL-6、CRP 单项及联合检测对OSAHS 相关PAH 的诊断价值
2.3 相关性 肺动脉收缩压与血清TNF-α、IL-6、CRP水平均呈正相关,差异均有统计学意义(r= 0.753、0.759、0.752,均P<0.05),见表3。
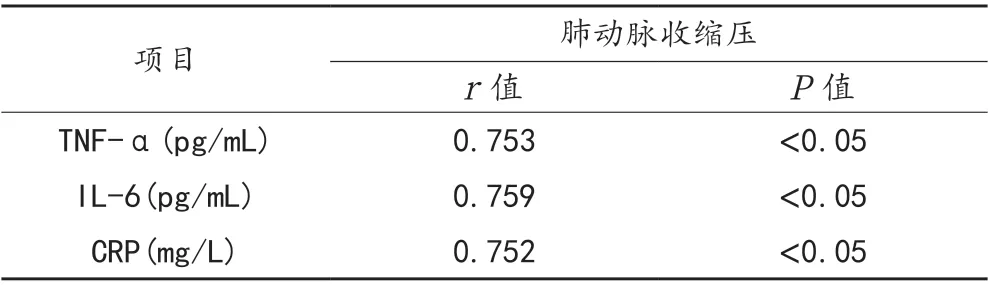
表3 肺动脉收缩压与血清TNF-α、IL-6、CRP 水平的相关性
3 讨论
OSAHS 属于呼吸系统常见病,该疾病的发展过程患者出现间歇性低氧血症可引发患者睡眠结构异常,进而导致心血管系统和内分泌系统并发症的发生。临床研究显示,间歇性低氧血是导致OSAHS 靶器损伤的主要原因,且血管舒缩物质失衡可引发缺氧性肺血管收缩,最终导致PAH 的形成[6]。
当OSAHS 患者出现间歇性缺氧时,其机体内相关核因子-кB(NF-κB)则会被激活,从而会使患者体内血清TNF-α、IL-6、CRP 水平上升,进而损害患者靶器官[7]。本研究中,B 组患者血清TNF-α、IL-6、CRP、肺动脉收缩压水平均高于A 组、健康对照组,且A 组均高于健康对照组,其原因在于,OSAHS 患者出现低氧血症可使中性粒细胞下降,并在肺内激活,引发血清IL-6大量释放,因此血清IL-6 与PAH 的发生密切相关[8];血清TNF-α 与OSAHS 患者的血管损伤密切相关,当TNF-α 水平升高后可刺激患者的机体产生大量的活性氧,从而导致患者血管内皮受损,且还会在一定程度上抑制血管舒张前列环素2 的信使核糖核酸(mRNA)表达,进而加强肺血管收缩,最终导致患者肺动脉压升高[9];血清CRP 属于一种急性反应蛋白,当机体处于炎症刺激状态下或是受到损伤后,CRP 含量则会升高,从而使升高的肺动脉收缩压持续难降,与PAH 的发生存在的一定的关系[10]。
临床研究显示,CRP 属于一种全身炎性反应的敏感指标,可作为PAH 的独立预测因素,但其可受到多种因素的干扰,单独诊断OSAHS 相关PAH 缺乏一定的准确性;TNF-α、IL-6 可有效调节肺循环,其在PAH 的发病机制中起重要作用;IL-6 水平的升高可增加PAH的发生风险[11]。本研究中,血清TNF-α、IL-6、CRP 水平联合检测诊断OSAHS 相关PAH 的灵敏度、特异度均高于单项检测,提示TNF-α、IL-6、CRP 对OSAHS相关PAH 诊断具有一定的临床价值,且三者联合检测诊断价值更高。同时,本研究中,肺动脉收缩压与血清TNF-α、IL-6、CRP 均呈正相关,推测血清炎性因子参与了疾病的发生、发展,其原因在于,肺动脉收缩压水平的升高,可使血管内皮受损,炎性细胞黏附并进入受损细胞,促进TNF-α、IL-6 的产生,这两种炎性因子有助于促进肝脏合成并释放CRP,CRP 可直接调节血管内皮细胞,使一氧化氮合成酶的表达和生物学活性降低,同时可减少内皮素-1 的释放,导致血管重塑和血管顺应性降低[12]。
综上,OSAHS 相关PAH 患者血清TNF-α、IL-6、CRP 水平均显著升高,且肺动脉收缩压与血清TNF-α、IL-6、CRP 均呈正相关,血清炎症因子可能参与了疾病的形成、发展,联合诊断可显著提高对OSAHS 相关PAH 诊断的灵敏度与特异度,提高诊断准确性,值得临床进一步研究和推广应用。
