血管内介入栓塞术与显微外科夹闭术对大脑中动脉动脉瘤破裂患者的效果观察
2021-03-05贾贞伟
贾贞伟
(新泰市第二人民医院神经外科,山东泰安 271219)
大脑中动脉动脉瘤指在脑动脉上形成的异常凸起,是引起蛛网膜下腔出血的常见原因,以先天性动脉瘤居多。动脉瘤破裂会出现蛛网膜下腔出血、脑内血肿、脑室内血肿等,严重者会威胁患者生命安全。显微外科夹闭手术主要通过将动脉瘤夹闭并将其置于血液循环外,可以直观地观察到患者病变的血管,从而进行夹闭的手术操作,但其对于患者而言创伤较大,且患者术后恢复时间较长,影响预后效果[1]。血管内介入栓塞术通过导管将弹簧圈放置于患者的脑动脉瘤腔中,并通过较为细密的填塞,从血液循环中剥离动脉瘤,其创伤小,有利于减轻患者脑部损伤[2]。本研究主要探讨血管内介入栓塞术与显微外科夹闭术对大脑中动脉动脉瘤破裂患者脑脊液内皮素 -1(ET-1)、白细胞介素 -6(IL-6)、中枢神经特异性蛋白(S100β)水平的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2019 年2 月至2021 年2 月新泰市第二人民医院收治的60 例大脑中动脉动脉瘤破裂患者,根据随机数字表法分为两组。对照组(30例)患者中男性18 例,女性12 例;年龄40~60 岁,平均(48.68±4.18)岁;动脉瘤直径9~20 mm,平均(15.12±3.67)mm。观察组(30 例)患者中男性16例,女性14 例;年龄39~61 岁,平均(48.51±4.23)岁;动脉瘤直径10~20 mm,平均(15.04±3.51)mm。对两组患者一般资料进行对比,差异无统计学意义(P>0.05),组间可进行对比分析。诊断标准:符合《心脑血管病防治指南》[3]中的相关诊断标准。纳入标准:符合上述相关诊断标准,且经CT 检查确诊者;单发大脑中动脉瘤者;动脉瘤破裂出血者等。排除标准:自身免疫系统或血液系统疾病者;合并其他位置肿瘤者;存在血管内介入和显微外科手术夹闭的禁忌证者;伴有大量出血者等。入选的患者及家属均已签署知情同意书,且院内医学伦理委员会已审核并批准本研究。
1.2 手术方法 对照组患者进行显微外科夹闭手术:常规术前准备,消毒、铺巾。患者取仰卧位,全身麻醉,采用头架固定头部,翼点入路开颅,钝性分离皮瓣,于颞上线和冠状缝交界处上方钻骨孔,铣刀铣去2/3 蝶骨嵴,暴露颅底,脑膜固定,用弧形剪剪开硬脑膜,视情况缓慢降低颅内压。在显微镜下行手术治疗,找到大脑中动脉(沿颈内动脉向上的方向),若发现瘤体,操作轻柔将瘤颈分离暴露,再根据瘤颈大小用合适的动脉瘤夹,选择合适的临时阻断夹将供血动脉阻断,在适合的位置完全夹闭。松开临时阻断夹检查载瘤动脉是否通畅,若无出血,则缝合硬脑膜,如果术后患者脑组织明显肿胀,为降低颅内压则不予复位骨瓣,若无异常则给予复位并固定骨瓣。完全止血后,分层缝合,并用无菌敷料覆盖。观察组患者进行血管内介入栓塞术:常规术前准备,术前4 h 口服对应的镇静药物,采用全身静脉麻醉,术中予以1.25 g/h 肝素钠行全身肝素化,采用Seldinger 技术穿刺股动脉,置入7.5 F 鞘导管,引入合适的Tracker 导管,行全脑血管造影,充分了解动脉瘤的基本信息。根据动脉瘤大小,选用适中型号大小的弹簧圈,并将其送到动脉瘤瘤腔内。血管造影证实动脉瘤瘤腔完全被闭塞后,将导管拔出,对穿刺部位加压包扎,术后用鱼精蛋白中和肝素。两组患者术后均随访6 个月。
1.3 观察指标 ①比较两组患者手术时间、术后住院时间及术中出血量等手术相关指标。②脑脊液IL-6、ET-1、S100β 水平。术前、术后7 d 通过侧脑室穿刺收集两组患者脑脊液约3 mL,采用双抗体夹心酶联免疫吸附法检测脑脊液IL-6、ET-1、S100β 水平。③预后改善情况。术后6 个月对两组患者预后情况进行对比:包括恢复良好(以血管与动脉瘤完全分离为恢复良好)、残留稳定(以残留动脉瘤未出现破裂情况为残留稳定)、复发情况(以再次发生动脉瘤破裂为复发)[3]。
1.4 统计学分析 使用SPSS 26.0 统计软件分析数据,计量资料(手术相关指标、脑脊液IL-6、ET-1、S100β 水平)以(±s)表示,行t检验,计数资料(恢复良好率、残留稳定率及复发率)以[ 例(%)]表示,行χ2检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 手术相关指标 与对照组比,观察组患者术后住院时间、手术时间均缩短,术中出血量减少,差异均有统计学意义(均P<0.05),见表1。
表1 两组患者手术相关指标比较(±s)

表1 两组患者手术相关指标比较(±s)
组别例数手术时间(min)术后住院时间(d)术中出血量(mL)对照组30192.73±18.1626.13±2.87251.68±18.35观察组30110.65±15.4320.36±2.16100.06±10.87 t 值18.8668.79838.938 P 值<0.05<0.05<0.05
2.2 脑脊液IL-6、ET-1、S100β水平 与术前比,术后7 d两组患者脑脊液IL-6、ET-1、S100β 水平均降低,且观察组低于对照组,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者脑脊液IL-6、ET-1、S100β 水平比较(±s)
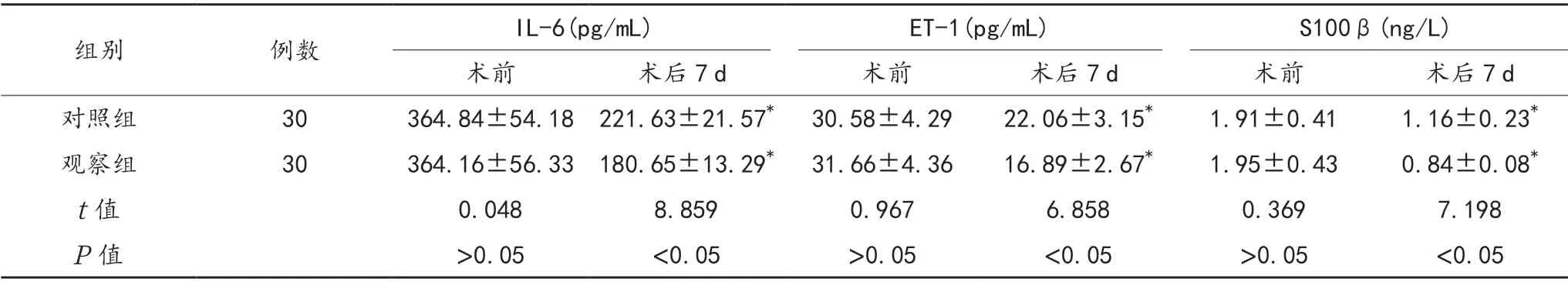
表2 两组患者脑脊液IL-6、ET-1、S100β 水平比较(±s)
注:与术前比,*P<0.05。IL-6:白细胞介素-6;ET-1:内皮素-1;S100β:中枢神经特异性蛋白。
组别例数IL-6(pg/mL)ET-1(pg/mL)S100β(ng/L)术前术后7 d术前术后7 d术前术后7 d对照组30364.84±54.18 221.63±21.57* 30.58±4.2922.06±3.15*1.91±0.411.16±0.23*观察组30364.16±56.33 180.65±13.29* 31.66±4.3616.89±2.67*1.95±0.430.84±0.08*t 值0.0488.8590.9676.8580.3697.198 P 值>0.05<0.05>0.05<0.05>0.05<0.05
2.3 预后情况 术后6 个月,观察组患者恢复良好率与复发率均高于对照组,残留稳定率低于对照组,差异均有统计学意义(均P<0.05),见表3。
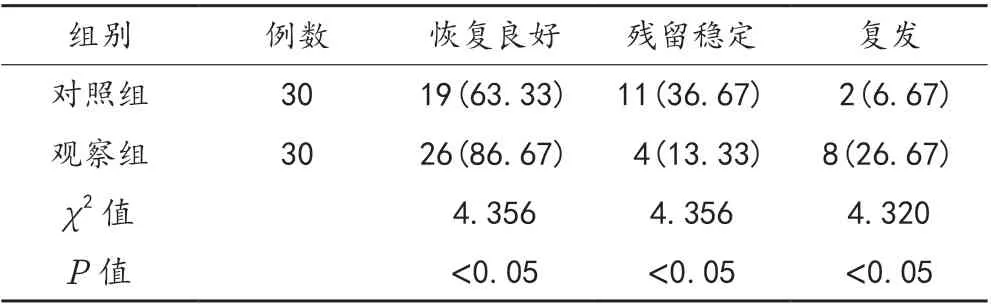
表3 两组患者预后情况比较[ 例(%)]
3 讨论
脑动脉瘤是脑动脉血管壁向外出现的膨隆,受血流冲击、情绪激动、劳累等诱因的影响,可以出现突发的破裂,引起自发性蛛网膜下腔出血。显微外科夹闭手术是现今临床上常用于治疗大脑中动脉瘤破裂的手段,可通过直观的方式将患者的动脉瘤剥离,但其操作步骤较为复杂,且对患者造成的创伤较大[4]。
血管内介入栓塞术是指通过介入技术来对血管进行栓塞治疗的手段,通过穿刺针、导丝及导管等器械,在医学影像设备的帮助下进行的治疗和诊断操作[5]。介入栓塞术是一种将动脉瘤与血流分开的手术方法,其原理是使用一种材料经血管进入动脉瘤内,将动脉瘤填充,用填塞的材料作为防止血流进入脑动脉瘤的屏障[6-7]。介入栓塞术对患者创伤较小,可缩短手术时间;血管内介入栓塞术对正常脑组织不会造成挤压,对载瘤动脉的刺激较小,对脑血管的痉挛反应影响较小,有利于患者术后预后的恢复[8-9]。但由于血管内介入栓塞术术中缺少对患者动脉瘤的夹闭,不利于改善颅脑内环境,易引发患者术后病情复发[10]。本研究中,观察组患者术后住院时间、手术时间与对照组比较均缩短,术中出血量与对照组比较均减少,术后6 个月,观察组患者恢复良好率与复发率均高于对照组,残留稳定率低于对照组,提示血管内介入栓塞术与显微外科夹闭手术均为治疗大脑中动脉动脉瘤破裂的有效术式,而血管内介入栓塞术可更有效缩短患者手术时间、住院时间,且创伤较小,利于术后恢复,但术后复发率较高。
S100β 是S100 蛋白家族中的一员,其为脑特异性蛋白,水平越高提示患者脑损伤越严重;IL-6 能促进ET-1 的释放,引起内皮细胞活化,且可增加内皮细胞氧化损伤的程度,同时加重炎症反应程度[11]。血管内介入栓塞术主要是通过对患者的股动脉进行穿刺治疗,对动脉瘤囊内或瘤颈部位进行放置一个纤细的微导管,通过微导管将钛合金弹簧圈放置于动脉瘤囊内,帮助填满动脉瘤囊从而达到止血的效果[12]。血管内介入栓塞术可降低因对患者进行开颅而致的过度损伤,属于微创手术方式,且不会对患者的脑实质造成极为严重的伤害,同时对于病变周围的组织伤害相对较小,相对能够减轻患者的炎症反应[13-14]。本研究结果显示,术后7 d 观察组患者的脑脊液IL-6、ET-1、S100β 水平均低于对照组,提示血管内介入栓塞术治疗大脑中动脉动脉瘤破裂,患者恢复情况较为显著,且对其脑损伤程度的影响较小。
综上,两种手术治疗大脑中动脉动脉瘤破裂患者,其治疗效果相当,但血管内介入栓塞术有利于缩短手术时间与术后住院时间,同时术中出血量较少,且创伤较小,利于术后恢复,但复发率较高。因此临床应结合患者自身情况选择最佳手术方法。
