长牡蛎新型模式识别受体CgLRRC69 的克隆和功能鉴定
2021-03-05张翔宇宋菁晨刘坤娜毛帆肖述向志明张扬喻子牛
张翔宇 , 宋菁晨, 刘坤娜 , 毛帆 肖述 向志明 张扬 喻子牛
1. 中国科学院热带海洋生物资源与生态重点实验室, 中国科学院南海海洋研究所, 广东 广州 510301;
2. 华南农业大学海洋学院, 广东 广州 510642;
3. 中国科学院大学, 北京 100049
先天免疫反应是脊椎动物和无脊椎动物的第一道宿主防御系统。先天免疫反应的第一步是通过模式识别受体(Pattern Recognition Receptors, PRRs)来感知病原体相关的模式识别分子(Pathogen- Associated Molecular Pattern, PAMPs), 从而启动特定的信号通路, 抵御病原体的入侵(Medzhitov, 2007)。目前已知的先天性免疫反应的模式识别受体结构域包括: 富含亮氨酸重复序列(leucine rich repeat, LRR)结构域、C1q 结构域、碳水化合物识别结构域(carbohydrate recognition domain, CRD)、胱天蛋白酶募集结构域等(Pålsson-McDermott et al, 2007)。其中, LRR 结构域是先天免疫识别过程中最常见的蛋白质结构域之一, 在植物、无脊椎动物和脊椎动物中广泛分布, 且进化保守(Huang et al, 2008)。LRR 结构域由LRR 基序组成, 每个LRR 基序通常具有20~29 个残基, 其共同特征是都包括一个保守的由 11 个氨基酸残基组成的片段(序列为LxxLxLxxN/CxL, x 可以是任何氨基酸, L 位也可以是缬氨酸、异亮氨酸和苯丙氨酸), 负责同配体识别, 发生蛋白质-蛋白质相互作用(Kobe et al, 2001)。在结构上, LRR 结构域呈弧形或马蹄形, 其凹面由平行的β 链组成, 而凸面则是包括α 螺旋在内的二级结构的可变区域。包含LRR 结构域的蛋白, 可以与蛋白质、激素、核酸、脂质和脂多糖等多种配体直接结合(Matsushima et al, 2019)。典型的含有LRR 结构域的蛋白质包括Toll 样受体(Toll-like receptors, TLRs)、RIG-I 样受体(RIG-I like receptors, RLRs)和NOD 样受体(Nucleotide binding oligomerization domain like receptors, NLRs)等, 它们在识别细菌、真菌、病毒和寄生虫的PAMPs 中发挥着重要的作用(Jin et al, 2008; Buchmann, 2014)。例如, 在植物中核苷酸结合位点(NBS)-LRR 蛋白可以与PAMPs 识别, 并诱导一系列宿主防御反应, 如呼吸氧爆发, 钙和离子通量的激活等(Kunkel et al, 2002; Delledonne et al, 2003; Peart et al, 2005)。在哺乳动物中, Toll 样受体利用LRR 域识别入侵的细菌、真菌和病毒等病原的PAMPs 分子, 从而激活下游的免疫反应(Ng et al, 2011a)。在无脊椎动物中, LRR 结构域出现了大量扩张, 增加了对病原体识别的多样性(Huang et al, 2008; Wang et al, 2016a, 2016b)。在对虾中, 富含LRR 基序的凝集素作为模式识别受体可以结合细菌的鞭毛蛋白, 从而阻止细菌的粘附和定植(Wang et al, 2017b)。另外, 长牡蛎中富含 LRR 基序的CgLRFN 可以有效地结合副溶血弧菌, 并且调理血淋巴的吞噬作用(Huang et al, 2018)。此外, 已有相关研究报道显示, 感染可以有效诱导包含LRR 结构域的基因的表达。例如, 扇贝LRR mRNA 在受4 种PAMPs (PGN、LPS、GLU 和poly I: C)刺激后, 转录水平显著上调(Wang et al, 2016a, b); 对虾的LRR 结构域包含蛋白在白斑综合症病毒(WSSV)的刺激下, 表达量也显著上升(Sriphaijit et al, 2007)。
长牡蛎Crassostrea gigas 是我国沿海地区的重要经济品种, 同时在固碳削减、防止海水富营养化等方面也发挥着巨大的生态价值。然而, 病害的爆发经常导致牡蛎的大规模死亡, 给贝类产业带来较大的经济损失, 因此深入了解牡蛎的免疫防御机制有利于制定新的抗病策略。本文通过研究长牡蛎中LRR 结构域包含的基因及其免疫学功能, 成功地克隆了一个LRR 基因(命名为CgLRRC69), 并对其在牡蛎免疫防御中的功能进行了鉴定。
1 材料与方法
1.1 实验样品、攻毒与组织收集
本实验所用长牡蛎(2 岁龄, 平均壳长100mm)均取自中国山东省青岛市。在进行实验之前, 先将牡蛎置于22~25℃的循环海水中培养两周, 使其适应实验室环境。随后将200 只牡蛎随机分为两组, 分别为细菌攻毒组和对照组。向攻毒组牡蛎的肌肉中注射 50μL 副溶血弧菌(Vibrio Parahemolyticus, 1×108CFU·mL–1), 对照组注射相同体积的PBS 缓冲液。在注射0h、3h、6h、12h、24h 后, 分别从围心腔内采集血淋巴液, 4℃离心(4000g, 10min)收集血淋巴细胞。每个采集样品的时间点, 细菌攻毒组和对照组都随机抽取了5 个个体收集血淋巴细胞, 用于提取总RNA。此外, 从3 只健康的牡蛎中收集血淋巴细胞、鳃、外套膜、肌肉、消化腺、性腺和心脏等组织和细胞, 提取总RNA 进行组织分布分析。
1.2 RNA 的提取
总RNA 的提取使用Trizol (Invitorgen)抽提法, 具体步骤如下: 取50mg 组织于液氮预冷的研钵中, 将组织研磨成粉末之后, 转移到装有1ml Trizol 的离心管中, 吹打、混匀后加入200μL 氯仿, 剧烈震荡40s; 室温放置5min 后, 4℃、12000g 离心10min, 吸取上清液转移至新的EP 管中, 在新的EP 管中加入0.5mL 的异丙醇, 混匀; –80℃沉淀过夜后, 4℃、12000g 离心10min, 弃上清; 75%乙醇清洗涤沉淀两次, 弃上清, 加入100μL DEPC 水溶解RNA。采用A260nm紫外光吸收法测定RNA 浓度, 通过琼脂糖凝胶电泳检测RNA 的完整性。
1.3 原核表达载体的构建
应用Primer 6.0 根据NCBI GeneBank的基因序列, 设计涵盖LRR 开放阅读框(ORF)的引物, 引物两端分别加入BamH-I 和Xho-I 两个酶切位点, 提取转录组RNA, 并逆转录为cDNA, 以此为模板使用这对引物进行PCR 扩增, 并利用2%琼脂糖凝胶电泳鉴定扩增结果。PCR 产物和pGEX-4T-1 载体分别使用BamH-I和Xho-I 进行双酶切, 酶切产物纯化后回收, 回收的PCR 片段和pGEX-4T-1 载体于16℃过夜连接。连接产物转化至大肠杆菌DH5α 感受态细胞, 在含有50μg·mL–1氨苄霉素的LB 固体培养基上37℃倒置培养过夜。挑选长势较好的单菌落接种于LB 培养基(50μg·mL–1)中, 于37℃摇床上震荡培养, 抽提重组质粒后, 提交至英潍捷基(上海)贸易有限公司进行测序。
1.4 重组蛋白的原核表达和纯化
将重组原核表达质粒pGEX-4T-1-LRR 转化至大肠杆菌BL21(DE3)感受态细胞, 在含有50μg·mL–1氨苄霉素的LB 固体培养基上37℃倒置培养过夜。挑选长势较好的单菌落接种于含有50μg·mL–1氨苄霉素的LB 培养基中, 于37℃、180r·min–1摇床上震荡培养, 定时检测细菌OD600。当OD600等于0.6 左右时, 加入终浓度为0.1mmol·L–1的IPTG, 在22℃、180 r·min–1的条件下诱导表达。培养结束后, 4℃、12000g 离心10min, 并收集沉淀; 加入溶菌酶至终浓度为2mg·mL–1后超声破碎细菌; 使用 Glutathione Sepharose 4B (GE Healthcare)纯化重组蛋白, 在12% 的SDS-PAGE 胶中分析纯化产物。
1.5 酶联免疫吸附反应(ELISA)
将脂多糖(LPS)、肽聚糖(PGN)、脂磷壁酸(LTA)、葡聚糖(Glucan)、昆布多糖(Laminarin)等多种PAMPs分别溶解在双蒸水(40mg·mL–1)中; 分别吸取50μL 至96-孔板(Costar), 室温放置, 直至蒸干; 蒸干后置于60℃烘干箱中30min, 固定PARMs; 加入200μL 含有牛血清蛋白(BSA)的Tris 缓冲液, 37℃孵育2h 进行封闭包被; 吸去上清, Tris 缓冲液清洗4 次, 以去除多余的BSA; 加入纯化好的LRR 重组蛋白, 室温孵育3h进行特异性结合; 弃上清, Tris 缓冲液清洗4 次, 以洗去未结合的LRR 重组蛋白; 加入鼠源anti-GST 抗体 (Abmat, 1: 5000), 孵育2h; 弃上清, Tris 缓冲液洗4次后加入HRP 偶联的羊抗鼠IgG (Abmat, 1: 3000), 孵育2h; 加入HRP 底物TMB(Tiangen)进行显色, 用酶标仪测量A450nm的吸收光结果。
1.6 吞噬效率测定
将溶藻弧菌(Vibrio alginolyticus)和副溶血弧菌(Vibrio Parahemolyticus)两种牡蛎致病菌在LB 培养基中37°C 下培养生长至对数中期, 并用新的LB 培养基稀释至109CFU·mL–1; 稀释后, Tris 缓冲液洗3 次, 在菌液中加入重组CgLRRC69 蛋白(100ng·µL–1), 空白对照组中加入20µL的Tris缓冲液, 阴性对照组中加入20µL的GST (100ng·µL–1), 37℃下孵育3h; 离心, 弃上清, 每组分别加入100µL 血淋巴细胞并轻轻摇晃混匀, 孵育30min; 弃上清, Tris 缓冲液洗3 次, 加入含有150µL 1.5%EDTA 的PBS 悬浮细胞; 取100µL 细胞悬浮液铺在LB琼脂平板上, 37℃过夜后即可对菌落形成单位(CFU)进行计数, 以统计吞噬弧菌的数量。
1.7 实时定量PCR
通过实时定量PCR 分析CgLRRC69 mRNA 在各种组织以及攻毒过程中的表达水平, 以GAPDH 为参考基因, 实时PCR 分析的引物见表1。实时荧光定量分析采用Roche 公司的2×Master Mix 试剂盒, 反应体系如下: Forward Primer (10μmol·L–1)1μL, Reverse Primer (10μmol·L–1)1μL, cDNA1μL, 补充无菌水至20μL。荧光定量PCR 的程序为: 将配制好的体系加到96 孔板上, 封板膜后, 短暂离心, 放置于荧光定量 PCR 仪中。然后按照如下反应程序进行操作: 94℃预变性1min; 95℃变性15s, 55℃复性15s, 72℃延伸15s, 进行40 个循环; 85 , 15s℃后终止反应。数据以2–ΔΔct法计算目的基因的表达量。
1.8 RNA 干扰(RNAi)
通过合成并注射dsRNA, 从而敲降CgLRRC69在牡蛎体内的表达水平。表1 所示是用于合成dsRNA的引物。设计带有T7 启动子的CgLRRC69 引物和GFP 引物进行PCR 扩增, 产物用于dsRNA 的合成; 体外转录合成RNA (Promega, RiboMAX™ Express RNAi System), 体系如下: T7 2×缓冲液 10μL, DNA模板1~8μL (约1μg), 酶混合物2μL, RNase dH2O 补充至20μL。PCR 程序为: 37℃孵育30min, 70℃反应10min, 然后用降落PCR 从70℃降至20 , ℃ 每个循环降 0.5 , 12s℃为一个循环, 合成dsRNA。纯化dsRNA: 每 20μL 的体系加入 1μL 稀释(1: 200)的 RNase solution 和1μL RQ1 Rnase-free DNase, 37℃反应30min; 加入2μL 3mol·L–1sodium Acetate (pH5.2)和20μL 异丙醇混合均匀; 冰上反应5min 后, 以最大转速离心10min, 去除上清; 用70%的冰乙醇小心清洗白色沉淀, 去除乙醇, 空中晾干15min; 用2~5 倍体积无核酸酶水溶解RNA, 保存于-20℃或-80℃下, 用于后续注射。将10 只牡蛎随机均分为2 组并置于2个水箱中, 分别标记为实验组和对照组。每只牡蛎注射50µg dsRNA, 3d 后收集样品并进行后续实验。RNAi 效率通过RT-qPCR 进行确定。

表格1 使用的寡核苷酸引物序列 Tab. 1 Sequences of oligonucleotide primers used
1.9 弧菌清除效率测定
将溶藻弧菌和副溶血弧菌两种牡蛎致病菌在LB 培养基中37℃下培养生长至对数中期, 并用新的LB 培养基稀释至109CFU·mL–1; 稀释后, Tris 缓冲液洗3 次备用。在24 孔细胞培养板中培养牡蛎血淋巴细胞, 每孔细胞数约2.5×105个, 培养0.5h 后加入50µL 菌悬液, 轻轻摇晃混匀孵育20min, 使血淋巴吞噬弧菌; 弃上清, Tris 缓冲液洗3 次, 去掉没有被吞噬的弧菌; 缓冲液孵育1h, 使血淋巴细胞尽量杀死内化的细菌; 弃上清, 加入含有 150µL 1.5%EDTA 的PBS 悬浮细胞; 取100µL 细胞悬浮液铺在LB 琼脂平板上, 37℃过夜后即可计数CFU。
1.10 数据分析
使用GraphPad Prism (版本8.0.1)进行数据处理和统计分析, 所有统计值均表示为平均值±SEM。使用SPSS 18.0 软件对所获取的数据进行分析, 其中两组之间的显著性由Student-t 检验确定, 两个以上组通过ANOVA 单因素方差分析和Tukey HSD 多重比较。当P<0.05 时, 认为差异显著, 用*表示; 当P<0.01 时, 认为差异极显著, 用**表示。
2 结果
2.1 CgLRRC69 基因开放阅读框(ORF)的克隆与鉴定
从长牡蛎基因组数据库中获得CgLRRC69 基因序列, 并以此克隆了长牡蛎CgLRRC69 的开放阅读框(ORF)。获得的CgLRRC69 的开放阅读框序列长度为1059bp, 编码457 个氨基酸, 预测等电点约为8.21, 核苷酸序列和推导的氨基酸序列如图1 所示。

图1 CgLRRC69 完整的ORF 和推导的氨基酸序列 黑色字体为长牡蛎CgLRRC69 的开放阅读框(ORF), 蓝色字体为翻译的氨基酸序列, 粗体表示起始密码子和终止密码子; *代表终止密码子, 负责终止肽链合成; 灰色阴影部分表示LRR-亮氨酸重复序列 Fig.1 The complete ORF and deduced amino acid sequence of CgLRRC69. The black font is the open reading frame (ORF) of Oyster CgLRRC69, the blue font is the translated amino acid sequence, and the bold font indicates the start codon and the stop codon. * represents the stop codon, which does not encode any amino acid and is responsible for terminating the peptide chain synthesis. Shading indicates the LRR-leucine repeat sequence
BLAST 分析表明 CgLRRC69 与哺乳动物的LRRC69 同源性最高。多序列比对显示LRRC69 在进化中高度保守(图2)。
SMART 预测分析(图3)显示, CgLRRC69 包含6个LRR 结构域和1 个LRR_TYP 结构域, 而同为软体动物的虾夷扇贝LRRC69 有4 个LRR 结构域和2个LRR_TYP 结构域。人、家鼠和斑马鱼LRRC69具有7~8 个LRR 结构域。

图2 长牡蛎LRRC69 氨基酸序列与人(Homo sapiens)、家鼠(Mus musculus)、斑马鱼(Danio rerio)、虾夷扇贝(Mizuhopecten yessoensis)和美洲牡蛎(Crassostrea virginica)的对比 图中*、:和.分别表示相同的、高度保守的和不太保守的氨基酸残基; 黑底白字表示在选取的6 个物种中, 在不太保守的氨基酸残基中仍有 3 个以上相同氨基酸重复; 灰底黑字表示在不太保守的氨基酸残基中存在性质相似的氨基酸; GenBank 登录号如下: 人(NP_001123362.1)、家鼠(XP_006538358.1)、斑马鱼(XP_005159720.1)、虾夷扇贝(XP_021346950.1)和美洲牡蛎(XP_022338017.1) Fig.2 The amino acid sequence of Pacific oyster LRRC69, compared with Homo sapiens, Mus musculus, Danio rerio, Mizuhopecten yessoensis, and Crassostrea virginica. Identical, highly conserved and less conserved amino acid residues are indicated by *, : and . . White letters on black background indicate that in the six selected species, there are still more than three identical amino acid residues in the less conservative amino acid residues. Black letters on gray background indicate that there are amino acids with similar properties in the less conservative amino acid residues. The GenBank accession numbers are listed: Homo sapiens (NP_001123362.1), Mus musculus (XP_006538358.1), Danio rerio (XP_005159720.1), Mizuhopecten yessoensis (XP_021346950.1) and Crassostrea virginica (XP_022338017.1)
采用 MEGA4.0 软件的邻接算法生成无根系的CgLRRC69 系统进化树(图4), 结果显示长牡蛎的 CgLRRC69 与美洲牡蛎(Crassostrea virginica)的LRRC69 亲缘关系最近, 并与其他无脊 椎 动物 如 虾夷 扇 贝(Mizuhopecten yessoensis)、棘冠海星 (Acanthaster plancl)等的LRRC69 同源蛋白聚为一支, 这与传统分类的结果相符。
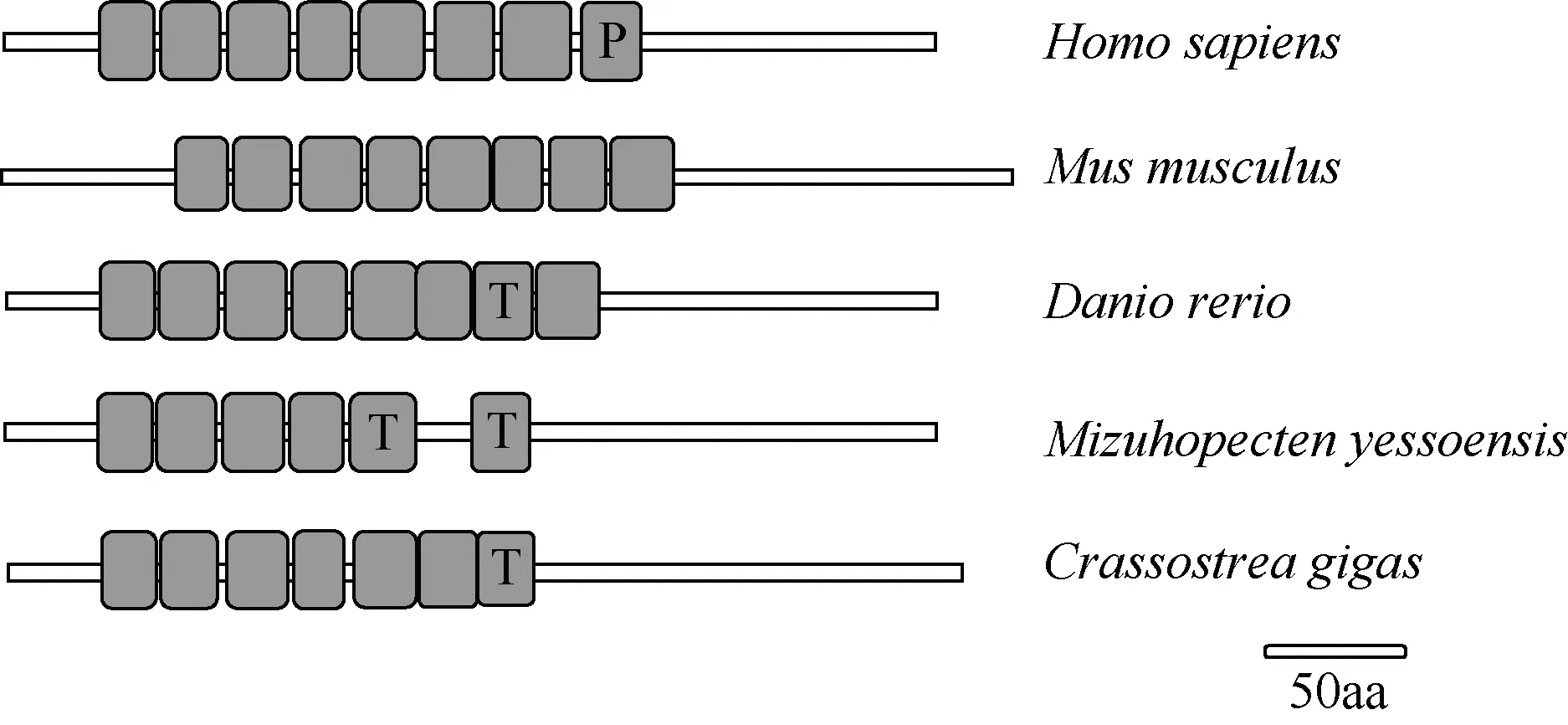
图3 LRRC69 在不同物种中的结构图解 P 表示 Pfam: LRR, T 表示 LRR-TYP, 空白表示普通 LRR; GenBank 登录号如下: 人(NP_001123362.1) 、 家鼠(XP_006538358.1) 、 斑马鱼(XP_005159720.1) 、 虾夷扇贝(XP_021346950.1)、美洲牡蛎(XP_022338017.1) Fig.3 Schematic of LRRC69 structures in different species. P means Pfam: LRR; T means LRR-TYP; blank means ordinary LRR. The GenBank accession numbers are listed: Homo sapiens (NP_001123362.1), Mus musculus (XP_006538358.1), Danio rerio (XP_005159720.1), Mizuhopecten yessoensis (XP_021346950.1) and Crassostrea virginica (XP_022338017.1)
2.2 CgLRRC69 基因的表达模式
CgLRRC69 基因的组织分布表明, 其mRNA在所有检测到的组织中都有表达, 包括血淋巴细胞、鳃、外套膜、肌肉、心脏、消化腺和性腺 (图5a)。其中, 在鳃和血淋巴细胞中的表达水平最高, 其次是消化腺和性腺, 在其余组织中的表达水平相对较低。此外, 我们还分析了副溶血弧菌感染下CgLRRC69 mRNA 在血淋巴的表达模式。结果显示, 在副溶血弧菌感染 3h 后, CgLRRC69 基因表达上调了4.04 倍(P<0.01); 在6h 后达到峰值, 达到了15.15 倍(P<0.01)。随着时间的推移, CgLRRC69 mRNA 水平在感染后12h 开始下降, 并在24h 恢复到初始水平(图5b)。这些结果表明, CgLRRC69 可能在长牡蛎免疫防御中起着重要的作用。
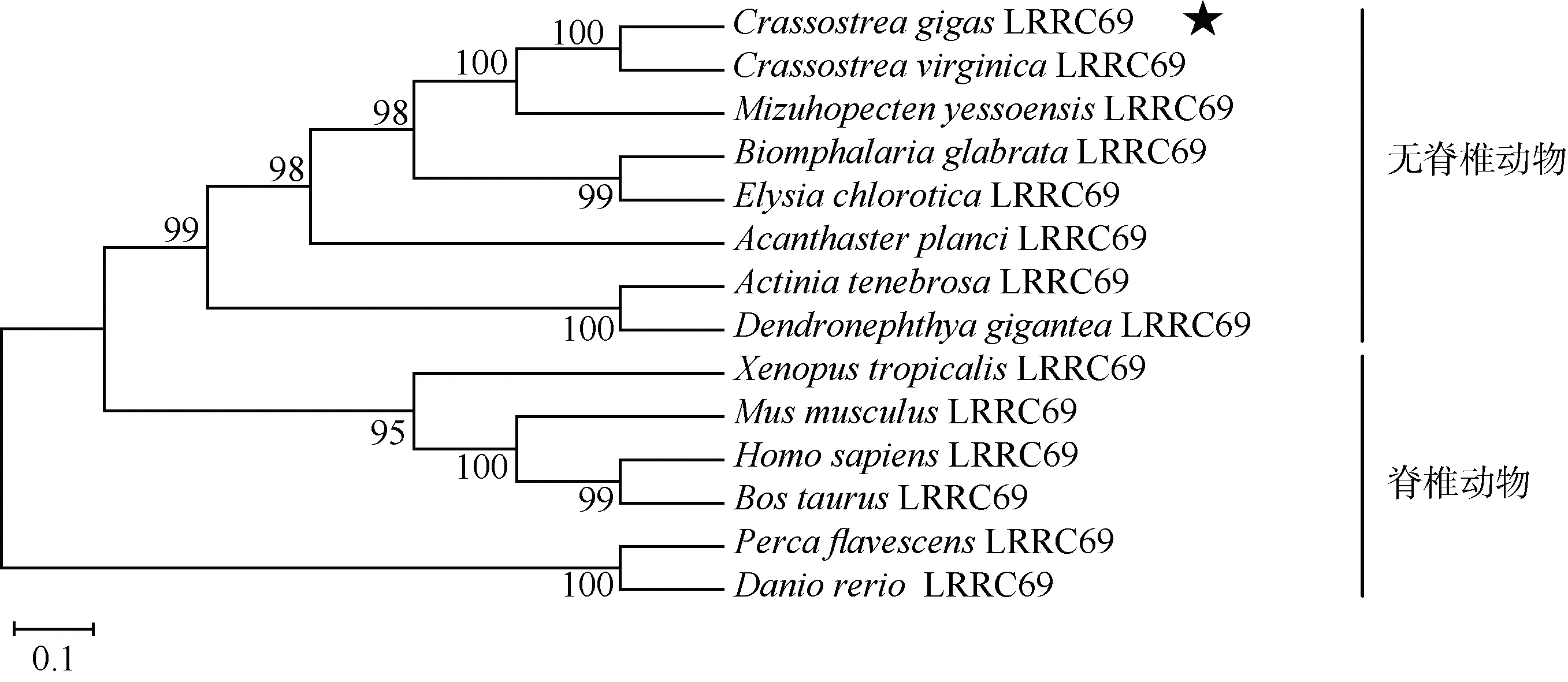
图4 无脊椎动物和脊椎动物的LRRC69 系统发育分析 五角星表示目的物种 Fig.4 Phylogenetic analysis of invertebrate and vertebrate LRRC69 homologs. Five-pointed star indicates the target species
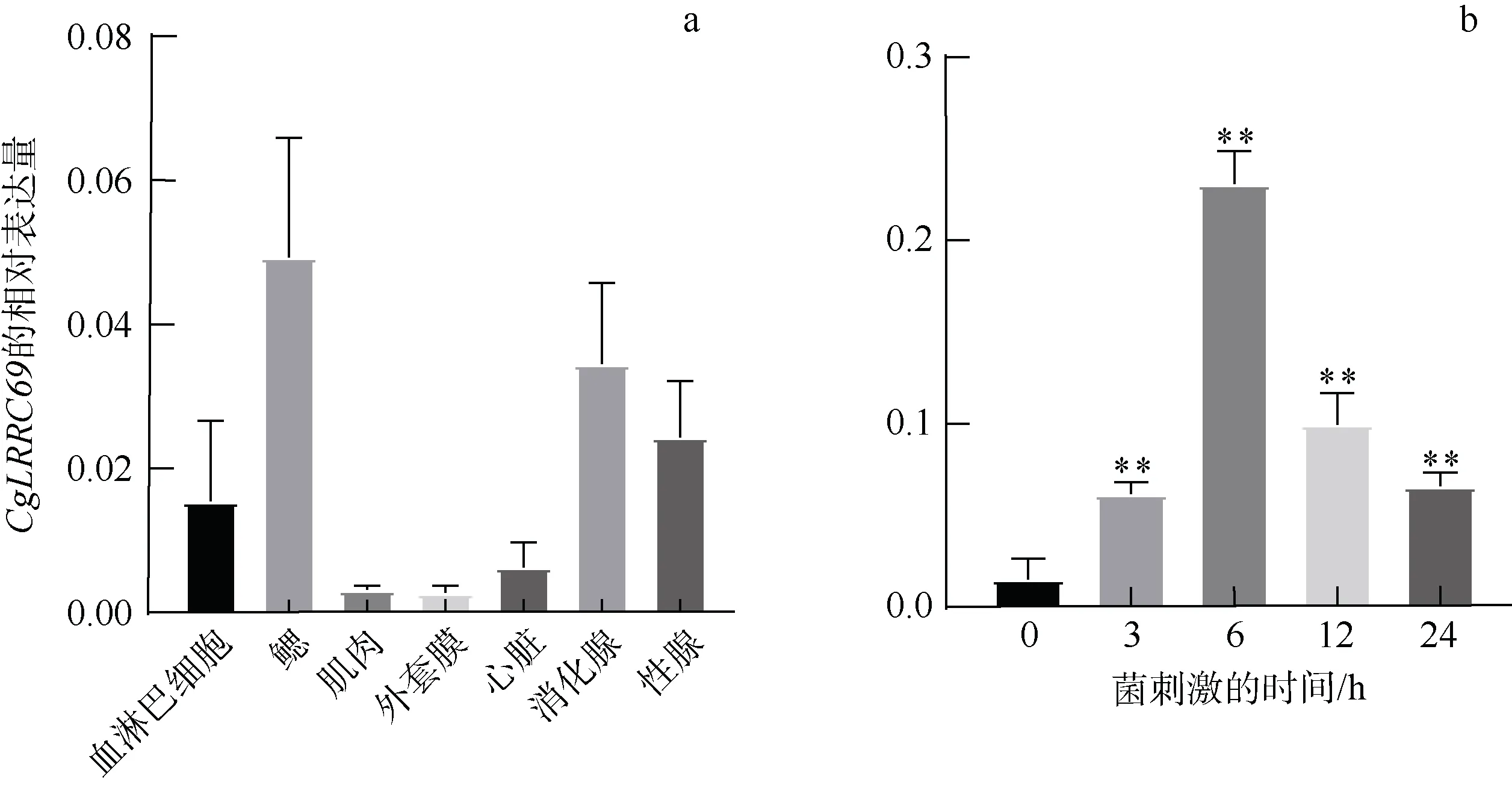
图5 CgLRRC69 基因的相对表达量 a. 长牡蛎组织中CgLRRC69 的分布, 包括血淋巴细胞、鳃、外套膜、肌肉、心脏、消化腺和性腺; b. CgLRRC69 在细菌刺激下的表达变化, 数值以Mean ± SEM 表示(N=3), **表示p<0.01, 即差异极显著 Fig.5 CgLRRC69 gene expression in tissues and under bacterial challenge. (a) Tissue distribution of CgLRRC69 in oyster, including hemocytes, gill, muscle, mantle, heart, digestive gland, and gonads. (b) Variation in expression of CgLRRC69 in response to bacterial challenge. Data are expressed as Mean ± SEM (N=3). ** means p<0.01, namely, the difference is extremely significant
2.3 CgLRRC69 蛋白的模式识别
通过原核表达的方法, 我们获得了CgLRRC69的重组蛋白, 纯化后的 CgLRRC69 融合蛋白大约为66.56kDa (图6a)。通过对重组CgLRRC69 蛋白与多种PAMPs 分子(包括LPS、PGN、LTA、GLucan、Laminarin 和poly I: C)进行ELISA 实验, 结果发现CgLRRC69 对LPS 具有特异的结合能力, 显著高于其对其他PAMPs 的亲和力 (图6b)。进一步分析显示, 相比于对照组, ELISA 实验证明CgLRRC69 和LPS 在蛋白浓度为1μg·mL–1时已经显著结合 (图6c), 表明了CgLRRC69 对LPS 具有高度的亲和力。
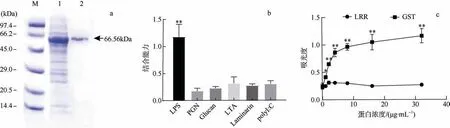
图6 CgLRRC69 蛋白的体外表达及对LPS 的亲和力特异性分析 a. 经SDS-PAGE 分析纯化后的CgLRRC69 蛋白, 用考马斯亮蓝染色显示; M 为分子量标记; 数字1 表示泳道1, 为总细菌蛋白; 数字2 表示泳道2, 为纯化的蛋白质。b. 测定病原菌相关的模式识别分子与CgLRRC69 蛋白的结合亲力, **表示p<0.01, 即差异极显著。c. 酶联免疫吸附法测定LRR 结构域蛋白与固定化LPS 的结合, 数值以Mean ± SEM 表示(N=3); *表示p<0.05, 即差异显著; **表示p<0.01, 即差异极显著 Fig.6 CgLRRC69 protein with affinity specificity for LPS. (a) The purified CgLRRC69 recombinant protein was analyzed by SDS-PAGE and visualized with Coomassie brilliant blue staining. M: Molecular weight marker; Lane 1: total bacterial protein; Lane 2: purified protein. (b) PAMPs binding affinity with CgLRRC69. ** means p<0.01, namely, the difference is extremely significant. (c) The binding of LRR domain protein to immobilized LPS as determined by Enzyme-linked immunosorbent assay. Data are expressed as Mean ± SEM (N=3). * means p<0.05, namely, the difference is significant; ** means p<0.01, namely, the difference is extremely significant
2.4 CgLRRC69 的促吞噬作用
为了确定CgLRRC69 蛋白是否会影响血淋巴细胞介导的吞噬作用, 我们对牡蛎的血淋巴细胞进行了吞噬实验和杀菌实验。吞噬实验结果显示, 血淋巴细胞对CgLRRC69 重组蛋白孵育过的溶藻弧菌和副溶血弧菌的吞噬指数分别增加了1.87 倍和1.65 倍 (图7a), 表明CgLRRC69 重组蛋白具有调理作用, 具体表现为可以促进对弧菌病原体的吞噬。为进一步验证CgLRRC69 在牡蛎体内的功能, 通过RNAi实验敲降了CgLRRC69 的表达。定量PCR 的结果表 明, 相比于对照组的CgLRRC69 表达水平, 实验组的RNAi 效率超了60% (图7b)。吞噬并清除入侵病原体是血淋巴细胞介导的免疫防御中重要的过程, 本文的实验结果也验证了CgLRRC69 在清除入侵病原菌中的作用。敲降CgLRRC69 以后, 血淋巴细胞对溶藻弧菌和副溶血弧菌的清除能力都有显著下降 (图7c)。上述结果均表明CgLRRC69 对于牡蛎血淋巴细胞吞噬防御的重要作用

图7 CgLRRC69 在吞噬和杀菌中的作用 a. CgLRRC69 重组蛋白对血淋巴吞噬细菌的影响, **表示p<0.01, 即差异极显著; b. RNAi 敲降效率, **表示p<0.05, 即差异极显著; c. 对照组与dsCgLRRC69 敲降处理组杀菌能力的差异, 数值以Mean ± SEM 表示(N=3); *表示p<0.01, 即差异显著 Fig.7 The role of CgLRRC69 in phagocytosis and sterilization. (a) The effects of CgLRRC6 recombinant protein coating on the phagocytic ability of hemocytes. ** means p<0.01, namely, the difference is extremely significant. (b) dsCgLRRC69 knockdown efficiency. Experimental group: dsLRRC69; control group: dsGFP. ** means p<0.01, namely, the difference is extremely significant. (c) Display of the difference in bactericidal ability between the control group and dsCgLRRC69 knockdown treatment group. Data are expressed as Mean ± SEM (N=3). * means p<0.05, namely, the difference is significant
3 讨论
本研究从长牡蛎中鉴定出了CgLRRC69 基因, 其编码的蛋白包含了由13~20 个富含亮氨酸的氨基酸残基组成的7 个LRR 基序, 这也是LRR 结构域的典型特征(Ng et al, 2011b)。LRR 家族的其他成员已经被证实参与了包括识别抗原、启动免疫应答、诱导凋亡和自噬等过程, 这些研究也提示CgLRRC69可能在牡蛎的免疫防御方面具有重要作用(Liu et al, 2016)。为了验证这一假设, 我们检测了CgLRRC69在各组织中的表达模式。CgLRRC69 的转录本在多种组织中广泛分布, 其中以鳃为最高, 可能在于鳃作为滤水性器官, 经常接触海水中的病原微生物有关(Li et al, 2017)。此外, 我们还观察到CgLRRC69在生殖腺中也有较高的表达, 推测可能其在卵细胞中积累, 以母性遗传的方式保护下一代个体, 但是这个假说需要进一步验证。同时, 副溶血弧菌感染可以显著地诱导血淋巴细胞中CgLRRC69 的表达, 其表达量在6h 达到峰值后缓慢回落并逐渐恢复到原始水平。Liu 等(2020)在中华绒螯蟹中也发现了类似的表达模式, EsVLRA 是由13 个LRR 结构域组成的免疫基因, 同样在副溶血弧菌感染6h 后, 其表达量达到峰值。这些结果暗示CgLRRC69 在早期急性感染中可能具有显著的免疫相关的作用。然而, 长牡蛎另外一个含有 LRR 结构域的基因(CgLRFN), 在副溶血弧菌感染后12h 达到峰值。不同表达模式的差异表明存在不同的调节机制, 这可能是由于CgLRRC69 和CgLRFN 在免疫防御中的功能有所不同造成的(Huang et al, 2018)。
病原菌侵入生物体后, 免疫反应的启动通常是由免疫细胞的模式识别受体感知病原体相关的模式识别分子(PAMPs)后启动特定的信号通路引发下游反应(Rothberg et al, 1990)。LRR 结构域介导大多数模式识别受体的识别作用, 如植物中的NBS(核苷酸结合位点)-LRR 结构域识别病原体, 哺乳动物中的Toll 样受体(TLR)和NOD 样受体(NLR)通过其LRR 结构域识别病原菌的分子决定簇(Kobe et al, 2001; Chai et al, 2009)。作为无脊椎动物, 长牡蛎中存在CgTLR 通过LRR 结构域结合病原菌, 激活血淋巴细胞免疫应答机制(Zhang et al, 2011, 2013)。在本文研究中, 长牡蛎CgLRRC69 也显示出具有与病原菌模式分子LPS 特异性结合的能力。与此相似的是, 长牡蛎 TLR 家族的成员 CgLRRIG-1 和CgLRRIG-2 也具有LPS 识别能力, 且在LPS 刺激下mRNA 表达量显著升高(Wang et al, 2017c)。LPS 是革兰氏阴性菌细胞壁外壁的主要组成成分, 且LPS携带大量负电荷, 而LRR 结构域则由大量的正电氨基酸组成, 推测这可能是介导其识别LPS 的原因。在结构上, LRR 结构域的凸面由包括α-螺旋在内的二级结构组成, 这与大多数含有 α-螺旋的抗菌肽(Antimicrobial peptides, AMPs)结构相似(Sitaram, 2006)。单一的α-螺旋肽已被证实存在与完整抗菌蛋白相似的抗菌活性, 推测LRR 结构域可能是通过α-螺旋与LPS 结合来激活下一步的免疫反应。
血淋巴细胞通过识别外来病原菌进而吞噬杀死病原菌来完成整个吞噬作用。但体液中的细胞和细菌因带负电荷而互斥, 调理素可以促进病原体的吞噬清除。目前已明确的调理素(包括C3b、C4b、IgG、IgM、C-反应蛋白和血清样蛋白等)大多都是在脊椎动物上进行了多次研究, 关于无脊椎动物调理素的资料却很少(Van Lookeren Campagne et al, 2007; Li et al, 2008)。已有证据表明, LRR 结构域可以结合细菌表面分子以促进吞噬作用(Kawai et al, 2010; Wang et al, 2019)。与此相似的是, 在冈比亚按蚊(Anopheles gambiae)中, AgTep1 蛋白被激活后也通过两个富含亮氨酸重复序列(LRR)蛋白来调节和促进对病原体的识别、吞噬和消灭(Shokal et al, 2017)。本研究测定了CgLRRC69 在长牡蛎血淋巴细胞吞噬作用中的调理作用, 以及CgLRRC69 对血淋巴细胞杀菌能力的影响, 结果表明CgLRRC69 可以作为调理素来刺激牡蛎血淋巴细胞的吞噬作用, 而且根据酶联免疫吸附实验, 体外重组的CgLRRC69 蛋白可能是通过与LPS 特异性结合来直接发挥调理作用的。同时, 在杀菌能力方面, 通过RNAi 敲降CgLRRC69 的表达抑制了细菌在牡蛎体内的清除能力, 这有力地证实了CgLRRC69 在牡蛎免疫系统中的关键作用。
综上所述, 本文研究发现的CgLRRC69 可能是牡蛎中的一种新型模式识别受体, 能起介导LPS 识别和调理的双重作用, 为深入研究低等生物的免疫防御和演化提供了新的线索。
