一株群体感应抑制活性海洋放线菌的筛选与鉴定*
2021-03-05李艳群陈柔雯林宗豪田新朋尹浩
李艳群 , 陈柔雯 , 林宗豪 , 田新朋 , 尹浩
1. 中国科学院热带海洋生物资源与生态重点实验室, 中国科学院南海海洋研究所, 广东 广州 510301;
2. 中国科学院大学, 北京 100049;
3. 南方海洋科学与工程广东省实验室(广州), 广东 广州 511458;
4. 广东省海洋药物重点实验室, 中国科学院南海海洋研究所, 广东 广州 510301
群体感应(Quorum sensing, QS)是微生物群体根据自身细胞密度变化释放的信号分子达到一定阈值后, 影响微生物特定基因的表达, 调控自身生理活动, 实现微生物种群自我协调的一种群体行为。QS调控机制与病原微生物的毒力和致病性密切相关(Manefield et al, 1999; Zhang, 2003)。群体感应抑制剂(Quorum sensing inhibitors, QSIs)是具有前景的传统抗生素替代物。QSIs 通过调节致病菌的QS 行为, 降低其致病性和毒力。QSIs 控制病菌的机理不同于传统抗生素阻断、干扰致病菌的生物合成途径, 不易对致病菌形成选择性压力, 因而致使致病菌产生耐药性的几率非常小(张炼辉, 2019)。
QS 现象的发现与海洋微生物密切相关。Nealson 等(1970)首次报道了一种海洋费氏弧菌(Vibrio fischeri)的菌体密度与发光呈正相关, 该发光现象是由高丝氨酸信号分子介导的群体感应, 由此引发了关于QS 的猜想。海洋细菌哈维弧菌(V. harveyi)有复杂的QS 信号产生和感应系统, 现在被广泛用作QS 研究的模式微生物(Miller et al, 2002)。
海洋微生物已经成为QS 抑制活性菌株的重要来源。Dobretsov 等(2013)发现海洋环境中的芽孢杆菌(Bacillus)、弧菌(Vibrio)、假单胞菌(Pseudomonas)具有对附生或伴生细菌的QS 信号分子产生响应和干扰的能力。Kanagasabhapathy 等(2009)的研究表明, 海洋生物的共附生微生物中也存在着丰富的QSIs生产菌株, 属于芽孢杆菌科(Bacillaceae)、假单胞菌科(Pseudomonadaceae) 、 假交替单胞菌科(Pseudoalteromonadaceae)和弧菌科(Vibrionaceae)。目前, 已从海洋活性菌株中发现了一批重要的QSIs, 如利用紫色杆菌模型从海洋革兰氏阴性细菌Rheinheimera aquimaris QSI02 中发现了活性化合物二酮哌嗪cyclo(Trp-Ser)(Sun et al, 2016), 从海洋放线菌Streptomyces parvulus HY026 次级代谢产物中发现了放线菌素D(actinomycin D)(Miao et al, 2017), 以及从海洋真菌Penicillium sp. SCS-KFD08 中分离并鉴定出了Aculene E 和Aspergillumarins B (Kong et al, 2017)。再如,使用铜绿假单胞菌模型发现了海洋蓝细菌 Lyngbya majuscula 的次级代谢产物Malyngolide(Kwan et al, 2010), 它在浓度为3.57~57mmol·L–1时可抑制基于铜绿假单胞菌LasR受体的Acylated homoserine lactone (AHL)报告基因的表达, 且不会影响铜绿假单胞菌自身的生长。
QS 快速检测技术的发展为活性菌株的发现带来了便利。紫色杆菌(Chromobacterium violaceum)模型是发现QS 抑制活性的有效指示菌之一。紫色杆菌是一种革兰氏阴性细菌, 其紫色菌素的产生受QS 严格调控。当自身细胞密度达到一定临界浓度时, 紫色杆菌向环境释放的信号分子 N-Hexanoyl-L- homoserine lactone (C6-HSL)与接受信号的其他细胞内转录调节蛋白CviR 结合, 启动紫色菌素基因的表达(Mcclean et al, 1997), 从而产生紫色菌素, 并指示 QS 作用的发生。本研究所用的紫色杆菌(C. violaceum 026, CV026 )为信号分子基因缺失突变株, 当受到外源信号分子C6-HSL 刺激时, 也能够启动QS 调控的紫色菌素产生(Mcclean et al, 1997)。若有QSIs 存在, 则能抑制紫色菌素的产生。紫色杆菌作为一种准确、便捷、直观的指示菌株(Martinelli et al, 2004), 已经在QS 相关研究中被广泛应用。
本研究利用紫色杆菌CV026 模型, 对南海中西部和印度洋深海沉积物样品中40 株放线菌的QS 抑制活性进行了评价, 并筛选到了1 株具有明显QS 抑制活性的菌株, 本文将其命名为SCSIO 53717。根据形态学特征和 16S rRNA 基因序列分析, 鉴定SCSIO 53717 菌株为Kocuria 属。这是对该属菌种具有QS 抑制活性的首次报道。
1 材料与方法
1.1 材料
1.1.1 菌株
40 株待筛选的放线菌分离自南海中、西部不同深度(0~4500m)的沉积物样品和印度洋深海(水深>4000m)沉积物样品, 菌种保藏于中国科学院海洋微生物研究中心。紫色杆菌指示菌株CV026 由中国海洋大学宫倩红教授惠赠。
1.1.2 培养基
2216E 培养基: 蛋白胨 5.00g, 酵母粉 1.00g, CaCl21.80g, FeC6H5O70.10g, KBr 0.08g, KCl 0.55g, H3BO322.00mg, MgCl25.90g, NaCl 19.45g, Na2CO30.16g, NaF 2.40mg, (NH4)NO31.60mg, Na2HPO48.00mg, Na2SiO3·9H2O 4.00mg, Na2SO43.24g, SrCl234.00mg, 超纯水 1000mL, pH7.6, 1×105Pa 灭菌20min, 备用。加入15g 琼脂为2216E 固体培养基。
LB 培养基: 胰蛋白胨 10g, 酵母提取物 5g, NaCl 10g, 超纯水 1000mL, pH7.0, 1×105Pa 灭菌20min, 备用。加入15g 琼脂为LB 固体培养基。
1.1.3 试剂
实验所用细菌基因组 DNA 提取试剂盒(EasyPure®Stool Genomic DNA Kit)和PCR 扩增预混液(PCR SuperMix)均购于北京全式金生物技术有限公司(TransGen Biotech)。信号分子C6-HSL 和呋喃酮 C30((Z-)-4-Bromo-5-(bromomethylene)-2(5H)- furanone, C5H2Br2O2)均购于Sigma 公司。所用生化试剂均为分析纯。
1.2 方法
1.2.1 待测放线菌菌株的活化及其提取物的制备
分别将40 株海洋来源的放线菌涂布于2216E固体培养基, 在30℃培养10~12h 进行复苏。挑取单克隆菌落划线分离纯化, 将纯化菌株接种于2216E液体培养基, 30℃、180rpm 振荡培养7d, 加入等体积的乙酸乙酯溶液, 经超声清洗仪清洗10min 后萃取, 收集上层萃取液, 重复萃取3 次。将所有乙酸乙酯萃取液经旋转蒸发仪减压浓缩至干, 得到各放线菌的提取物, 用甲醇溶解成200mg·mL–1溶液, 用于QS 抑制活性菌株的筛选。
1.2.2 QS 抑制活性菌株筛选
挑取划线纯化的紫色杆菌CV026 单菌落接种于LB 液体培养基中, 30℃、180rpm 振荡培养至对数生长期(OD600≈0.7), 作为母液。配制LB 琼脂培养基100mL, 1×105Pa 灭菌20min, 待其冷却至55℃左右, 分别加入100μL 50mg·mL–1卡那霉素溶液、100μL二甲基亚砜(DMSO)溶解的0.2mmol·L–1C6-HSL 和5mL 紫色杆菌CV026 菌液, 混匀后倒平板。待平板冷却凝固后, 用打孔器打孔(6mm), 每个孔内分别均匀加入5μL 提取物, 以5μL 甲醇溶解的2mmol·L–1呋喃酮C30 作为阳性对照, 5μL 甲醇溶液作为阴性对照。将平板置于30℃培养箱中培养24h。若待测物具有QS 抑制活性, 则可以观察到相应样品的孔周围有紫色杆菌生长, 但不产生紫色杆菌素, 而是出现无色不透明的环圈。
1.2.3 菌株SCSIO 53717 提取物对紫色杆菌CV026生长的影响
挑取划线纯化的紫色杆菌CV026 单菌落接种于LB 液体培养基中, 30℃、180rpm 振荡培养至对数生长期(OD600≈0.7), 用新鲜LB 培养液稀释1000 倍, 分装为5 组, 每组3 个平行; 每组分别加入提取物, 使各组培养基中提取物的终浓度分别为0、125、250、500 和1000mg·mL–1; 30℃、180rpm 振荡培养, 每隔2h 分别测定各管OD600吸光值, 直至对数生长后期, 以检测提取物SCSIO 53717 对紫色杆菌CV026 生长的影响。
1.2.4 菌株SCSIO 53717 提取物对紫色杆菌CV026紫色菌素产量的影响
挑取划线纯化的紫色杆菌CV026 单菌落接种于LB 液体培养基中, 30℃、180rpm 振荡培养至对数生长期(OD600≈0.7), 加入与培养基体积比为 1‰的0.2mmol·L–1C6-HSL 后混匀, 分装为5 组, 每组3个平行; 每组分别加入提取物, 使各组培养基中提取物的终浓度分别为 0、125、250、500 和1000mg·mL–1; 空白对照组: 0mmol·L–1C6-HSL, 0mg·mL–1SCSIO 53717 提取物; 30℃、180rpm 振荡培养20h。紫色菌素的提取和测定方法参考相关文献(Skogman et al, 2016; Zhang et al, 2018)并作改进, 具体操作如下: 吸取 1mL 上述培养好的菌液于1.5mL 离心管中, 室温8000g 离心10min, 使紫色菌素和菌体充分沉淀, 去掉上清液; 加1mL DMSO, 涡旋振荡, 使紫色菌素充分溶解于DMSO 中, 室温8000g 再次离心10min, 使菌体及碎屑沉淀。吸取300μL 上清液转移至96 孔板中, 测定上清OD585值, 以检测提取物对紫色杆菌CV026 紫色菌素产量的影响。
1.2.5 菌株SCSIO 53717 的形态观察
将纯化的菌株SCSIO 53717 划线接种于LB 固体培养基上, 30℃培养2~3d, 观察其菌落的形状、颜色、大小等形态特征。挑取划线纯化的SCSIO 53717单菌落接种于LB 液体培养基, 30℃、180rpm 培养过夜。用接种环蘸取SCSIO 53717 菌液于载玻片上, 自然干燥后通过火焰2~3 次固定, 滴加草酸铵结晶紫染色1min, 蒸馏水冲洗, 滴加碘液覆盖1min, 吸水纸吸去水分, 滴加95%酒精脱水20s, 吸水纸吸去水分, 滴加番红染色 1min, 蒸馏水冲洗, 自然晾干, 置于显微镜下观察菌体形态特征。
1.2.6 菌株SCSIO 53717 种属的鉴定
按照细菌基因组DNA 提取试剂盒(EasyPure®Stool Genomic DNA Kit)说明书, 提取放线菌SCSIO 53717 的基因组DNA 作为扩增模板; 采用细菌16S rRNA 通用引物(27F: 5'-AGAGTTTGATCCTGGCTC AG-3'; 1492R: 3'-GGTTACCTTGTTACGACTT-5')进行PCR 扩增反应。反应条件为94℃预变性5min; 然后94℃变性30s, 53℃退火30s, 72℃延伸1min, 30个循环; 最后72℃延伸10min。PCR 扩增产物经琼脂糖凝胶电泳检测, 阳性PCR 扩增产物委托天一辉远基因科技有限公司进行测序, 所得到的基因序列经过标准菌株数据库EzBioCloud 网站(https://www. ezbiocloud.net)进行核酸序列比对分析, 获取与之最相似的模式菌株。利用 NCBI BLAST(https:// blast.ncbi.nlm.nih.gov/Blast.cgi)对菌株SCSIO 53717的16S rRNA 基因序列进行同源性比对和相似性分析; 运用MEGA 6 软件中的邻接法(Neighbor-Joining)构建生物系统进化树。
2 结果与讨论
2.1 海洋来源QS 抑制活性菌株的筛选
紫色菌素在紫色杆菌中受QS 严格调控。呋喃酮C30 是一种人工合成的QSIs——溴代呋喃酮, 能抑制紫色菌素的生成, 在固体培养基加样孔周围表现出浑浊但不透明的褪色圈(Hentzer et al, 2003)。根据 40 株海洋来源放线菌的筛选结果发现, 菌株SCSIO 52865、SCSIO 53279 和SCSIO 53717 的粗提物均具有紫色杆菌QS 抑制活性, 其中菌株SCSIO 53717 的活性最强。
将 SCSIO 53717 发酵液提取物制成 25~ 200mg·mL–1的样品, 加入平板后均显示具有QS 抑制活性, 同时色素抑制圈的直径随样品浓度增加而增加(图1), 初步表明该菌株提取物对 CV026 的QS抑制有剂量依赖性。虽然SCSIO 53717 提取物的活性与阳性对照呋喃酮C30 相比并没有优势, 但是该提取物是未经分离纯化的混合物, 其中的有效成分含量并不高, 通过对有效成分的浓缩可能将获得高活性的QSIs。如尹守亮(2011)运用紫色杆菌CV026和铜绿假单胞菌(P. aeruginosa)QS 筛选模型, 发现海洋来源的真菌QY013 提取物具QS 抑制活性, 并从中分离得到活性单体化合物 5,6-dihydro-4- methyl-2H-pyran-2-ketone。因此, 本研究发现的菌株SCSIO 53717 发酵提取物具有QS 抑制活性, 存在抑制QS 的有效成分, 具有进一步研究与开发的价值。
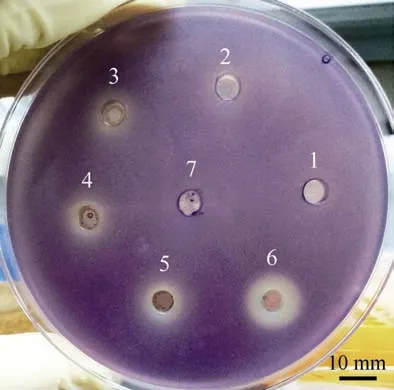
图1 SCSIO 53717 提取物抑制紫色菌素的产生 图中数字1、2、3、4、5 依次表示浓度为25、50、100、150、200mg·mL–1 的SCSIO 53717 提取物(5μL); 6 为阳性对照(加入5μL 呋喃酮C30); 7 为阴性对照(加入5μL 甲醇溶液) Fig.1 Inhibition of violacein production by SCSIO 53717 extracts. The numbers 1, 2, 3, 4, and 5 in the figure indicate the SCSIO 53717 extract (5μL) with a concentration of 25, 50, 100, 150, and 200 mg·mL–1, respectively; the number 6 is the positive control (adding 5μL of furanone C30); and the number 7 is the negative control (adding 5μL of methanol solution)
结合试样的制备过程, 还可以推测 SCSIO 53717 提取物中的QSIs 属于能和信号分子在与受体结合过程中产生竞争的小分子类物质。已有的研究表明抑制QS 系统主要有三种途径(Hoang et al, 1999; Fan et al, 2013; Horke et al, 2015): 1) 促进AHL 信号分子的降解; 2) 抑制信号分子的合成; 3) 干扰信号分子与受体蛋白的结合。本研究中, 信号分子为外源添加物, 不存在抑制信号分子产生的条件; 此外, 使用的有机溶剂提取物中一般不含大分子蛋白, 因而通过酶催化降解AHL 分子的可能性也很小。因此, 提取物中可能存在与信号分子产生竞争的小分子QS 抑制活性物质, 可以降低C6-HSL 与受体蛋白结合的几率。
2.2 菌株SCSIO 53717 提取物对紫色杆菌CV026生长的影响
本研究测试了菌株SCSIO 53717 提取物对指示菌生长的影响, 结果如图2 所示。向CV026 培养液中分别加入不同浓度的SCSIO 53717 提取物后, 培养过程中对菌密度的监测表明: 在终浓度为0~1000mg·L–1的范围内, 这些紫色杆菌CV026 的生长曲线没有明显的差异。这进一步证实了 SCSIO 53717 提取物对CV026 生长无影响, 具有典型的QS抑制活性。
该研究结果与Manefield 等(1999)报道的结果相符。许多QSIs 可以干扰病原菌的QS 系统, 抑制致病因子的正常表达, 从而产生显著的抗病效果, 但它们并不抑制微生物本身的生长, 这种抗菌机理不易对致病菌形成选择性压力而导致其产生耐药性。
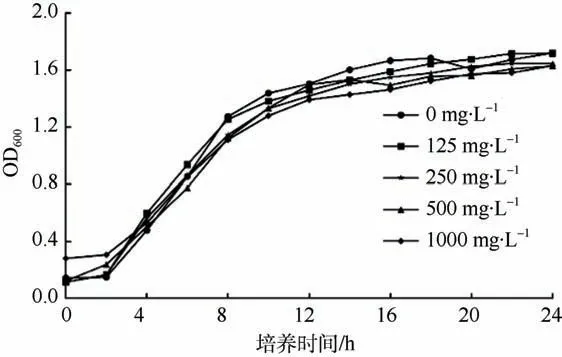
图2 SCSIO 53717 提取物对紫色杆菌CV026 生长的影响 Fig.2 Effect of extract from strain SCSIO 53717 on the growth of C. violaceum CV026
2.3 菌株SCSIO 53717 提取物对紫色杆菌CV026紫色菌素产量的影响
不同浓度的菌株SCSIO 53717 提取物对紫色杆菌CV026 紫色菌素产量的影响如图3 所示。在终浓度为0.2μmol·L–1信号分子C6-HSL 存在的情况下, CV026 紫色菌素OD585值随提取物加入量的增加而有规律地降低, 即色素的浓度依次下降, 表明菌株SCSIO 53717 提取物抑制了紫色菌素的生成, 而且抑制的强度存在明显的剂量依赖性, 与本文2.1 中的平板模型筛选结果一致。
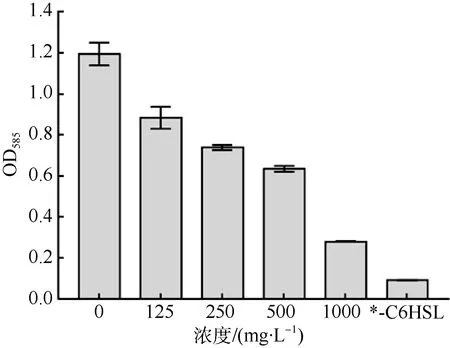
图3 不同浓度菌株 SCSIO 53717 提取物对紫色杆菌CV026 紫色菌素产量的影响 *-C6HSL 为空白对照组, 不产生紫色菌素 Fig.3 Inhibition of violacein production using extracts of strain SCSIO 53717 at different concentrations. *-C6HSL is a blank control and does not produce violacein
结合菌株 SCSIO 53717 提取物对紫色杆菌CV026 生长的影响(图2)可知, 在0~1000mg·L–1浓度范围内, 提取物并不影响紫色杆菌CV026 的生长。这进一步证明, 菌株SCSIO 53717 提取物对于紫色杆菌CV026 紫色菌素产生的抑制作用并不是通过影响紫色杆菌CV026 的生长, 而是通过干扰紫色杆菌的QS 系统实现的。
2.4 菌株SCSIO 53717 的形态特征
将菌株SCSIO 53717 划线接种于LB 固体培养基, 置于30℃生长2~3d 后的菌落形态如图4 所示。菌株SCSIO 53717 的菌落呈圆形, 直径3~5mm, 略凸, 光滑, 略带红色。革兰氏染色结果如图5 所示。菌株SCSIO 53717 属于革兰氏阳性菌, 细胞为球形, 呈现成对和成簇。根据Kumar 等(2018)对Kocuria sp. rsk4 的描述判断, 菌株SCSIO 53717 的形态结构与Kocuria sp. rsk4 相同。
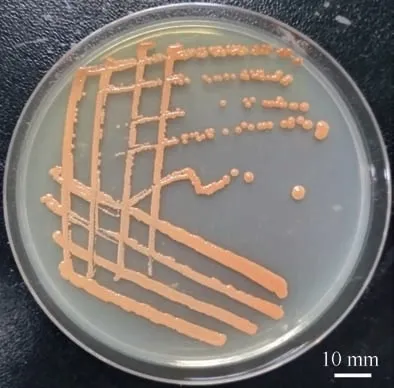
图4 菌株SCSIO 53717 的菌落形态 Fig.4 Morphological characteristics of SCSIO 53717 strain

图5 菌株SCSIO 53717 的革兰氏染色结果 Fig.5 Gram staining result of SCSIO 53717 strain
2.5 菌株SCSIO 53717 的鉴定
菌株SCSIO 53717 的16S rRNA 基因序列经EzBioCloud 网站比对, 结果显示其与Kocuria rosea DSM 20447T的相似度最高, 同源性达到99.79%。菌株SCSIO 53717 的生物系统进化树如图6 所示。SCSIO 53717 与K. oceani FXJ8.095、K. polaris CMS 76or 和K. rosea DSM 20447T聚为一支, 且与K. rosea DSM 20447T的亲缘关系最近。结合菌株SCSIO 53717 的形态特征和16S rRNA 基因序列分析结果, 可以将其鉴定为Kocuria 属。
Kocuria 是革兰氏阳性菌, 在自然界广泛存在。目前, 已有关于Kocuria 属放线菌产生抗菌物质的报道(Kumar et al, 2018), 并在该属放线菌化学成分的研究中发现了环肽、N-乙酰色胺、类胡萝卜素等物质(姚蓉 等, 2017), 但尚未出现有关该属菌株具有QS 抑制活性与QSIs 的报道。本文首次报道了该属菌株的QS 抑制活性, 说明从中发现新型QSIs 的几率较大, 这是本文认为该菌株值得深入研究的依据之一。因此, 我们拟在下一步的工作中对菌株SCSIO 53717 的提取物进行活性跟踪分离, 阐明其活性机理, 寻找海洋放线菌来源的新型QSIs。

图6 基于菌株SCSIO 53717 及其近缘属种以16S rRNA 基因序列构建的系统进化树 线段0.005 代表1/200 进化距离单位; 分支上的数值为自举1000 次的结果 Fig.6 Neighbor-Joining tree constructed showing the phylogenetic relationships among SCSIO 53717 strain and other related strains based on 16S rRNA gene sequence. Scale bar: 0.005 nucleotide substitution per 200 nucleotides of 16S rRNA gene sequence. Numerals on branches are the supporting percentage by 1000 replicates
3 结论
本文利用紫色杆菌CV026 筛选模型, 对40 株来源于海底沉积物样品的放线菌提取物进行了QS抑制活性的筛选, 发现了活性菌株SCSIO 53717, 其提取物能够抑制紫色菌素的产生, 且在有效终浓度为0~1000mg·L–1的范围内不影响紫色杆菌CV026的生长。菌种鉴定结果表明菌株SCSIO 53717 属于Kocuria 属, 这是关于该属菌种具有QS 抑制活性的首次报道。
