FTY720对肾缺血再灌注大鼠脑损伤的保护作用和机制#
2021-03-05李婷婷何冠军刘亚西赵蕾康道林涂发平
李婷婷* 何冠军 刘亚西 赵蕾 康道林 涂发平△
(1. 川北医学院第二附属医院药剂科,四川 南充 637100;2. 川北医学院药学院,四川 南充 637100;3.高坪区人民医院肾内科,四川 南充 637100;4. 川北医学院附属医院麻醉科,四川 南充 637000)
肾缺血再灌注损伤(renal ischemiareperfusion injury,RIRI)是在肾移植、肾切除等复杂肾脏手中常见的病理生理过程,是引起急性肾损伤和肾功能衰竭的重要原因之一,此过程不仅导致肾脏本身缺血再灌注损伤,还会引起远隔器官如肝、肺、脑等器官损伤[1-3],其机制主要与再灌注过程中中性粒细胞的迁移、细胞因子的表达、氧化应激的增强、巨噬细胞的集聚等有关[4-5]。
术后脑损伤是外科手术后常见的一种中枢神经系统并发症,主要表现为术后神经系统炎症及其导致的认知功能障碍等,明显影响患者术后恢复和生存质量[6]。芬戈莫德(Fingolimod,FTY720)是1-磷酸鞘氨醇(sphingosine-1-phosphate, S1P)类似物,通过激活SIP受体发挥独特的免疫调节功能,是近年来备受关注的新型免疫调节剂[7-8]。FTY720作为S1P受体激动剂,与S1P受体结合能抑制巨噬细胞向肾移植、高血压肾病、过敏性结膜炎、实验性自身免疫性神经炎、脑缺血再灌注等动物模型的相应组织浸润,减轻炎性反应[9-12]。FTY720除了作用于免疫系统外,还能稳定地穿过血脑屏障,直接作用于中枢神经系统内S1P受体而发挥多重生物学效应[13]。基于此,本研究拟通过建立大鼠RIRI模型来探讨FTY720能否改善大鼠术后脑损伤及其机制,相关的研究国内外尚未见报道。
1 材料与方法
1.1 实验动物及分组
清洁级雄性SD大鼠30只,体重 250~300g,由川北医学院实验动物中心提供,许可证号:SYXK(川)2018-18,环境温度21~25℃,自由进食、进水,采用随机数字表法分3组(n=10):假手术组(Sham)、模型组(RIRI组)和FTY720干预组(FTY720组)。
1.2 试剂与仪器
FTY720购自美国cayman公司,临用时以生理盐水配成浓度为1mg/ml注射液;Tunel试剂盒购自瑞士罗氏公司;兔源Caspase-3一抗1: 1000购自美国Abcam公司,β-actin一抗1: 1000购自美国Cell Signaling Technology公司,羊抗兔IgG二抗购自北京中杉公司,Morris水迷宫购自北京吉安得尔科技有限公司。
1.3 RIRI模型的制备及药物注射方案
大鼠术前12h禁食,不禁水,以3%戊巴比妥钠(50mg/kg)腹腔注射麻醉,皮肤消毒,经背部双侧肋弓下缘距脊柱约0.5cm处行约长1.5cm的纵行切口,钝性分离并暴露双侧肾脏,分离双侧肾蒂,切除右肾。Sham组仅暴露左侧肾蒂,不阻断;FTY720组和RIRI组大鼠采用无创动脉夹阻断左侧肾蒂,可见肾脏由鲜红变紫黑色,表示夹闭成功,阻断45min后去除动脉夹恢复肾血流。三组均以0.25%布比卡因分层浸入切口镇痛,无菌丝线逐层缝合关腹,FTY720组于再灌注前15min通过腹腔注射FTY720(1 mg/kg),Sham组和RIRI组于再灌注前15min通过腹腔注射等体积生理盐水。再灌注后经腹腔补充林格氏液(3mL/100g,每小时1次),操作过程中维持动物体温在35.5℃~37℃。
1.4 标本采集
术后24h每组随机选取5只大鼠,水合氯醛腹腔麻醉,断头取出脑组织和左侧肾脏,左侧脑组织和左侧肾脏分别置4%多聚甲醛中固定,右侧脑组织剥离海马组织后置于液氮罐保存。
1.5 HE染色观察大鼠肾脏和海马组织CA1区病理形态
大鼠肾脏组织和海马组织经浸洗、梯度酒精脱水、透明、浸蜡、包埋、切片( 4 μm) 、脱蜡、复水、染色等步骤后,于光镜下观察肾脏和海马组织CA1区的病理形态,评价其病理性损伤。
1.6 TUNEL法测定大鼠海马组织CA1区神经细胞凋亡情况
海马组织按1.5项方法石蜡包埋、切片( 4 μm) 、脱蜡、复水等步骤后,加入20 μg▪mL-1不含DNase的蛋白酶K试剂,于20~37℃下反应15~30 min,用pH7.4的磷酸盐缓冲液(PBS)清洗3次,加入TUNEL检测试剂50 μL,于37℃避光孵育1 h;用PBS清洗3次,以封闭液封片后置于显微镜下观察,记录视野中TUNEL染色阳性细胞的数量。
1.7 Western blot检测海马组织Caspase-3表达水平
从液氮中取出各组海马组织,称量、研磨、裂解、离心、提上清,BCA试剂盒进行蛋白定量。聚丙烯酰胺凝胶电泳(SDS-PAGE)将不同分子量蛋白分离,并将目标蛋白转移至PVDF膜上。caspase-3、β-actin一抗4℃孵育过夜,二抗室温孵育1h,清洗后滴加ECL化学发光试剂,曝光获取图像,使用ImageJ软件处理数据,结果以目的蛋白与内参蛋白条带灰度值比值表示。
1.8 Morris水迷宫检测大鼠认知功能
各组剩余大鼠于术后24h进行水迷宫实验,参照文献[14]。
实验指标: (1)定位航行实验,用于测试大鼠的学习能力:连续进行5 d,每天1次,分别从四个象限中点将大鼠面向池壁入水,记录每只大鼠从入水到爬上平台的时间,即为逃避潜伏期,若60 s后大鼠仍未找到平台,以60 s计算,并将其引导至平台停留10s。(2)空间探索实验,用于测试大鼠的空间记忆能力:第6 d进行空间探索实验,撤去平台,选取和平台对应的象限中点入水,记录60 s内大鼠穿越平台次数。
1.9 统计学方法
采用Spss17.0统计软件进行实验数据的分析,以均数±标准差(±SD)表示,两组间比较采用最小差异法(LSD),多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 肾脏组织的病理形态
光镜下Sham组大鼠肾组织未见明显病理改变,肾脏被膜完整,皮质和髓质分界清晰,其间可见少量炎细胞浸润;RIRI组和FTY720组大鼠肾组织出现明显病理改变,RIRI组肾脏皮质出现片状坏死,形成红色淡染的透明物质,皮质和髓质交界处肾小管和集合管灶状坏死,结构不清晰,肾小管和集合管中可见均质红染的蛋白样物质沉积;FTY720组肾脏出现局灶性坏死,肾小管上皮细胞脱落,呈均质淡红色物质,皮质和髓质交界处大量的肾小管和集合管萎缩、变性和坏死,结构不清晰,肾小管和集合管中可见粘液样物质沉积;以上结果说明大鼠肾缺血再灌注损伤模型造模成功,见图1。
2.2 海马组织CA1区病理形态
光镜下,Sham组海马神经元结构完整,排列整齐;RIRI组海马组织明显水肿,椎体细胞数量减少,细胞变性坏死,FTY720组海马病理变化较RIRI组明显改善,病理学评分差异具有统计学意义(P<0.05),见图2、图3。
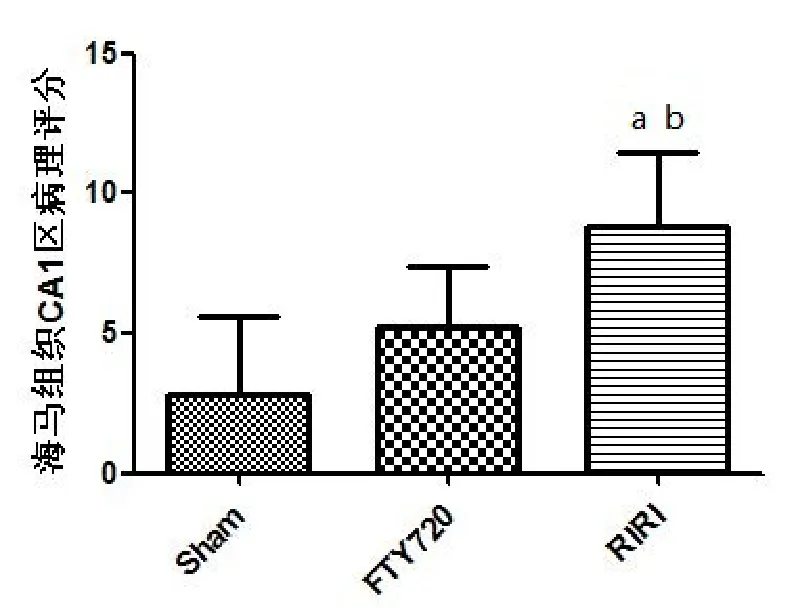
图3 各组大鼠海马组织CA1病理评分比较(n=5)
2.3 TUNEL法测定海马组织CA1区神经细胞的凋亡情况
Sham组偶见凋亡细胞,RIRI组可见较多TUNEL染色阳性,细胞核呈棕褐色的凋亡细胞;与 Sham 组比较,RIRI组大鼠大脑海马组织CA1区凋亡细胞百分比明显增加(P<0.05)。与RIRI组比较,FTY720组凋亡细胞数量明显减少,差异有统计学意义(P<0.05),见图4、图5。

图4 各组大鼠海马组织CA1 TUNEL染色阳性细胞
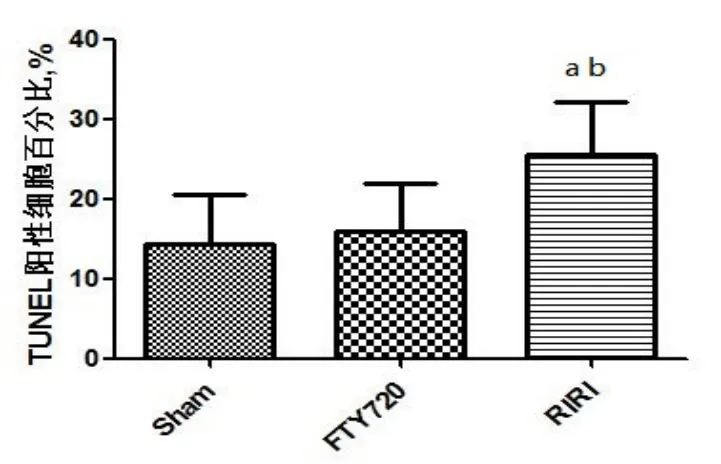
图5 各组大鼠海马CA1区TUNEL阳性细胞数量比较(n=5)
2.4 Western blot 检测海马组织Caspase-3的表达水平
与 Sham组比较,RIRI组Caspase-3水平明显增加(P<0.05);与RIRI组比较,FTY720组Caspase-3水平显著降低(P<0.05),如图6、图7所示。
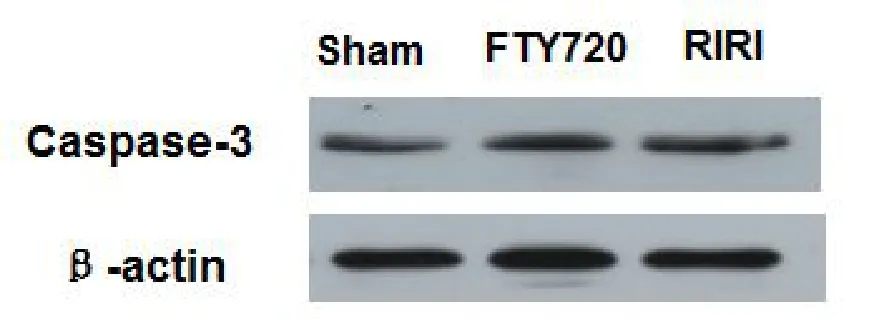
图6 各组大鼠海马CA1区Caspase-3蛋白的电泳图
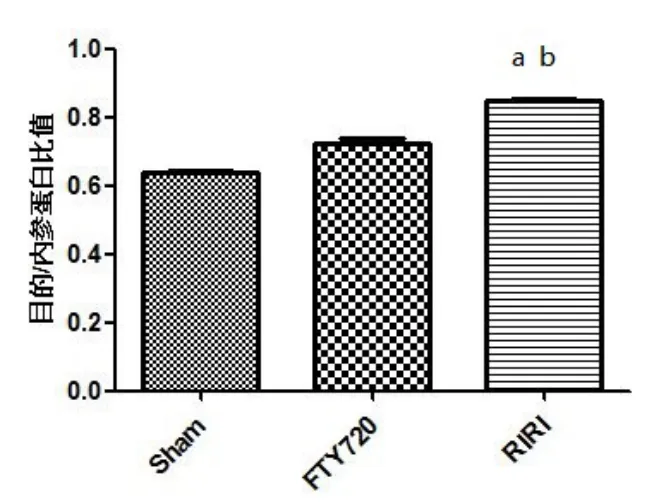
图7 各组大鼠海马CA1区Caspase-3蛋白表达水平比较(n=5)
2.5 大鼠的认知功能
与Sham组相比,RIRI组大鼠逃逸潜伏期明显延长,穿越平台次数明显减少,差异具有统计学意义(P<0.05);与RIRI组相比,FTY720组大鼠逃逸潜伏期明显缩短,穿越平台次数明显增多,差异具有统计学意义(P<0.05),见表1。
表1 各组大鼠逃逸潜伏期、穿越平台指数比较(±SD,n=5)
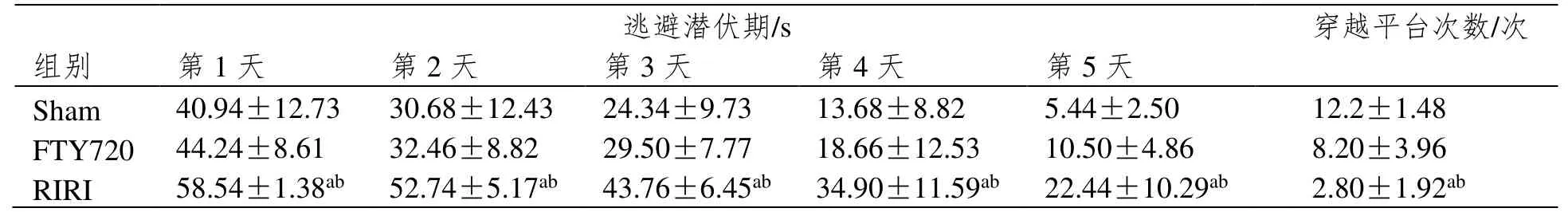
表1 各组大鼠逃逸潜伏期、穿越平台指数比较(±SD,n=5)
注:aP<0.05 vs Sham group;bP<0.05 vs FTY720 group
?
3 讨论
随着肾移植技术的不断提高,肾移植术后患者存活率不断提高,术后认知功能障碍正成为一个极其重要的临床问题。FTY720作为FDA批准的用来治疗复发-缓解型多发性硬化(MS)的口服免疫调节药物,能通过血脑屏障,可作为用于临床的具有神经保护作用的潜在药物,以减轻肾缺血再灌注对神经认知的影响。
本研究采用SD大鼠建立RIRI模型,结果显示RIRI组大鼠肾组织和海马组织CAI区出现了明显的病理损伤,同时RIRI组大鼠海马组织CA1区出现了大量的TUNEL染色阳性细胞,表明RIRI可导致大鼠海马组织CA1区神经细胞发生凋亡,表明肾缺血再灌注引起脑损伤模型造模成功。Morris水迷宫实验是目前公认的客观评价学习记忆功能的实验方法,主要用于研究海马损伤与空间学习记忆能力的关系[15],本研究采用Morris水迷宫实验研究RIRI对认知功能的影响发现,与Sham组相比,RIRI组大鼠学习能力和空间记忆能力显著降低,与Barbosa PR等人[16]的研究结果一致,提示RIRI能够引起大鼠海马组织CA1区的神经细胞损伤,从而导致大鼠认知功能障碍。术后认知功能障碍的确切机制仍不明确,其中手术创伤引起的组织损伤激活机体先天性免疫系统,导致细胞因子TNF-α、IL-6、IL-1β[17-18]等大量释放是重要原因。细胞因子能够在相对薄弱的室周区,以主动转运方式穿过血脑屏障进入大脑,细胞因子也可刺激迷走神经传入纤维,进而激活中枢炎性反应通路,上述两种途径导致中枢神经系统内小胶质细胞激活,活化的小胶质细胞进一步合成和释放TNF-α、IL-6、IL-1β,细胞因子和小胶质细胞活化共同造成中枢神经系统炎症反应,最终导致认知功能障碍。但仍有研究表明[19-20],FTY720能为病理环境中的神经元提供神经保护效应,主要是通过上调神经元细胞上Bcl-2/Bax蛋白的结合率,下调凋亡蛋白Caspase-3的表达水平,从而发挥抗细胞凋亡效应,有效改善认知功能障碍。本研究发现,FTY720组大鼠海马组织CA1区病理损伤、神经细胞凋亡数显著低于RIRI组,提示FTY720对RIRI大鼠脑组织损伤有保护作用,且水迷宫实验显示,FTY720组大鼠学习能力和空间记忆能力较RIRI组有显著改善,提示FTY720能够一定程度地改善RIRI引起的大鼠认知功能障碍。Western blot结果显示,与RIRI组相比,FTY720组大鼠海马组织CA1区Caspase-3的表达水平显著降低,提示FTY720可通过下调海马组织CA1区Caspase-3的表达从而发挥抗神经细胞凋亡的作用,与Di Menna L[20]等人研究结果相一致。
综上所述,RIRI造模大鼠可引起远隔器官脑组织的损伤和认知功能障碍,FTY720干预能显著改善大鼠RIRI引起的脑损伤和认知功能障碍,其机制可能与FTY720抑制Caspase-3的表达,从而减少海马组织CA1区神经元细胞凋亡有关。本研究为FTY720作为肾缺血再灌注引起脑损伤的潜在治疗药物提供了一定的基础。
