三氧化二砷聚乳酸纳米粒的制备及在大鼠体内药动学
2021-03-05王琪耿雪徐世一苏慧李雪莹郝若祎霍元子阎雪莹
王琪,耿雪,徐世一,苏慧,李雪莹,郝若祎,霍元子,阎雪莹
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
三氧化二砷(As2O3,ATO)为白色霜状粉末,故称“砒霜”,是中药砷的有效成分,自2000年ATO被批准作为治疗急性早幼粒细胞白血病的一线药物以来,其对各种恶性肿瘤的抗癌作用一直是人们研究的热点[1-3]。然而,由于其药代动力学差,半衰期短,给药后消除迅速[4],还有剂量限制不良反应,使它在体内对实体瘤的作用受到限制[5]。为了改善三氧化二砷的药代动力学,避免ATO的毒性和副作用,增强其抗肿瘤作用,许多新型的As2O3药物制剂也受到了广泛的关注[6]。
近年来,纳米技术于药物载体的应用,大大提高了难溶药物的溶解度;对载体材料表面功能化,使这类载体制备的制剂具有高效低毒的优点[7]。目前,许多纳米粒子(NPs)正在进行药物释放研究,包括用于癌症治疗的药物释放研究[8]。聚乳酸(PLA)是多个乳酸分子之间的羟基和羧基脱水聚合形成的高分子聚合物,可生物降解,其降解反应容易发生,最终降解产物为H2O和CO2,随代谢排出体外,不会对机体产生任何伤害。且作为药物载体材料,聚乳酸可提高药物的溶解度和生物利用度,还具有靶向作用[9]。聚乙二醇(polyethylene glycol, PEG)由于分子中含有大量乙氧基,能够与水形成氢键,因而具有良好的亲水性,经聚乙二醇修饰的药物分子可明显增加水溶性。聚乳酸经聚乙二醇修进入人体后,毒副反应更小、且能有效逃避免疫防御系统的吞嚼作用,使聚乳酸成为优良的药物载体材料[10]。
本研究以As2O3为模型药物,以聚乳酸、聚乙二醇修饰的聚乳酸为载体材料制成纳米粒,对粒径分布、Zeta 电位、体外释药等进行研究。比较游离状态和不同载体状态下的As2O3体内药动过程。为As2O3新型递药系统的构建及其在肿瘤治疗中的应用提供参考。
1 材料
1.1 仪器
原子吸收光谱仪(德国耶拿分析仪器股份公司,novAA400p);氩气钢瓶;超声波细胞破碎机(宁波新芝生物科技股份有限公司,Scientz-IID);旋转蒸发器(上海申胜生物技术有限公司,R-205B);数控恒温水浴锅(上海申胜生物技术有限公司,W202B);pH计(DELTA320,梅特勒-托利多仪器上海有限公司);纳米粒度及Zeta电位分析仪(Zetasizer Nano-ZS90,马尔文仪器有限公司);数控超声波清洗器(KQ5200DB,昆山市超声仪器有限公司);数显恒温磁力搅拌器(HJ-6A,金坛市荣华仪器制造有限公司);恒温水浴振荡器(哈尔滨市东联电子技术开发有限公司,HZS-HA型);分析天平(Sartorius BT25S,德国Sartorius公司);数控超声波清洗器(KQ5200DB,昆山市超声仪器有限公司);2K系列实验室冷冻干燥机(美国Virtis公司);智能型独立通气大鼠IVC 实验动物净化笼具(苏州市苏杭科技器材有限公司);Allegra 64R型高速冷冻离心机(美国Beckman 公司);EHD型智能电热消解仪(北京莱伯泰科仪器有限公司)。
1.2 药品与试剂
砷单元素标准溶液(样品编号:12071,中国计量科学研究院);三氧化二砷(批号:548CC888720,Merck Parmstadt);Poloxamer 188 (上海协泰化工有限公司);聚乳酸(PLA,M=15000,15011603,济南岱罡生物工程有限公司);mPEG-聚乳酸(mPEG-PLA,MPEG=3500,15062303,济南岱罡生物工程有限公司);透析袋(MW:8000-14400,美国Sigma公司);实验用水为去离子水;盐酸、抗坏血酸、硫脲为优级纯,其他试剂均为分析纯。
1.3 实验动物
SD大鼠56只,雌雄各半,体质量(200±20)g,黑龙江中医药大学GLP实验室提供。
2 方法与结果
2.1 三氧化二砷聚乳酸纳米粒包封率的测定方法
2.1.1 仪器工作条件的选择
参考文献[11]确定。电灯流:10.0 mA;光谱通带:0.5 nm;波长:193.7 nm;空气流量:13.50 L/min;乙炔流量:2.00 L/min;还原剂:1%硼氢化钠和0.3%氢氧化钠溶液(临用现配);载液:盐酸(5→100)溶液;载气:氩气(分压为0.3 MPa);背景校正:氚气。
2.1.2 标准曲线的绘制
砷标准储备液浓度为1 000 μg/mL,将其以5% HCl逐级稀释成浓度为0.10 μg/mL的砷标准工作液,精密吸取0.10、1.00、2.00、3.00、4.00、5.00 mL于10 mL容量瓶中,加入5 %硫脲-抗坏血酸溶液1.0 mL,以5%盐酸定容至刻度线,混匀,使砷浓度为1.00、10.00、20.00、30.00、40.00、50.00 μg/L,测定其吸光值,结果扣除空白溶液的吸光值。以砷浓度C (μg/L)为横坐标,扣除空白吸光值后不同浓度砷的吸光值A为纵坐标进行线性回归,得到砷的线性回归方程为:Y=0.085 6X+0.630 7,相关系数为R2=0.999 7。结果表明:砷对照品浓度在1.0~50.00 μg/L范围内与吸光度呈良好的线性关系。
2.1.3 包封率和载药量
分别精密吸取As2O3-PLA-NPs、As2O3-mPEG-PLA-NPs分散液1.00 mL,装入处理后的透析袋中,扎紧袋口,置于透析外液为200.0 mL双蒸水的烧杯中。将烧杯放入水浴振荡器中,室温、恒速(100 rmp)动态透析,在420 min时,精密吸取透析外液2.0 mL进行测定分析,测定计算纳米粒溶液中游离的As2O3量为W游,投入的As2O3为W总,同法重复3次。包封率、载药量计算公式如下:
ER (%) = (W总-W游) / W总×100 %
DL (%)= (W总-W游) / WP×100 %
公式中,ER:包封率;DL:载药量;W总:总药量;W游:游离药量;Wp:载体重量。
2.2 纳米粒制备工艺优化
2.2.1 纳米粒的制备工艺
2.2.1.1 As2O3-PLA-NPs的制备工艺
采用复乳溶剂挥发法制备纳米粒,精密称量PLA 40.00 mg,加入1.50 mL乙酸乙酯(与水相比例为1∶4),超声至完全溶解。精密吸取浓度为10.00 mg/mL的As2O3溶液100.00 μL,100 W超声60 s(超声2 s,间歇2 s),将初乳加入到6.00 mL含6%吐温20的外水相中,80 W冰浴超声60 s(超声2 s,间歇2 s)形成复乳,以旋转蒸发法除去有机溶剂,以去离子水转移至25 mL容量瓶中,定容至刻度线,即为最终样品。
2.2.1.2 As2O3-mPEG-PLA-NPs的制备工艺
采用“2.2.1.1”上述制备方法,精密称量mPEG-PLA 40.00 mg,加入2.50 mL乙酸乙酯(与水相比例为1∶3),超声至完全溶解。精密吸取浓度为10.00 mg/mL的As2O3溶液100.0 μL,100 W超声60 s(超声2 s,间歇2 s),将初乳加入到6.00 mL含3 %吐温20的外水相中,80 W冰浴超声60 s(超声2 s,间歇2 s)形成复乳,用旋转蒸发法除去有机溶剂,以去离子水转移至25.00 mL容量瓶中,定容至刻度线,即为最终样品。
2.2.2 正交实验优化制备工艺
2.2.2.1 As2O3-PLA-NPs正交实验优化制备工艺
结合前期As2O3-PLA-NPs单因素考察的结果综合来看,PLA的量( A )、As2O3的量(B)、Tween20的浓度(C)和有机相与水相的比例(D)为主要影响因素。各因素设计3个不同水平,以包封率为主要评价指标,按L9(34)正交试验设计表安排实验,筛选最优处方和制备工艺。因素水平和实验设计见表1。
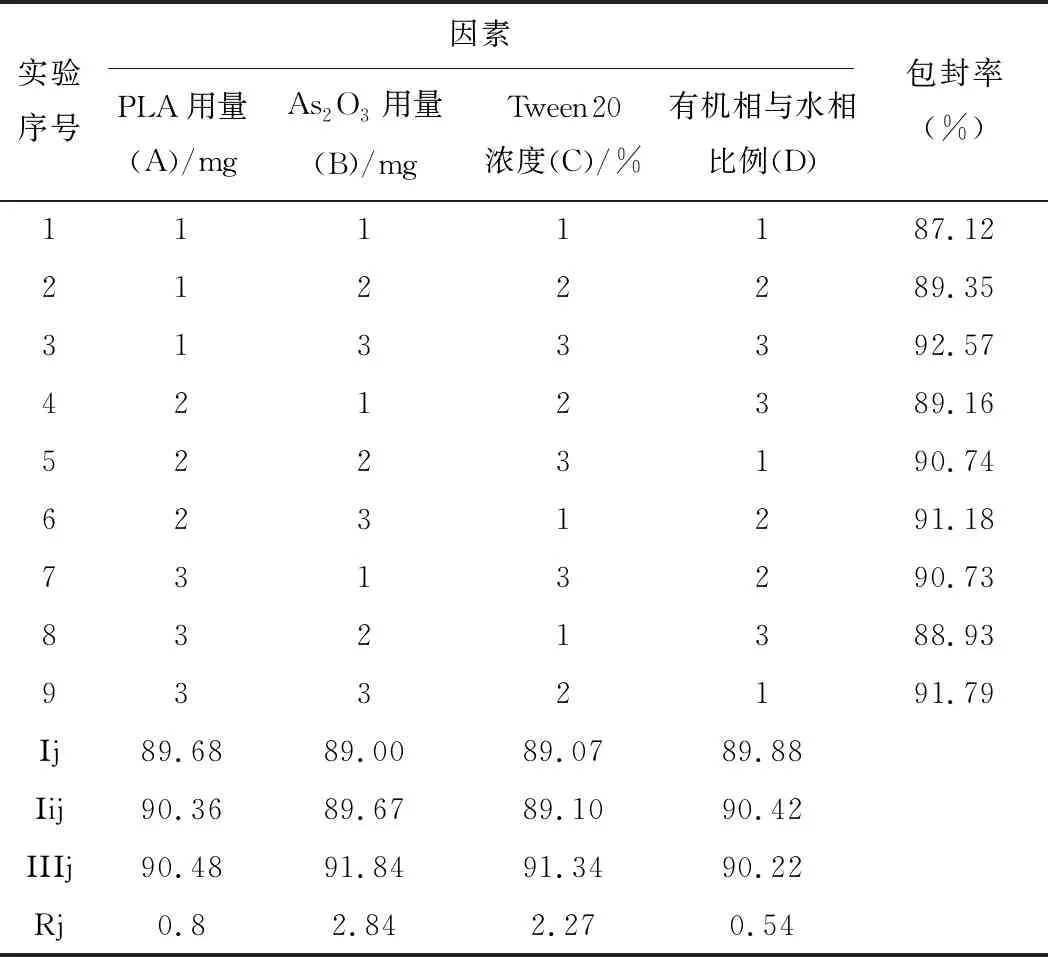
表1 As2O3-PLA-NPs正交设计结果(n=3)
根据表1中极差值Rj和方差分析(表2)可知,各因素影响的主次顺序是B>C>A>D可以得出最优处方组合为:A3B3C3D2。即PLA为40.00 mg, As2O3为3.00 mg,吐温20浓度为6 %,有机相为1.50 mL,且与水相比例为1:4。按照优化后的处方工艺制备3批As2O3-PLA-NPs,结果显示,平均包封率为91.75%,RSD=0.38%,重现性良好。
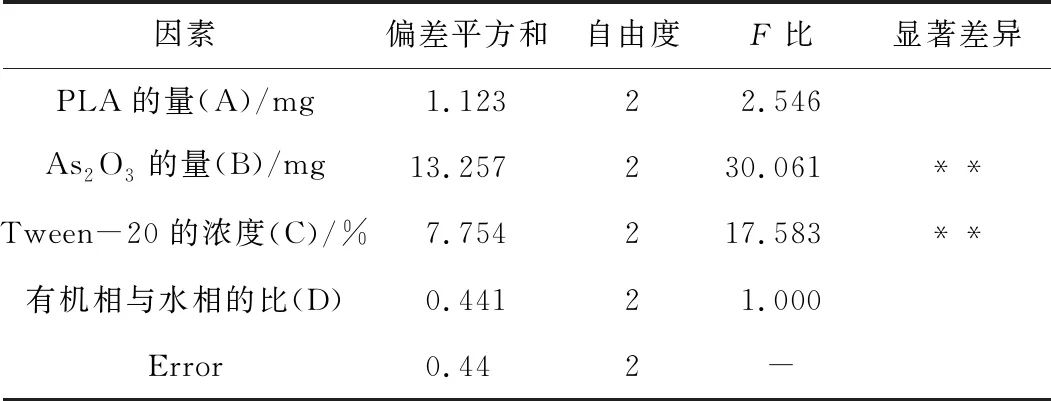
表2 As2O3-PLA-NPs方差分析结果
2.2.2.2 As2O3-mPEG-PLA-NPs正交实验优化制备工艺
结合前期As2O3-mPEG-PLA-NPs单因素考察的结果综合来看,mPEG-PLA的量(A)、As2O3的量(B)、Tween20的浓度(C)和有机相与水相的比例(D)为主要影响因素。各因素设计3个不同水平,以包封率为主要评价指标按L9(34)正交试验设计表安排实验,筛选最优处方和制备工艺。因素水平和实验设计见表3。
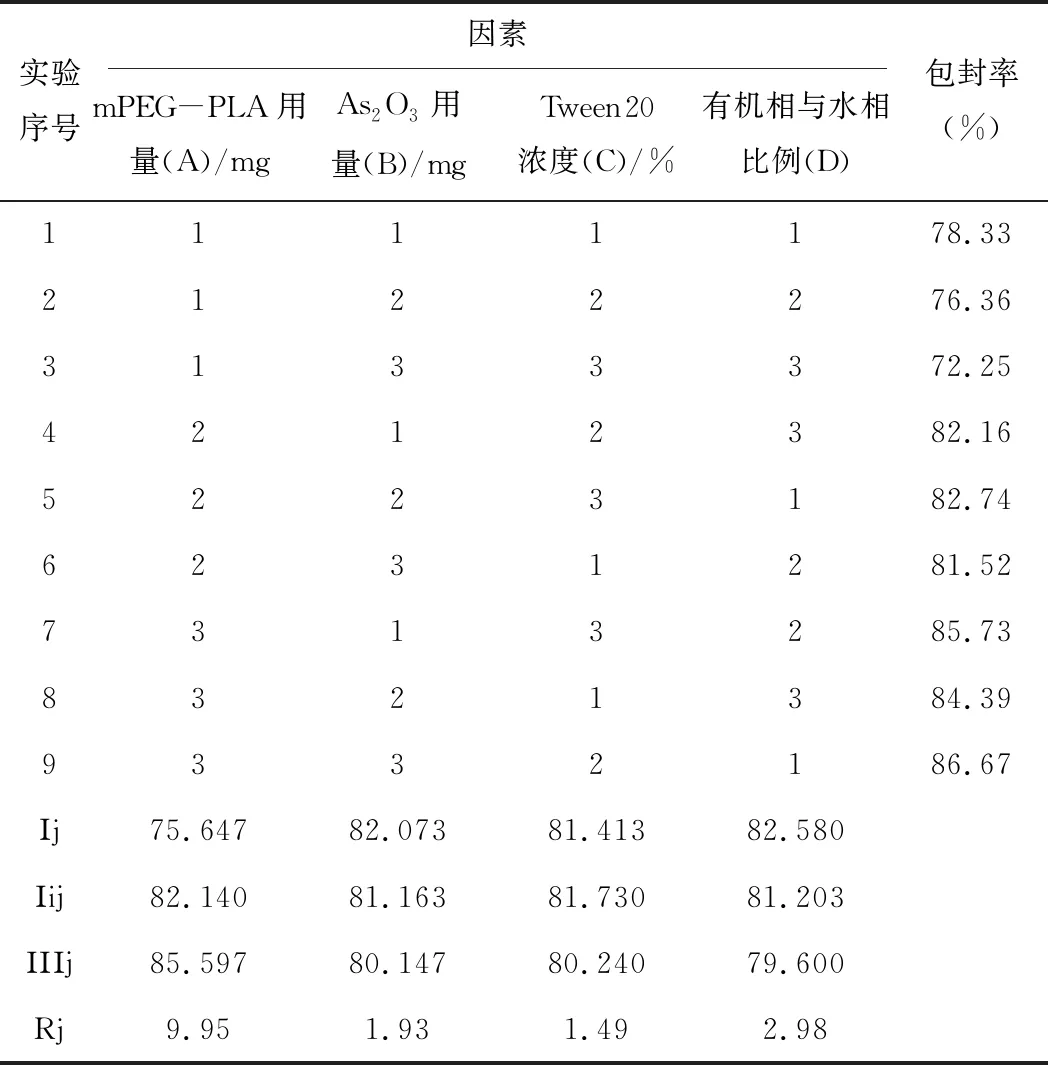
表3 As2O3-mPEG-PLA-NPs正交设计结果(n=3)
根据表3中极差值Rj和方差分析(表4)可知,各因素影响的主次顺序是A>D>B>C可以得出最优处方组合为:A3B3C2D1。即mPEG-PLA:40.00 mg;As2O3:3.00 mg;吐温20浓度为3%;有机相为2.50 mL,且与水相比例为1:3。按照优化后的处方工艺制备3批As2O3-PLA-NPs,结果显示,平均包封率为86.32%,RSD=0.54%,重现性良好。
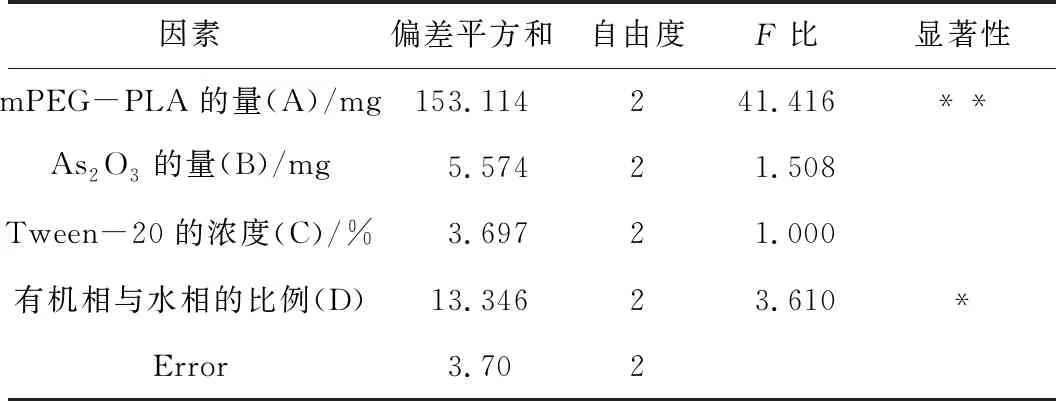
表4 As2O3-mPEG-PLA-NPs方差分析结果
2.3 三氧化二砷纳米粒冻干工艺研究
制得的纳米粒子溶液采用4 ℃的低温离心(1 000 rpm)5 min,沉淀用去离子水反复洗涤,除去游离药物,所得纳米粒沉淀用2 mL去离子水再分散。分别考察以5%乳糖、海藻糖、甘露糖、蔗糖为冻干保护剂及不加冻干保护剂的冻干样品的质量。其中纳米粒子分散液按体积比1:1加入冻干保护剂溶液。结果显示,As2O3-PLA-NPs和As2O3- mPEG-PLA-NPs均以5%甘露醇(w/v)冻干后的质量最理想,肉眼观察均为白色、疏松的固体,表面光洁细腻,振摇后能整块脱落。
2.4 三氧化二砷纳米粒基本性质
2.4.1 载药量、外观、粒径分布及Zeta电位
按照“2.1.3”项下测定方法,测得As2O3-PLA-NPs和As2O3-mPEG-PLA-NPs的平均载药量为6.88%(RSD=0.36%)和6.47%(RSD=0.62%)。取两种三氧化二砷纳米粒冻干品适量,加水轻微振摇分散,稀释后滴加在超薄碳膜上,在透射电镜下观察粒子形态并拍摄照片(图1)。结果表明,纳米粒子呈现较均匀圆形,分散性良好。采用粒径分析仪测定三氧化二砷纳米粒粒径和Zeta电位(图2)。测定结果显示,As2O3-PLA-NPs、As2O3-mPEG-PLA-NPs平均粒径为(133.20±5)nm、(123.40±6)nm;Zeta电位为-7.11 mV、-6.7 mV。
2.4.2 三氧化二砷聚乳酸纳米粒体外释药行为
取适量冻干粉(相当于0.40 mg As2O3),加2 mL去离子水,转入已处理后的透析袋中,将袋口扎紧,放入盛有200 mL释放介质的烧杯中,将烧杯放到恒温水浴振荡器37 ℃水浴中,恒速(100 rpm )振摇。分别于0、0.25、0.5、1、2、4、6、8、10、12、24、36、48、60、72 h量取1 mL释药介质,同时补入等量同温空白介质,测定各时间点的药物含量,并计算各时间点的累积释放度,绘制体外溶出曲线见图3。由结果可知,将三氧化二砷制备成纳米粒后,体外释药具有明显的缓释释药特征。
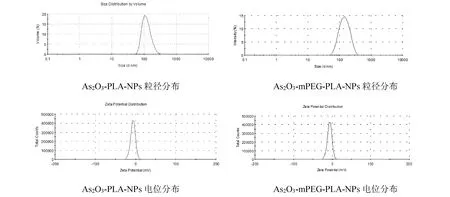
图2 As2O3-PLA-NPs和As2O3-mPEG-PLA-NPs的粒径和Zeta电位分布
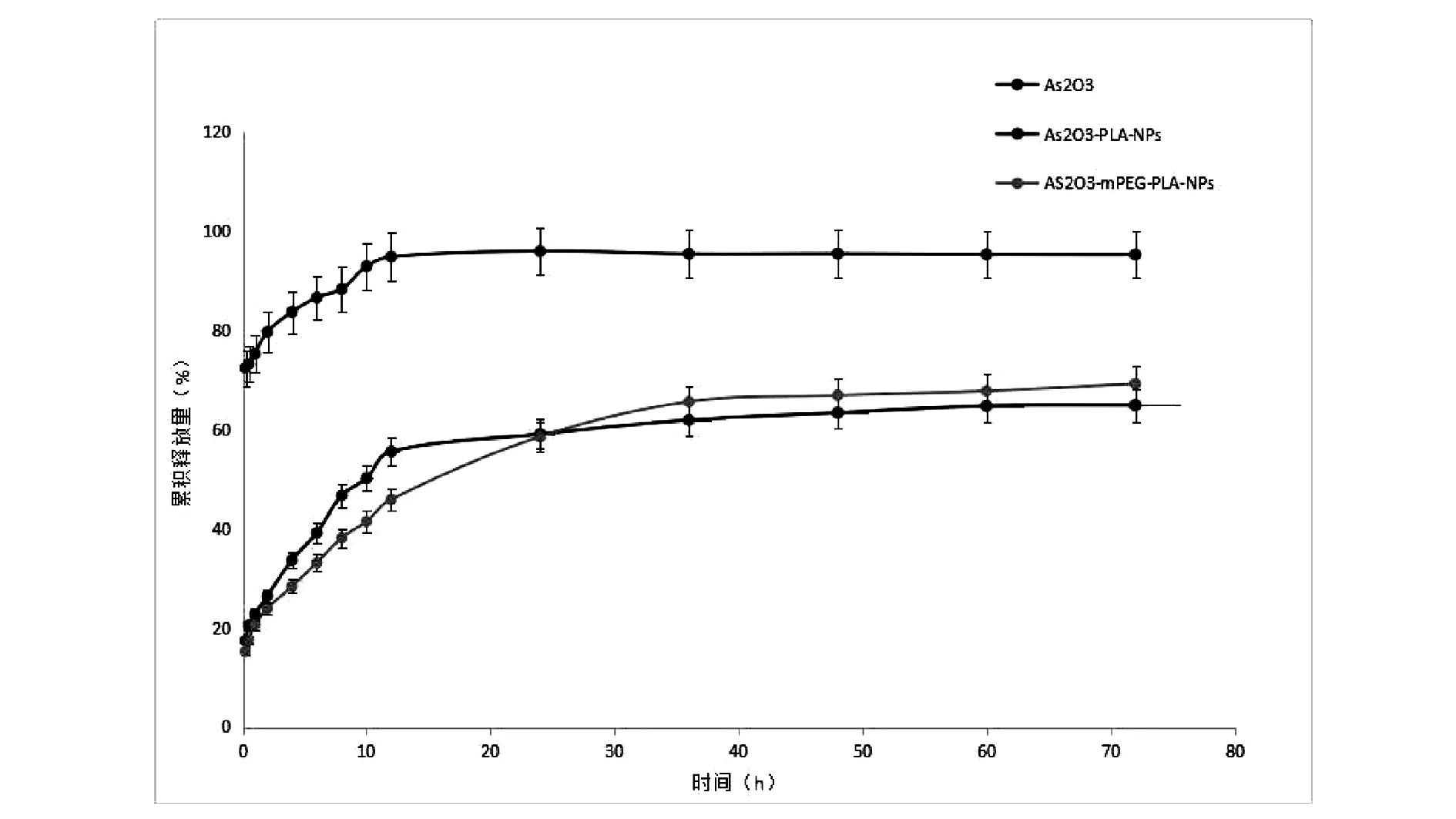
图3 As2O3、As2O3-PLA-NPs、As2O3-mPEG-PLA-NPs冻干粉针剂体外释放曲线(n=3)
2.4.3 释药模型拟合
对As2O3-PLA-NPs、As2O3-mPEG-PLA-NPs体外释药分别采用零级、一级、Higuchi 及 Weibull 模型进行拟合(表5, 6),制备的As2O3-PLA-NPs、As2O3-mPEG-PLA-NPs体外释药模型符合Weibull 模型。
Ln[ln(100/100-Q)]=0.334ln(t)-1.256 9(R2=0.969)
Ln[ln(100/100-Q)]=0.380 3ln(t)-1.445 8(R2=0.976 8)

表5 As2O3-PLA-NPs释放模型和相关系数

表6 As2O3-mPEG-PLA-NPs释放模型和相关系数
2.5 药动学研究
2.5.1 血浆样品的处理
解冻冻存血样,涡旋后离心(4 000 rpm,5 min),精密吸取上清液100 μL置于聚四氟乙烯消解罐中,加入硝酸与高氯酸的混酸(硝酸∶高氯酸=4∶1) 1.5 mL,加盖,室温下放置过夜,进行预反应,电热消解仪130 ℃进行加热消解,至冒浓烟,随时观察溶液颜色,待样品冷却至室温,转移至10 mL比色管中,同时加入硫脲-抗坏血酸1.0 mL,以5%盐酸定容至刻度线,作为样品溶液。
2.5.2 对照品溶液的配制及标准曲线的绘制
按照“2.1.2”配置砷溶液,精密吸取一系列不同浓度的砷标准溶液各100 μL,置于10 mL EP管中,精确加入100 μL的大鼠空白血浆,涡旋混匀,按照“血液样品处理”项下操作配制成相当于含砷浓度为1.00、10.00、20.00、30.00、40.00、50.00 μg/L 的标准含药血浆,进样分析,以砷吸光值为纵坐标A,以血浆中砷的药物浓度作为横坐标C (μg/L)进行线性回归,得出线性回归方程为Y=0.084 25X+0.307 2,相关系数r2=0.993。由相关系数r可知,在1.0~50.00 μg/L范围内与吸光值呈良好的线性关系。
2.5.3 方法学验证
配制成浓度为2.00、20.00、40.00 μg/L的质控样品来考察日内精密度RSD值。结果显示RSD值分别为7.29%,6.22%和5.37% (n=6)。考察3 d的日间精密度,3种浓度RSD值分别为2.93%,4.14%和8.04%(n=6)。取100 μL大鼠空白血浆样品,向其中加入浓度为0.20 μg/mL、2.00 μg/mL、4.00 μg/mL的砷标准储备液,制成质控样品,按照“2.5.1”项下方法处理血浆样品。另取100 μL大鼠空白血浆样品,按照“2.5.1”项下方法处理后,再加入低、中、高3个浓度的等量的砷标准溶液,制备成标准对照样品,相同方法测定,记录吸光值,将质控样品的吸光值与对照样品的吸光值比较,计算提取回收率,结果显示3种浓度的回收率分别为(77.26±5.33)%、(86.74±4.18)%和(80.67±6.24)%(n=3)。其中,3种浓度的 RSD值<7.16%。任取一份血浆样品,置于-40 ℃冰箱中于24 h内反复融冻,高效液相色谱测定血药浓度变化。结果显示,冰冻-溶解重复3次砷血浆样品依然稳定,RSD为9.2%,满足样品分析测定要求。
2.5.4 给药方案及样品采集
将SD大鼠随机分为7组,每组8只。称取纳米粒冻干粉适量,以生理盐水为分散介质,配制浓度分别为6.33 mg/mL和6.67 mg/mL的As2O3-PLA-NPs,As2O3-mPEG-PLA-NPs分散液。给药剂量如下:As2O3生理盐水注射组(2 mg/kg),As2O3-PLA-NPs高(3 mg/kg)、中(2 mg/kg)、低(1 mg/kg)剂量组,As2O3-mPEG-PLA-NPs高(3 mg/kg)、中(2 mg/kg)、低(1 mg/kg)剂量组。
给药前12 h禁食,不禁水,各组称重后,按剂量尾静脉注射方式对大鼠进行给药。给药前采集空白血样。尾静脉注射给药后0.25、0.5、0.75、1、2、4、6、8、10、24、36 h,大鼠眼眶取血0.5 mL,置于装有肝素钠抗凝剂的离心管中,混匀,-80 ℃冻存待测。
2.5.5 房室模型的建立
分别测定As2O3-PLA-NPs高(3 mg/kg)、中(2 mg/kg)、低(1 mg/kg)剂量组和As2O3-mPEG-PLA-NPs高(3 mg/kg)、中(2 mg/kg)、低(1 mg/kg)剂量组血浆样品血药浓度,绘制药动学曲线。药动学曲线结果见图4及表7。在As2O3同等剂量下,经尾静脉注射,比较As2O3生理盐水组和As2O3-PLA-NPs组主要药动学数据,As2O3-PLA-NPs组的消除半衰期是生理盐水组的1.52倍;药时曲线下面积明显增大,As2O3-PLA-NPs组AUC是生理盐水组的1.42倍。As2O3-mPEG-PLA-NPs组的消除半衰期是生理盐水组的2.53倍;药时曲线下面积,As2O3-mPEG-PLA-NPs组AUC是生理盐水组的2.20倍。药动学特征显示,在相同剂量下,As2O3制成纳米粒后药物在循环系统中的滞留时间明显延长,清除率降低,起到一定的缓释作用。
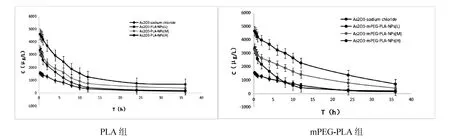
图4 PLA组和mPEG-PLA组As2O3血药浓度-时间曲线
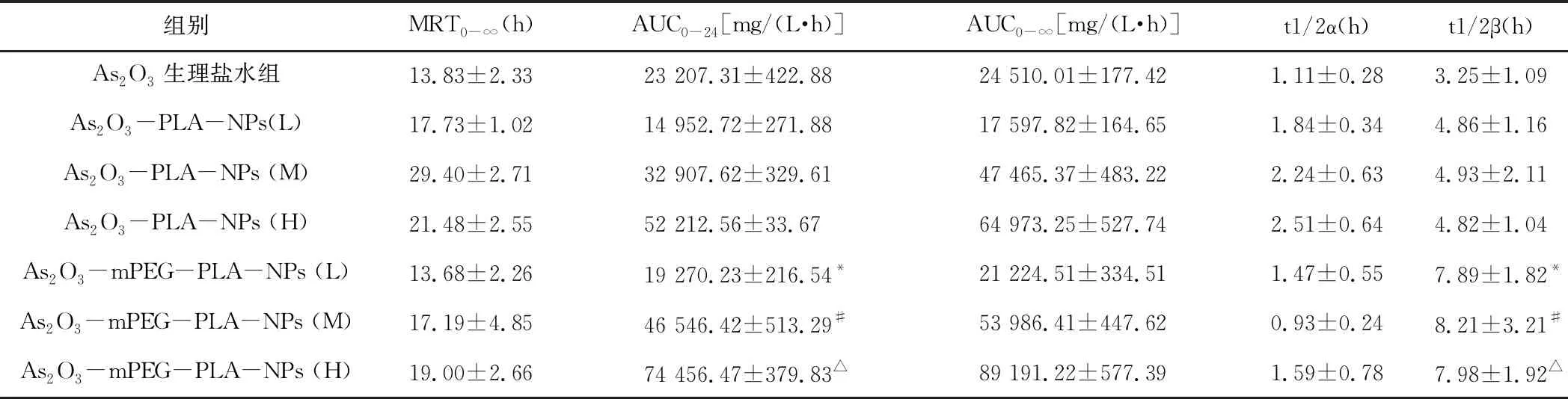
组别MRT 0-∞(h)AUC0-24[mg/(L·h)]AUC 0-∞[mg/(L·h)]t1/2α(h)t1/2β(h)As2O3生理盐水组13.83±2.3323 207.31±422.8824 510.01±177.421.11±0.283.25±1.09As2O3-PLA-NPs(L)17.73±1.0214 952.72±271.8817 597.82±164.651.84±0.344.86±1.16As2O3-PLA-NPs (M)29.40±2.7132 907.62±329.6147 465.37±483.222.24±0.634.93±2.11As2O3-PLA-NPs (H)21.48±2.5552 212.56±33.6764 973.25±527.742.51±0.644.82±1.04As2O3-mPEG-PLA-NPs (L)13.68±2.2619 270.23±216.54*21 224.51±334.511.47±0.557.89±1.82*As2O3-mPEG-PLA-NPs (M)17.19±4.8546 546.42±513.29#53 986.41±447.620.93±0.248.21±3.21#As2O3-mPEG-PLA-NPs (H)19.00±2.6674 456.47±379.83△89 191.22±577.391.59±0.787.98±1.92△
3 讨论
三氧化二砷纳米粒系采用复乳溶剂挥发法进行制备,推测形成纳米粒的过程为:将溶有三氧化砷的水相溶剂加入到溶有聚乳酸的有机溶剂中进行第一次初乳化,形成W/O型反胶团,再加入含表面活性剂的外水相中,进行第二次乳化,形成W/O/W型复乳,旋转蒸发除去有机溶剂得到纳米粒[11]。在此过程中,乳化充分、超声时间、超声功率是形成均一纳米粒的关键,通过对制备条件的优化,最终选用复乳溶剂挥发法制备纳米粒,得到As2O3-PLA-NPs、As2O3-mPEG-PLA-NPs平均包封率为91.75%、86.32%和平均载药量为6.88%、6.47%的最佳的纳米粒。虽然在mPEG-PLA和PLA中聚乳酸分子量相同,但是由于每批原料差异和工艺技术的原因,不能保证分子量完全相同,而这直接导致相同工艺下,两组纳米粒的粒径可能相差甚远,而粒径的差异,会直接影响纳米粒的体内外释放及对肿瘤细胞的作用,故本部分实验的重点,是通过工艺技术,得到两组粒径相近、包封率较好的纳米粒。通过比较不同复乳超声时间、超声功率以及调整油相比例发现,虽然超声时间和功率能在一定程度上影响粒径,但对包封率影响较大,而随有机相比例增加,纳米粒粒径变化显著。这是因为,当聚合物浓度低时,有机相黏度低,表面张力较小,分散速度比较快,有利于有机相快速扩散和挥发除去,因此得到的纳米粒粒径变小[12]。实验过程中发现,纳米粒溶液在室温放置长时间,会引起沉降,影响纳米粒稳定性,故采用冻干法,制备成冻干粉,可提高纳米粒稳定性。
本实验制备的三氧化二砷纳米粒粒径分布均匀,体外释药模型符合Weibull模型。体内药动学结果显示,在相同剂量下,As2O3制成纳米粒后药物在循环系统中的滞留时间明显延长,清除率降低,起到一定的缓释作用,改善药物体内生物过程[13]。本研究成功制备了形态均匀、包封率较高、具有良好生物相容性的三氧化二砷纳米粒,为三氧化二砷的后续开发及研究拓宽了思路并提供了试验依据。
