巨噬细胞ABCG1介导的氧化固醇外流的研究
2021-03-05刘平原沈思琪武燕翔陈连凤严晓伟
刘平原 沈思琪 武燕翔 陈连凤 严晓伟
100730 中国医学科学院 北京协和医学院 北京协和医院心内科
动脉粥样硬化(atherosclerosis,AS)以内皮下脂质蓄积、粥样斑块形成及动脉管腔狭窄为特征,可引起冠心病、脑梗死、外周血管病等一系列疾病,是世界范围内最常见的疾病和死亡原因[1]。ABCG1是跨膜半转运体,在巨噬细胞中高表达并介导胆固醇外流,对体内脂质代谢稳态有重要作用。本课题组前期临床研究提示人类巨噬细胞ABCG1的表达可能具有促AS作用[2],其机制尚待进一步研究。近来研究发现氧化固醇,如7β-羟基胆固醇(7β-hydroxycholesterol,7β-OHC)和7-酮基胆固醇(7-ketochlesterol,7-KC)等[3],与AS的发生发展关系密切[4]。本实验通过构建ABCG1敲低单克隆稳转株,测定其氧化固醇外流情况,以探究ABCG1影响AS发生发展的相关机制。
1 材料与方法
1.1 材料
THP-1细胞(ATCC细胞库),RPMI1640培养基、FBS(GIBCO公司),引物(上海生物工程公司),慢病毒表达载体、DH5α、转染试剂LipofectAMINE2000、NBD-胆固醇(Invitrogen公司),DNA连接酶、限制性内切酶、反转录酶(Fermentas公司),质粒抽提试剂盒(Qiagen公司),兔抗人ABCG1抗体(Abcam公司),兔抗人GAPDH抗体、辣根过氧化物酶偶联IgG(中杉金桥生物公司),PMA、HDL(Sigma公司),ox-LDL(北京协生生物公司),质粒测序由Invitrogen公司完成。
1.2 稳转株构建
根据ABCG1基因序列设计shRNA oligo,将其连接到pGMLV-SC5RNAi载体构建慢病毒重组质粒,选取测序正确的质粒进行病毒包装;按照MOI=80利用慢病毒感染THP-1细胞,经有限稀释法筛选出稳定敲低细胞株;提取稳转株细胞总蛋白,并进行Western blot鉴定ABCG1表达。ABCG1 shRNA上游序列5’-gatccGGACCTGCTGAATGGACATCTT TCAAGAGAAGATGTCCATTCAGCAGGTCCTTTTTTg-3’,下游序列5’-aattcAAAAAAGGACCTGCTGAA TGGACATCTTCTCTTGAAAGATGTCCATTCAGCAGG TCCg-3’。阴性对照上游序列5’-gatccGTTCT CCGAACGTGTCACGTTTCAAGAGAACGTGACACGTT CGGAG-3’,下游序列5’-aattcACGCGTAAAAAA GTTCTCCGAACGTGTCACGTTCTCTTGAAACGTGAC ACGTTCGGAGAACg-3’。
1.3 巨噬细胞氧化固醇外流测定
1.3.1 细胞处理及样本收集 THP-1细胞以3×105/孔的密度接种于24孔板,以100 ng/ml PMA促进巨噬化。72 h后更换培养基,以无血清培养基饥饿8 h,以50 μg/ml 氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)干预。24 h后,PBS洗涤细胞三次,加入50 μg/ml 高密度脂蛋白(high-density lipoprotein,HDL)作为外流接受体诱导外流4 h,并设置空白对照组。收集外流液,12 000 rpm离心10 min,去除细胞碎片。PBS洗涤细胞三次,每孔加入10%甲醇水溶液+1%乙酸处理细胞5 min,收集裂解液。向外流液与细胞裂解液中加入3倍体积沉淀剂沉淀蛋白,10 000 rpm离心10 min,取5 μl进行脂质分析。
1.3.2 样本分析 通过LC-MS/MS(DIONEX Ultimate 3000超高效液相色谱仪 Thermo Q EXACTIVE)进行样本分析。将收集到的样本经ACQUITY BEH C18色谱柱分离 (1.7 μm,2.1×50 mm)。随后进行一个从70%水-30%乙腈到100%乙腈的8 min梯度洗脱,设定流速为0.25 ml/min。采用电喷雾正离子源,以二级数据依赖性扫描的检测模式,对样本进行定性与定量分析。7β-OHC和7-KC标准品绘制标准曲线用于样本定量。
1.4 统计学方法
2 结果
2.1 ABCG1基因小干扰RNA慢病毒表达载体构建及稳转株ABCG1蛋白表达情况
转染后,细胞内可观察到明显的荧光,表明目的质粒转染正常,目的质粒荧光标记基因表达正常(图1);ABCG1敲低组(ABCG1-sh)ABCG1蛋白表达水平(0.173 5±0.034 35,n=3)明显低于阴性对照组(0.755 6±0.044 54,n=3),差异有统计学意义(P<0.001),见图2,提示ABCG1稳定敲低细胞株构建成功。
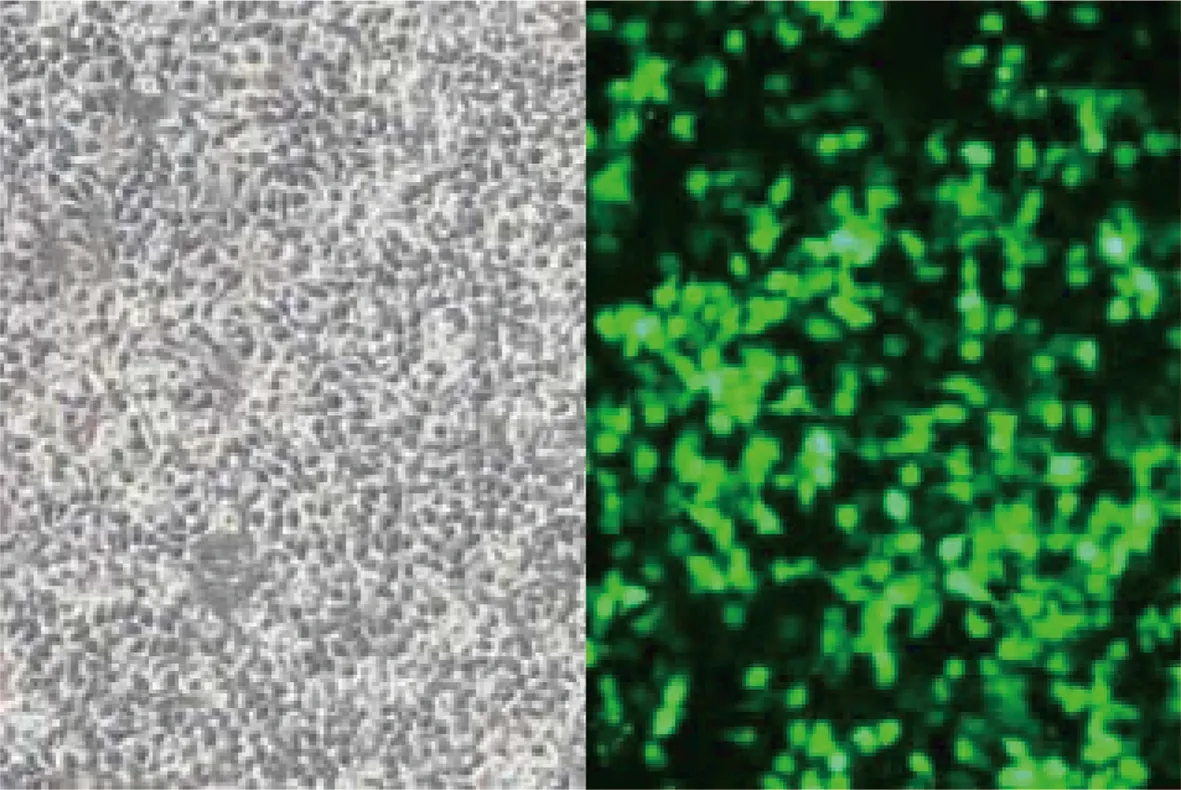
图1 转染后细胞荧光观察
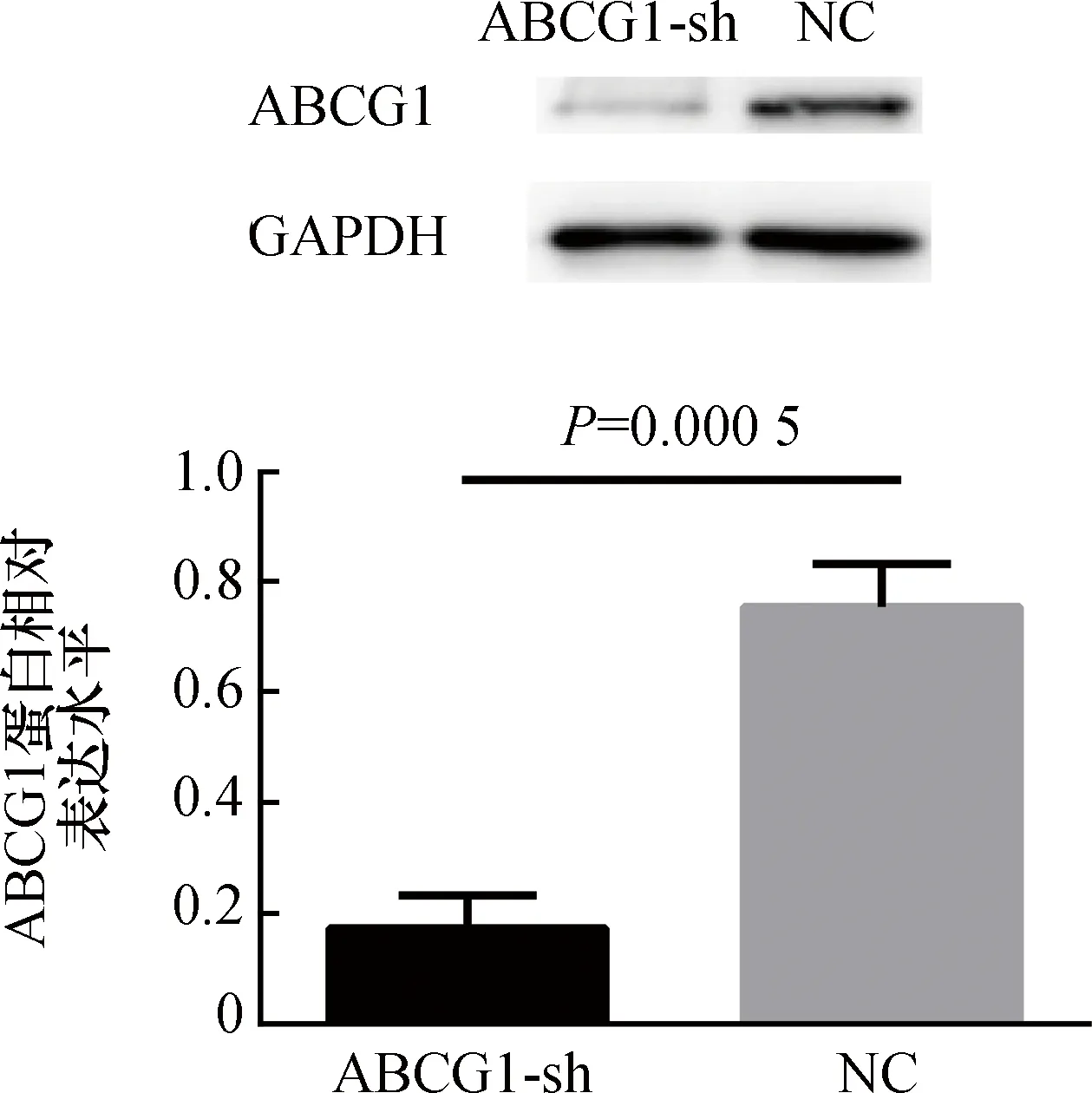
图2 各组细胞ABCG1蛋白水平
2.2 ABCG1低表达对氧化固醇外流率的影响
通过LC-MS/MS技术对待测样品进行了氧化固醇定性与定量分析,发现与无外流接受体的空白对照组相比,HDL作为外流接受体的组别,诱导氧化型胆固醇外流率增加(7-KC:28.6%±2.3%比4.1%±0.7%,P<0.001;7β-OHC:35.5%±5.7%比3.7%±1.1%,P<0.001),见图3A。与阴性对照组相比,ABCG1敲低组氧化型胆固醇的外流率降低(7-KC:16.1%±3.1%比24.7%±2.3%,P<0.05;7β-OHC:15.7%±0.7%比33.1%±3.7%,P<0.001),见图3B。
图3 巨噬细胞氧化固醇外流率
2.3 ABCG1低表达对巨噬细胞胞内氧化固醇沉积的影响
胞内氧化固醇沉积量通过细胞总蛋白进行校正,结果显示,与对照组比较,ABCG1低表达巨噬细胞胞内氧化固醇沉积增加[7-KC:(6.61±1.28)μg/mg比(2.13±0.08)μg/mg,P<0.05;7β-OHC:(1.61±0.51)μg/mg比(0.65±0.20)μg/mg,P<0.05],见图4。结合图3结果表明巨噬细胞ABCG1低表达可抑制氧化固醇7β-OHC及7-KC外流,增加胞内氧化固醇沉积。
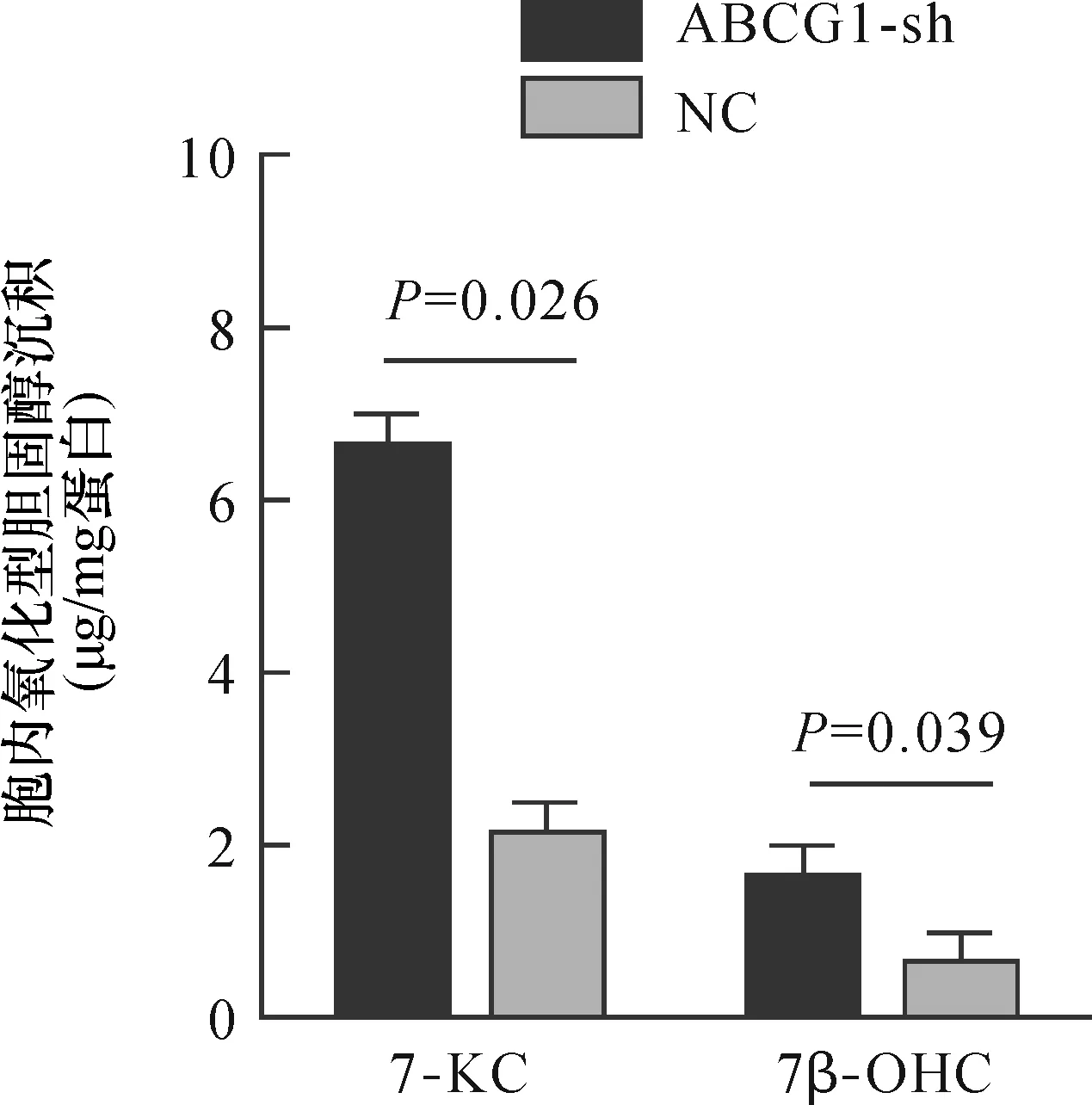
图4 巨噬细胞胞内氧化固醇沉积
3 讨论
巨噬细胞摄取ox-LDL形成泡沫细胞是AS的早期病理标志[1]。构建ABCG1敲低巨噬细胞模型可为ABCG1及AS的研究创造条件。本课题组前期通过嘌呤霉素筛选法构建了ABCG1敲低混合稳转株,其是由多个单克隆稳转株构成的克隆群。因其外源片段的整合位点不同,不同的单克隆表达效率不同[5]。此外,由于体外细胞多属于病胞系,其基因组呈现不确定的特点,即使是同类细胞,不同细胞个体基因组背景都存在差异。因此,本研究对前期ABCG1敲低细胞模型的构建进行改进,通过有限稀释法获得了ABCG1敲低单克隆稳转株,其为含有稳定整合外源片段的单个细胞的扩增,ABCG1的表达效率稳定,且基因组背景相对单一,可去除细胞群体的干扰因素,进一步减少实验结果的干扰因素。
本课题组前期研究结果发现,ABCG1低表达巨噬细胞促凋亡基因Bok与Bid表达增高[6],细胞凋亡加快。结合本实验结果,其可能与ABCG1介导的氧化固醇外流密切相关。本研究中,我们发现ABCG1低表达的巨噬细胞7-KC及7β-OHC外流减少,胞内氧化固醇沉积增加。氧化固醇由胆固醇通过酶催化氧化途径及非酶催化氧化途径形成,在单核细胞/巨噬细胞中沉积可诱导细胞凋亡[7]。Tesoriere等[8-10]发现,当7-KC及7β-OHC与巨噬细胞共孵育时,细胞氧化性DNA损伤增加,p21、Bax及细胞色素C表达水平增强,线粒体凋亡途径激活,细胞凋亡增加。
巨噬细胞ABCG1在胆固醇逆转运中发挥重要作用,而其对AS的作用,在多项动物及临床研究中结果并不一致,目前仍存在争议[11]。Tarling等[12]发现ABCG1基因敲除小鼠AS病变区域巨噬细胞凋亡增加,粥样斑块体积缩小。以上研究及本实验结果提示我们,巨噬细胞ABCG1低表达造成胞内氧化固醇堆积,加速细胞凋亡,可能是ABCG1低表达抗AS的相关机制。
利益冲突:无
