PolyI:C刺激豚鹿(Axis porcinus)外周血淋巴细胞转录组分析
2021-03-05隋维恺杨茜茜冷思竹严慧娟陈维刚杜小刚
隋维恺, 高 艳,杨茜茜,冷思竹,严慧娟,屈 羽,陈维刚*,杜小刚*
(1.四川农业大学生命科学学院,四川雅安 625014;2.成都动物园成都市野生动物研究所,成都 610081)
豚鹿(Axis porcinus)隶属于哺乳纲(Mammalia)偶蹄目(Artiodactyla)鹿科(Cervidae)斑鹿属(Axis)。主要分布于云南西部靠近中缅边境的耿马、西盟两县的南丁河沿岸。多栖息于草地平原、沿海草地、森林、山地等地带。1975年被《濒危野生动植物种国际贸易公约(CITES)》列入附录Ⅰ[1]。2008 年,世界自然保护联盟(IUCN)将豚鹿收录到受威胁物种红色名录并列为濒危(EN)等级[2]。目前国内仅有北京动物园、上海动物园和成都动物园三家机构有圈养的豚鹿,其中,成都动物园饲养数量占总数的80%以上[3]。豚鹿种群复壮在野生动物保护中起到重要作用,但人工繁育的豚鹿幼崽存活率很低,主要原因是病原微生物感染引起肺炎和心肺功能衰竭而导致死亡[4]。疾病已经严重影响豚鹿幼仔的存活,进而严重影响豚鹿种群的发展[5]。随着生物学技术的迅猛发展,运用新的技术手段探究野生动物的抗病毒机制已经成为未来的发展趋势[6],为野生动物疾病预防提供了新的研究思路。
双链 RNA(double-stranded RNA,dsRNA)病毒是RNA病毒中的一大类群,其宿主范围广[7]。聚肌胞苷酸(Poly I:C)是人工合成的双链RNA[8]。Poly I:C 能够模拟病毒感染后所形成的双链RNA,刺激宿主产生免疫反应[9]。因此被广泛应用于病毒引起的宿主免疫应答的研究中。外周血淋巴细胞具有易于分离,对动物伤害小等特点常被用作基因表达分析的样本来阐述免疫问题,例如病毒-宿主交互、免疫性状的生物标记[10-11]等。
转录组测序(RNA-seq)是指通过新一代高通量测序技术,对样品中的所有RNA及整个转录组进行整体测序,计算出不同mRNA的表达量[12]。Illumina测序属于新一代测序技术适用于研究基因组不明确的物种的基因表达[13],具有测序通量大、准确性高、成本低等优势[14]。RNA-seq技术的大规模应用,使得非模式生物在基因组层面基因表达变化的研究有了快速的发展。目前转录组测序技术已经在野生动物保护与利用等相关研究中被广泛使用。如通过转录组测序技术揭示了大熊猫的微卫星位点多态性,筛选出与状态特有生理相关的潜在分子标记[15];利用转录组测序技术分析了嗜水气单胞菌感染后齐口裂腹鱼免疫相关基因的表达情况[16]。目前利用转录组测序技术分析豚鹿的抗病毒免疫机制的研究尚未见报道。
本研究利用转录组测序技术对Poly I:C刺激后的豚鹿外周血淋巴细胞进行测序分析,发现Poly I:C能够引起基因的差异表达。对差异基因进行富集分析,进一步筛选出免疫相关基因,并使用qPCR方法对转录组数据的准确性进行了验证,为后续豚鹿抗病毒免疫机制的研究奠定了基础。
1 材料和方法
1.1 材料与试剂
Ficoll Plus细胞分离液,北京索莱宝科技有限公司;PolyI:C,上海西格玛奥德里奇有限公司;Trizol RNA提取试剂,美国Thermo公司;primescriptTMRT reagent kit反转录试剂,大连宝生物有限公司;SYBRgreen II荧光染料,美国Bio-rad公司;试验所用引物由北京擎科有限公司合成。
1.2 仪器与设备
Nanodrop-2000超微量核酸蛋白测定仪,美国Thermo Scientific公司;CFX96型荧光定量PCR仪,美国Bio-Rad公司;ChemiDocTM XRS+型凝胶成像系统,美国Bio-Rad公司。
1.3 试验方法
1.3.1 样品采集和处理
6只成都动物园内圈养的雄性豚鹿,分别无菌收集抗凝血10 mL。按照Ficoll Plus细胞分离液说明书分离淋巴细胞,分离后的细胞用L-15完全培养基(含10% Gibco血清、150 U/mL青霉素及150 μg/mL链霉素)重悬,计数后按照每孔3×105个细胞的密度平均铺在6孔板中,分为PolyI:C组和PBS对照组,每组三个重复。无菌适应性培养 6 h。Poly(I:C)组加入 Poly(I:C)的 PBS 溶液,终浓度为 10 μg/mL;对照组加入等体积无菌PBS溶液。置于37℃的CO2培养箱中培养6 h后收集细胞并平均分成两份,其中一份样品加入1 ml Trizol吹打混匀后置于-80℃储存备用,此样品用于转录组测序。另一份样品按照Trizol方法[17]提取总RNA,使用NanoDrop2000和琼脂糖凝胶电泳法检测RNA的纯度和质量后于-80℃保存用于qPCR验证。
1.3.2 测序文库的构建和Illumina测序
总RNA质量达到建库要求。转录组文库构建和测序工作由北京诺禾致源科技有限公司完成。测序平台为Hiseq,测序策略为PE150。
1.3.3 测序数据处理
原始测序序列(raw reads)按照Cellerino的方法[18]进行过滤,进而得到clean reads。采用Trinity法[19]对过滤后的数据进行拼接。取每个基因中最长的转录本作为该基因的代表[20]进行后续的分析。
1.3.4 基因的功能注释
基因功能注释数据库包括:Nr、Nt、Pfam、Swiss-Prot、KEGG/KO、COG/KOG 和 GO[21]。
1.3.5 差异表达基因分析
利用RSEM[22]计算出每个unigene的表达水平,并以FPKM值[23]表示。随后进行差异分析,筛选阈值为 log2(fold change)|≥1,P-Value<0.05,并绘制火山图以直观地展现差异表达基因(DEGs)。
1.3.6 免疫相关差异表达基因的筛选
结合注释信息筛选免疫相关的差异表达基因[24]。利用HemI软件[25]绘制免疫相关DEGs热图。
1.3.7 qPCR验证
将1.3.1所述用于qPCR验证的RNA样品按照TAKARA公司反转录试剂盒方法合成cDNA,利用SYBRgreen II荧光染料进行实时荧光定量PCR实验,反应体系见表1。qPCR条件为95℃,3 min;95℃,5 sec、引物退火温度,30 sec、39个循环;95 ℃,10 sec;65℃~95℃,每0.5℃恒温5 s检测溶解曲线。本试验所用引物见表2。

表1 qPCR反应体系Table 1 Reaction system of qPCR

表2 用于免疫相关DEGs qPCR验证的引物Table 2 Primes used for qPCR validation of immune-related DEGs
2 结果与分析
2.1 测序数据统计与评估
对照及Poly I:C处理组的测序始测序序列(Raw reads)都在4 600万条以上。经过滤后,各组得到的Clean reads的量占Rawreads的比例都达到了96%以上。各样品Q20均在97%以上,Q30百分比均超过93%,CG含量在53.08%以下(表3)。

表3 测序数据输出质量情况Table 3 The quality of reads
2.2 转录组拼接及基因功能注释
经过混合拼接后,转录本(transcript)及单基因(unigene)长度分布情况如图1所示。共获得了252 783条转录本和121 204个unigenes,有77 790条转录本超过2 000 bp,30 170条unigene长度超过1 000 bp,转录本平均长度为1 959 bp,N50=4 131,单基因平均长度为 1 121 bp,N50=2 000(表 4)。

表4 拼接长度分布情况Table 4 The distribution of splicing length bp

图1 转录本及unigene拼接长度分布情况Figure 1 Distribution of transcript and unigene splice length
Unigenes在7个数据库中成功注释,45 352个unigene在Nr中成功注释,在Nt数据库中成功注释了117 078个unigene,有8 296个unigene成功注释在swiss-prot数据库中;有23 171和7 710个unigene分别成功注释在GO和KEGG数据库中(图2)。

图2 Unigene在各个数去库中的注释情况Figure 2 Unigene annotations in database
共计2 488个unigene在所有数据库中均成功被注释,117 722个unigene至少在一种数据中被成功注释,但有3 482个unigene并未成功注释(表5)。基因功能注释是对比多个物种的基因信息完成的(图 3)。

图3 注释所用参考物种分类情况Figure 3 The speciation and proportion of annotation

表5 注释情况统计Table 5 The statistics of success rate of annotation
2.3 差异表达基因分析
差异表达基因分析共挖掘出402个差异表达基因(252个显著上调和150个显著下调),其余基因未出现显著变化(图 4)。

图4 差异表达基因的火山图Figure 4 Volcano plot of differential expressed genes
2.4 差异基因GO及KEEG富集分析
GO富集分析将所有差异表达基因富集到生物学过程(biological process,BP),细胞组分(cellular component,CC)和分子功能(molecular function,MF)三大类别中,在生物学过程中,免疫反应(immune response)和免疫过程(immune system progress)等出现较高比例的富集(图5)。KEGG富集分析将差异表达基因富集到各种信号转导通路中,其中Tolllike receptors信号通路和RIG-1-like receptors信号通路等出现大量富集(图6)。

图5 差异表达基因GO富集分析Figure 5 Gene Ontology enrichment analysis of DEGs

图6 DEGs的KEGG富集分析Figure 6 KEGG enrichment analysis for DEGs
2.5 免疫相关差异基因分析
基于功能注释和富集结果,共筛选到28个免疫相关基因,利用HEMI软件将两组的免疫相关基因绘制热图,以直观显示二者变化差异(图7)。

图7 免疫相关DEGs热图Figure 7 Heat map of immune-related DEGs
2.6 qPCR验证
随机选取9个免疫相关基因进行实时荧光定量分析,以验证转录组测序数据的准确性。结果表明,Poly I:C刺激后所选的9个基因均出现不同程度的应答,与转录组数据相符(图8)。
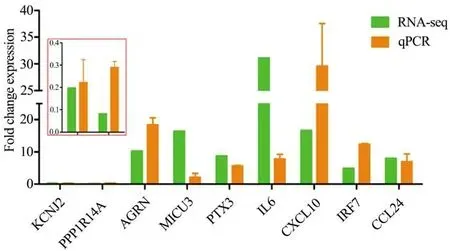
图8 免疫相关DEGs在转录组数据和qPCR数据中的表达水平Figure 8 Comparison of the fold change expression of DEGs by RNA-seq and qPCR
3 讨论与结论
豚鹿是中国国家Ⅰ级重点保护的野生动物,其基因组信息尚未公布[26]。本研究对Poly I:C刺激后的豚鹿外周血淋巴细胞进行了无参转录组测序。转录组测序数据质量主要从碱基测序错误率(Q20和Q30分别表示测序错误率为1%和0.1%的碱基比例)和碱基分布情况进行评估[27]。本次测序共获得318 259 890 bp的原始数据,过滤后得到的clean reads占原始数据的97.80%,Q20和Q30均占较高比例,且CG含量较低。组装后的转录本及unigene长度均大于300 bp,说明测序建库及拼接工作质量良好,具有较高的可信度。在基因功能注释方面,共有117 722条unigene被注释到至少一个数据库中,仅有2.88%的unigene未得到注释。总体注释情况较好,能够有效完成基因功能注释。本研究丰富了豚鹿的基因资源,可为豚鹿的抗病毒免疫研究提供高质量的基因数据参考。
有研究表明,PolyI:C能够模拟病毒的双链RNA,进而引起机体免疫反应[28]。差异表达基因数目统计结果表明,Poly I:C刺激后可以引起豚鹿外周血淋巴细胞基因的差异表达。差异表达基因经GO富集后被分为生物学过程,细胞组分和分子功能三大类中。生物学过程中,DEGs富集比例较高的亚类且与免疫密切相关的“免疫反应”和“免疫系统过程”等。细胞组分中,“胞外区域”占据较高的比例,可能与胞外病毒识别有关。在分子功能中,“细胞因子激活”“受体结合”等免疫相关亚类具有较高的富集比例。豚鹿外周血淋巴细胞在Poly I:C刺激后在抗病毒相关免疫调控信号转导途径中出现了复杂的信号转导反应。尤其是在机体抗病毒免疫过程中起着重要作用的RLR和TLR信号通路[29]。由此可见,Poly I:C能够有效模拟病毒刺激机体产生免疫反应,为后续抗病毒免疫相关基因的筛选奠定基础。进一步筛选免疫相关的差异基因发现,Toll样受体(TLRs)信号通路中的IRF7、IL6等基因在刺激后有较高的表达;另外,补体系统及趋化因子信号通路相关基因如PTX3,C1RL,CXCL10等也出现上调。
干扰素调节因子7(IRF7)在抗病毒免疫反应中具有重要的作用,能够参与I型干扰素的产生并调节先天免疫反应[30]。PolyI:C是合成的病毒双链RNA类似物,它可以用来模拟病毒感染并引发抗病毒免疫反应过程产生I型干扰素和炎性细胞因子来发挥抗病毒免疫的作用[31]。在本试验中,polyI:C刺激后上调了IRF7的表达,并诱导了IL-6的表达。此外,长链正五聚蛋白(PTX3)能够识别多种多样的病原体,通过结合C1q调节补体活性,并促进巨噬细胞和树突状细胞对病原体的识别[32]。PTX3能够结合并抑制人和鼠巨噬细胞病毒[33]和多种流感病毒[34]。本研究中polyI:C刺激外周淋巴细胞后上调了PTX3和补体受体C1RL基因的表达,推测补体系统在豚鹿抗病毒免疫反应中起到了重要的作用。
在涉及转录组技术的研究中,使用qPCR对转录组数据的准确性进行验证是常用的方法[35]。因此,本研究从筛选出的免疫相关基因中随机挑选了9个基因进行了qPCR验证,结果表明,二者数据呈现出一致的变化规律。说明转录组数据具有较高的可信度。
本研究利用Poly I:C对豚鹿外周血淋巴细胞进行刺激,获得二者的基因表达谱;并深度挖掘免疫相关基因,以及其表达差异。揭示豚鹿在病毒防御中的免疫应答机制,有利于人工繁育豚鹿过程中定制合理的饲养方案和疾病预防措施,并且为疫苗佐剂的开发及应用提供了理论基础。
