嗜水气单胞菌外膜蛋白AH6169的生物信息学分析及其原核表达
2021-03-05康超荣娜简思杰孙薇刘祥陈琛陈春琳
康超,荣娜,简思杰,孙薇,刘祥,陈琛,陈春琳
(陕西理工大学生物科学与工程学院,中德天然产物研究所,陕西 汉中 723001)
嗜水气单胞菌(Aeromonashydrophila,A.hydrophila)属于弧菌科气单胞菌属,是一种机会条件致病菌,可导致鱼类多种疾病症状,包括尾巴和皮肤腐烂以及出血性败血病,也可诱发人类的软组织伤口感染和腹泻,尤其在鱼类养殖中造成的高死亡率,给水产养殖业带来巨大的经济损失[1-2]。抗生素药物是治疗该菌引发病症的主要手段,但长期使用会导致细菌耐药性增加和药物残留等问题[3-4]。外膜蛋白(Outer membrane protein,OMP)是位于细菌表面蛋白的总称,有助于维持细菌结构的完整性并参与细菌的适应性反应[5-7]。研究显示,在与细菌毒力相关的各种因素中,由于外膜蛋白表面暴露和宿主间存在广泛的相互作用,使得宿主易于产生免疫应答,外膜蛋白具有疫苗的潜力,并已被证明赋予针对革兰氏阴性细菌的保护性免疫力[8-9]。高云山等[10]研究发现重组蛋白OmpF具有较好的免疫原性,可用于制备气单胞菌交叉型抗体。毛然然等[11]研究发现嗜水气单胞菌重组外膜蛋白OprM对斑马鱼的相对免疫保护率达89.47%,更适合于作为嗜水气单胞菌亚单位疫苗的候选成分。然而,关于嗜水气单胞菌外膜蛋白AH6169的研究尚未见报道。本研究选取嗜水气单胞菌主要外膜蛋白AH6169为研究对象,分子克隆获得AH6169蛋白的原核表达菌株,探讨其最佳表达条件,纯化获得AH6169蛋白并制备小鼠抗血清;探究AH6169蛋白的抗原性,结合AH6169蛋白生物信息学分析,为嗜水气单胞菌疫苗的研究提供理论依据。
1 材料与方法
1.1 试验材料
嗜水气单胞菌ATCC 7966、E.coliDH5α、E.coliBL21菌株及pET-32a质粒由陕西理工大学中德天然产物研究所保存;昆明鼠购自西安交通大学医学部。rTaq聚合酶、T4-DNA连接酶、内切酶BamH Ⅰ和XhoⅠ来自TaKaRa公司;细菌基因组提取、质粒提取试剂盒购自上海生工公司;IPTG、TMB显色液为西安赫特生物科技有限公司产品;山羊抗小鼠二抗购于Sigma公司;引物合成、基因测序由天润奥科生物公司。
1.2 试验方法
1.2.1 生物信息学分析获取不同菌株的AH6169蛋白序列 通过GeneDoc软件绘制多重序列比对图,利用MEGA软件构建系统发育树;采用ProParam数据库预测AH6169蛋白的氨基酸数、分子量大小、等电点、稳定指数等参数,并从ProScale analysis数据库中获取亲水性图谱;采用TMHMM 2.0和SignalP 5.0软件预测AH6169蛋白的跨膜区域和信号肽位置,并利用SOPMA和SWISS-MODEL软件分别进行二级结构和三维结构预测。最后使用STRING软件在线构建AH6169蛋白与其它蛋白的相互作用关系网络。
1.2.2 原核表达AH6169蛋白的重组菌株构建 根据NCBI数据库中嗜水气单胞菌ATCC 7966全基因组序列(GenBank:CP000462.1),设计引物扩增AH6169基因。F-AH6169:AGGGGATCCATGAAAAGACAGCATTGAC;R-AH6169:AGGCTCGAGTTAGAAGTTGTACTGCAG(划线位置分别为BamH Ⅰ和XhoⅠ的酶切位点)。以全基因组为模板,利用rTaq聚合酶实现AH6169基因扩增,反应体系为50 μL,退火温度设为55 ℃。扩增产物经核酸电泳鉴定并回收,BamH Ⅰ和XhoⅠ同时双酶切PCR产物与载体pET-32a,在T4-DNA连接酶作用下将AH6169基因导入质粒pET-32a,转化E.coliDH5α中,获得重组质粒。双酶切和基因测序进一步验证重组质粒,将构建成功的重组质粒转化至E.coliBL21中,构建AH6169蛋白原核表达菌株。
1.2.3 重组蛋白的诱导表达及纯化 挑取单菌落过夜培养,以1∶100转接培养至OD600为0.6,加入0.1 mol·L-1的IPTG,摇床诱导6 h,取1 mL菌液收集菌体,加入300 μL 2×SDS吹打混匀,高温变性蛋白5 min,12 000 r·min-1离心2 min(Thermo美国)取上清液10 μL进行SDS-PAGE电泳检测AH6169蛋白表达,结合包涵体洗涤和SDS-PAGE蛋白电泳切胶法纯AH6169蛋白[12]。
1.2.4 重组蛋白表达条件的优化 以L9(34)正交试验模型(表1)开展AH6169蛋白最佳表达条件研究。正交试验简要过程为:以1∶100将过夜培养的AH6169蛋白饱和菌液转接至600 μL培养液中,37 ℃、200 r·min-1培养至设定的不同OD600值,按照不同组合要求加入不同终浓度的IPTG并在规定条件下诱导,进行3组重复试验。收取1 mL诱导菌液,沉淀加入300 μL的2×SDS,高温变性蛋白5 min,样品通过SDS-PAGE电泳获得不同诱导条件下AH6169蛋白的表达图谱。使用软件Phoretix 1D和SPSS分别进行表达图谱光密度和不同因子显著性分析。

表1 AH6169蛋白表达条件正交试验的因子与水平Table 1 Factors and levels of orthogonal test for AH6169 protein expression condition
1.2.5 蛋白小鼠抗血清的制备及特异性检测 选用4~5周龄昆明鼠30只,试验前饲养3 d,每天喂食供水,试验组和对照组各为15只。取纯化AH6169蛋白100 μg混合100 μL弗氏完全佐剂,腹腔注射免疫小鼠。14 d后,等量蛋白混合100 μL弗氏不完全佐剂,二次免疫小鼠。7 d后,同二免,进行第三次免疫,对照组免疫PBS。7 d后眼球取血,3 000 r·min-1离心10 min获取抗血清于-80 ℃保存。免疫印迹法(Western blotting)验证AH6169蛋白抗血清特异性,步骤简述如下:SDS-PAGE电泳嗜水气单胞菌全蛋白,恒压80 V转NC膜1 h,NC膜充分封闭2 h后与不同稀释倍数(1∶800,1∶1 200,1∶1 600)的小鼠抗血清于37 ℃轻摇孵育40 min,对照为阴性抗血清。用TNT缓冲液冲洗3次,再与1∶3 000倍稀释的二抗于37 ℃轻摇孵育1 h,洗涤后通过DAB显色法确定AH6169蛋白抗血清的特异性。
1.2.6 酶联免疫法体外模拟蛋白抗血清与细菌的相互作用 培养嗜水气单胞菌、荧光假单胞菌和溶藻弧菌至OD600约1.0,菌体用1%的甲醛生理盐水80℃灭活,生理盐水调整菌液OD600=0.2,分装为1 mL·管-1(菌量108CFU),分别与100 μL不同稀释倍数的蛋白抗血清(1∶400、1 ∶800、1 ∶1 600、1∶3 200、1∶6 400)孵育90 min,对照为阴性血清。洗涤后与200 μL 1∶3 000倍稀释的二抗孵育1 h,洗涤菌体并混合20 μL PBS至酶标板中,加入200 μL TMB显色液,避光显色10 min,加入50 μL终止液H2SO4(2 mol·mL-1),450 nm读数[13]。
2 结果与分析
2.1 生物信息学分析
2.1.1 AH6169蛋白的同源性与系统发育分析 利用GeneDoc软件绘制不同菌株AH6169蛋白氨基酸序列比对图(图1)。结果显示,不同血清型的嗜水气单胞菌以及气单胞菌属间AH6169蛋白同源性均较好,推测AH6169蛋白可能为不同种类气单胞菌的感染提供交叉免疫保护作用。利用MEGA软件构建系统发育树(图2),发现嗜水气单胞菌与达克气单菌亲缘关系更近,推测AH6169蛋白在这2种菌之间可能存在共同抗原成分,具有相似的免疫学功能。
2.1.2 AH6169蛋白理化性质、结构与功能预测 ProtParam数据库分析显示:AH6169蛋白有357个氨基酸,相对分子质量大小为38 704.20,等电点为4.57,在哺乳动物、酵母和大肠杆菌的半衰期分别大于30、20、10 h,不稳定指数为13.67,归类为稳定蛋白;亲水性图谱分析得出亲水性平均值为-0.490,表明AH6169蛋白属于疏水性蛋白(图3A);跨膜结构预测图谱(图3B)可知,在全序列中预测到跨膜氨基酸,存在跨膜结构,属于外膜蛋白;信号肽预测结果(图3C)显示,该蛋白的1~21位氨基酸组成了信号肽序列,21~22位氨基酸之间存在切割位点,可信度达到0.999 1;SOPMA软件二级结构预测显示,α-螺旋占全序列22.69%,延伸占25.49%,无规则卷曲占46.79%(图3D)。WISS-MODEL软件三级结构预测结果显示,AH6169蛋白的三维结构为多孔状结构(图3E);通过STRING数据库构建蛋白互作网络,发现有10种蛋白可与AH6169蛋白相互作用(图3F)。
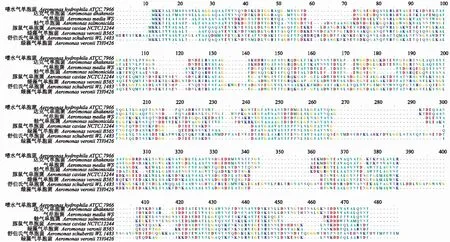
图1 AH6169蛋白氨基酸序列比对Fig.1 Sequence alignment of amino acid of AH6169 protein

图2 AH6169蛋白系统发育树Fig.2 Phylogenetic tree of AH6169 protein
2.2 AH6169基因重组质粒的构建
利用引物F-AH6169、R-AH6169扩增AH6169基因,出现约为1 000 bp的单一条带(图4A),与理论大小相符。重组质粒pET-32a-AH6169经BamH Ⅰ和Xho Ⅰ双酶切,得到约1 000 bp的条带,大小符合AH6169基因(图4B)。目的基因经测序比对,显示与 NCBI 数据库所公布序列一致,证实正确构建重组质粒。
2.3 AH6169蛋白的表达纯化
AH6169重组菌株经IPTG诱导表达,电泳显示目标蛋白成功表达,相对分子质量约59 kD;利用包涵体洗涤和SDS-PAGE电泳切胶法纯化获得AH6169蛋白(图5),与预测的分子量大小一致。
2.4 AH6169蛋白表达条件的优化
为确定AH6169蛋白的最佳表达条件,每个条件组合进行3组重复。诱导菌经SDS-PAGE电泳获得不同诱导条件下AH6169蛋白的表达图谱(图6),图谱光密度值如表2所示,所得数据极差和方差分析如表3和表4所示。从表3可以看出,在诱导AH6169菌株表达时,最佳条件组合为A2B1C2D2,即菌液OD600值为0.8时选择终浓度0.1 mmol·L-1的IPTG,32℃诱导8 h。表4分析结果显示,加诱导剂时菌液OD600值为0.8,达到显著性,由此可得诱导时菌液浓度对于AH6169蛋白的高效表达尤为重要。



A.亲水性预测; B.跨膜结构预测; C.信号肽预测; D.二级结构预测; E.三级结构预测; F.蛋白互作网络。A.Hydrophilic prediction; B.Transmembrane structure prediction; C.Signal peptide prediction; D.Secondary structure prediction; E.Tertiary structure prediction; F.Protein-protein interaction network.

A.PCR扩增AH6169基因,M.DNA Marker,1.AH6169基因; B.重组质粒的双酶切,M.DNA Marker,1.重组质粒,2.重组质粒pET-32a-AH6169的BamH Ⅰ和Xho Ⅰ双酶切。
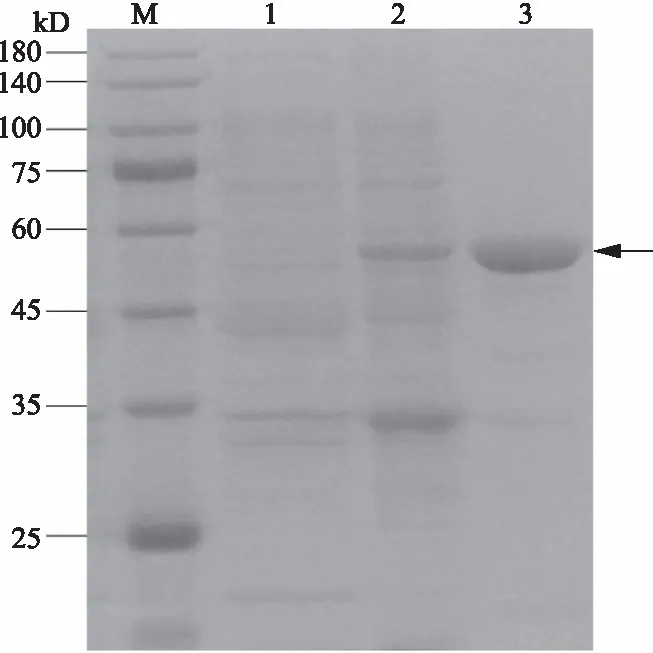
M.蛋白Marker;1.未诱导菌株;2.诱导菌株;3.纯化的AH6169蛋白。M.Protein marker; 1.Uninduced strain; 2.Induced strain; 3.Purified AH6169 protein.
2.5 AH6169蛋白抗血清的特异性检测及3种菌相互作用
通过免疫小鼠制备多克隆抗血清,Western blotting结果表明AH6169蛋白与制备的抗血清特异性结合,呈现出明显的单一条带,阴性对照无条带,抗血清滴度达到1∶1 600,如图7所示,表明制备的AH6169蛋白抗血清与嗜水气单胞菌AH6169蛋白可特异性结合。
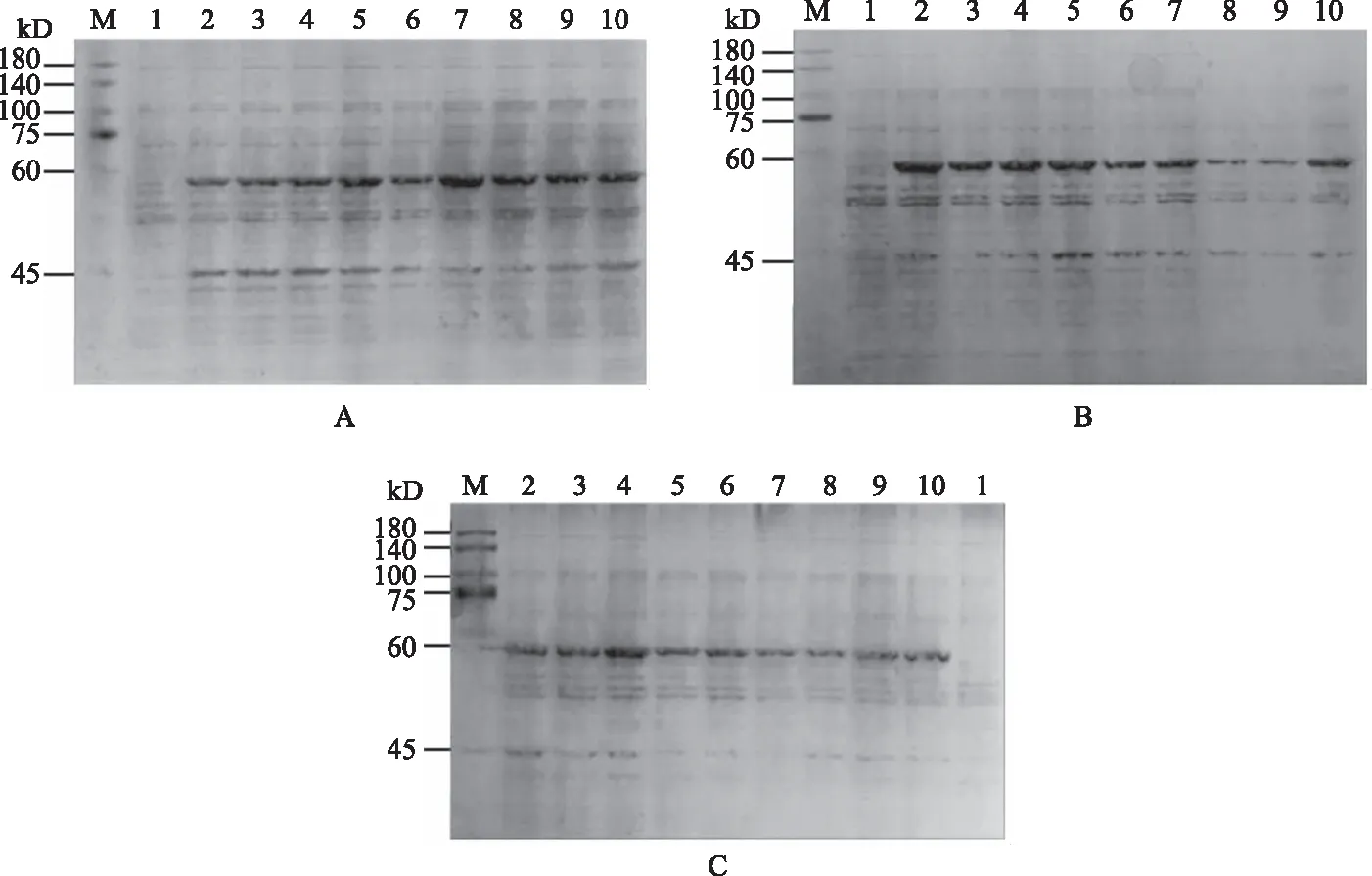
注:A,B,C为3次重复; M.蛋白marker; 1.未诱导菌株; 2~4.OD600值为1.0,诱导温度分别为28、37、32 ℃; 5~7.OD600值为0.8,诱导温度分别为28、32、37℃; 8~10.OD600值为0.5,诱导温度分别为37、32、28 ℃。Notes:A,B,C are three replicates; M.Protein marker; 1.Uninduced strain; 2 to 4.OD600 is 1.0,inducing temperature is 28,37,32 ℃ respectively; 5 to 7.OD600 is 0.8,inducing temperature is 28,32,37 ℃ respectively; 8 to10.OD600 is 0.5,inducing temperature is 37,32,28 ℃,respectively.

表2 AH6169蛋白表达图谱光密度分析Table 2 Optical density analysis of AH6169 protein expression map
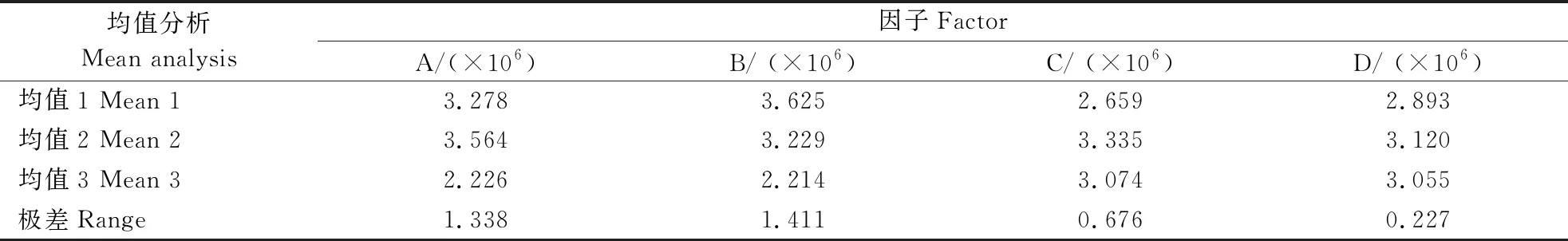
表3 AH6169蛋白光密度数值的极差分析Table 3 Range analysis of optical density of AH6169 protein
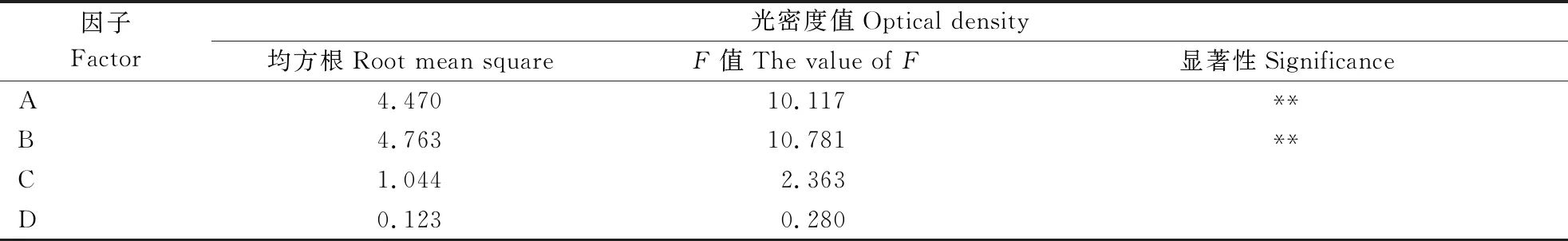
表4 AH6169蛋白光密度数值的方差分析Table 4 Variance analysis of optical density of AH6169 protein
采用酶联免疫法模拟AH6169蛋白抗血清与嗜水气单胞菌、荧光假单胞菌和溶藻弧菌体外相互识别作用。结果显示,随着抗血清稀释倍数的增大,AH6169蛋白抗血清与3种菌的结合能力逐渐减弱,当抗体滴度达到1∶3 200时,仍可检测到两者的相互作用(图8)。可见,AH6169蛋白抗血清与嗜水气单胞菌、荧光假单胞菌和溶藻弧菌在体外存在相互作用,说明该蛋白与这3种细菌存在共同抗原成分(交叉抗原),表明AH6169蛋白可能具有较好的抗原性。

1~3.1∶800,1∶1 200,1∶1 600倍稀释抗血清;4.阴性血清(1∶400倍稀释)1 to 3.Dilution proportion of antiserum was 1∶800,1∶1 200,1∶1 600,respectively; 4.Negative serum ( dilution proportion was 1∶400)

A.AH6169蛋白抗血清与嗜水气单胞菌体外相互作用; B.AH6169蛋白抗血清与荧光假单胞菌体外相互作用; C.AH6169蛋白抗血清与溶藻弧菌体外相互作用。A.Interaction between AH6169 protein antiserum and Aeromonas hydrophila in vitro; B.Interaction between AH6169 protein antiserum and Pseudomonas fluorescens in vitro; C.Interaction between AH6169 protein antiserum and Vibrio alginolyticus in vitro.
3 结论与讨论
嗜水气单胞菌是水产养殖鱼类暴发性传染病的主要病原菌,可以感染多种淡水鱼,引发败血症且存在极高死亡率,同时也可引发人类脑膜炎、腹泻及肠胃炎等,是一种人、畜及水生动物共患的条件致病菌。传统抗生素药物治疗该菌感染会存在药物残留、细菌耐药性等问题[14-16]。疫苗是保护宿主免受细菌感染最经济、有效和环境友好的药物。因此,有必要开发新型水产养殖疫苗[17]。目前,水产养殖疫苗主要是基于全细胞的细菌灭活疫苗[18],具有免疫持久、活性高等优点,受到广泛关注,但在蛋白亚单位疫苗和核酸疫苗研发上滞后。本研究从嗜水气单胞菌AH6169蛋白亚单位疫苗角度出发,为新型疫苗开发奠定基础。
革兰氏阴性菌具有双层细胞膜,外膜蛋白是嗜水气单胞菌的主要毒力因子之一,具有较强的免疫原性,能够激发机体免疫产生高水平的保护性抗体,部分重组蛋白更是具有较高的疫苗效能[19]。郑宗林等[20]将嗜水气单胞菌外膜蛋白OmpA免疫斑点叉尾,结果证实OmpA蛋白可提高斑点叉尾的溶菌酶活性、ACH50活性、头肾巨噬细胞活性。GUO等[21]用嗜水气单胞菌和创伤弧菌外膜蛋白构建二价保护原免疫美洲鳗,发现该保护原激活了机体的特异性和非特异性免疫,并可预防两种病原体的感染。然而,现阶段关于外膜蛋白的研究更多还处于实验室筛查阶段,暂无商品化的疫苗投放市场。本研究发现嗜水气单胞菌外膜蛋白AH6169抗血清与嗜水气单胞菌、荧光假单胞菌和溶藻弧菌这3种菌在体外存在相互识别作用,该蛋白与另外3种细菌存在共同抗原成分(交叉抗原),表明AH6169蛋白可能具有较好的抗原性,在疫苗开发上有研究价值。
生物信息学可准确预测蛋白理化性质、结构与细胞表位[22],对蛋白功能研究有参考价值。凌空等[23]对嗜水气单胞菌的3对基因(溶血素HlyA、外膜蛋白ompS及丝氨酸蛋白酶AhpA)进行克隆与生物信息学分析,通过研究3对基因的开放阅读框编码的氨基酸,进一步研究嗜水气单胞菌的保护性和抗原多样性。刘祥[24]对溶藻弧菌附着定植因子ACFA进行预测,结果表明ACFA蛋白具有很好的免疫原性,在疫苗上有应用前景。本研究分析发现,AH6169蛋白性质稳定,为疏水性蛋白,其二级结构主要以无规则卷曲为主,这有助于抗原表位的形成,三级结构预测显示呈多孔状跨膜结构,推测AH6169与宿主间存在广泛的信息与物质交换,可能对宿主产生较强的免疫激活作用,在疫苗研发上有着重要意义。在不同气单胞菌AH6169蛋白同源性分析中,在不同气单胞菌AH6169蛋白同源性分析中,发现嗜水气单胞菌与达克气单菌亲缘关系更近,推测AH6169蛋白在这2种菌之间可能存在共同抗原成分,有相似的免疫学功能,具体的实验验证有待深入研究。
蛋白表达由于受到宿主的影响,其最佳表达条件往往是唯一的。本实验室通过分子克隆对溶藻弧菌外膜蛋白OmpU和附着定植因子ACFA正交试验,发现低浓度的IPTG、适度的诱导时间,利于蛋白的表达[25-26]。本研究通过正交试验发现菌液OD600值为0.8,IPTG终浓度为0.1 mmol·L-1,32 ℃诱导8 h,AH6169蛋白获得最大表达量。可见,在低浓度的IPTG和适宜的诱导下有利于AH6169蛋白的表达。
综上所述,嗜水气外膜蛋白AH6169的无规则卷曲结构有助于抗原表位形成,可能为不同菌株的感染提供交叉免疫保护作用,且存在较好的免疫原性。因此,嗜水气单胞菌外膜蛋白AH6169有望成为亚单位疫苗的候选抗原。
