丛枝菌根真菌对镉胁迫小麦幼苗解毒效应的研究
2021-03-05王红霞韩蕾蕾李阳张乐乐李晓袁祖丽
王红霞, 韩蕾蕾, 李阳, 张乐乐, 李晓, 袁祖丽
(河南农业大学生命科学学院,河南 郑州 450002)
工农业生产的迅猛发展,工业“三废”的随意排放,使得农田土壤遭受到不同程度的重金属污染[1]。据统计,中国重金属污染的土地面积约2 500万hm2,占耕地总面积的20%[2],其中以镉(Cadmium, Cd)的污染面积最大、最严重[3]。据不完全统计,中国农田Cd污染面积已达1.33万hm2,每年生产Cd含量超标的农产品达14.6亿kg,且有日益加重的趋势[4-5]。污染土壤中的Cd被植物根系吸收后,转运至地上部可食用部位,不仅降低农作物产量、品质,还可经食物链富集到人体,严重危害人类健康[6]。Cd胁迫能诱导超氧阴离子等植物体内活性氧((Reactive oxygen species, ROS)的产生[7],造成植物体内生物大分子的氧化伤害[8-10],导致植物损伤与死亡。小麦在世界各地广泛种植,以其为主要粮食的人口占2/5[11],是易吸收Cd的农作物之一[12]。小麦子粒中的Cd含量超标时有报道[13],因此,减少土壤中Cd对小麦生长发育造成的影响,提高小麦产量、品质具有重要意义。丛枝菌根真菌是一种广泛存在于陆地生态系统中的土壤真菌[14]。研究表明,丛枝菌根真菌能在一定程度上增强植物的抗逆性[15],调节植株对重金属的吸收和转运[16],提高植物对重金属的耐受能力[17]。丛枝菌根真菌分泌的球囊霉素相关土壤蛋白(Glomalin-related soil protein, GRSP)可与土壤中的重金属结合,降低重金属的毒性[18]。研究发现,在Cd污染的土壤中,每千克的GRSP对Cd的固定量可达1 120 mg[19]。植物螯合肽(Phytochelatin, PC)是一类富含半胱氨酸(Cys)的多肽家族[20],通过与重金属离子螯合并运输到液泡内减少细胞质中重金属的含量,增强植物抵抗胁迫的能力[21],Cd是PC的最强诱导者[22]。目前,如何减少土壤中Cd对植物造成的毒害,已有较多报道[23-25],但接种丛枝菌根真菌对Cd胁迫小麦幼苗的解毒效应尚不清楚。因此,以小麦和摩西球囊霉菌(Glomusmosseae,Gm)为材料,采用土培试验,研究Cd胁迫下接种丛枝菌根真菌对小麦幼苗解毒效应的影响,为小麦栽培提供理论依据。
1 材料与方法
1.1 试验材料
小麦(TriticumaestivumL.)品种为百农207,由河南农业大学国家小麦工程技术研究中心提供。丛枝菌根真菌为摩西球囊霉菌(Glomusmosseae,Gm),由北京市农林科学院植物营养与资源研究所提供。
1.2 试验方法
采用土培试验,营养土按m(基质)∶m(蛭石)=3∶1的比例拌匀,高温(121 ℃)灭菌30 min后自然晾干,供试基质的主要成分为泥炭土,Cd的本底值为0.11 mg·kg-1。塑料杯用5 mL 75%乙醇消毒。根据试验设计(表1),未接菌组每个杯子装入120 g营养土,接菌组放入115 g营养土和5 g菌种。小麦种子用3%过氧化氢浸泡消毒20 min,蒸馏水冲洗数次后浸泡30 min,待用。每杯播种36粒,覆土,浇水至杯子质量250 g,并将杯子放置光照培养箱中培养。培养箱条件设置为16 h光照/8 h黑暗,温度16~25 ℃,相对湿度80%,光照度0~100 μmol·m-2·s-1。待幼苗刚出土后,按照试验设计(表1)对胁迫组小麦幼苗进行Cd胁迫处理,胁迫质量分数依据《农用地土壤污染风险管控标准》(GB 15618—2018)中关于管制值的基础上定为5和10 mg·kg-1。此后每2 d浇灌不再含Cd的Hoagland’s营养液50 mL,每个处理重复5次。幼苗生长至两叶一心收获。叶片用锡箔纸包裹迅速放液氮冷冻,-80 ℃保存备用。

表1 试验设计Table 1 Design of experiment
1.3 小麦叶片超氧阴离子产生速率的测定
植物组织中超氧阴离子产生速率的测定参照ELSTNER等[26]的方法。
1.4 球囊霉素相关土壤蛋白的测定
球囊霉素相关土壤蛋白的测定参照谢小林等[27]、何开平等[28]的方法。称取0.75 g土样,加入20 mmol·L-1柠檬酸钠缓冲液(pH值7.0)6 mL,超声混匀,121 ℃高温灭菌,然后10 000 r·min-1离心20 min,取上清液,于595 nm波长下测定其吸光值。
1.5 小麦根内Cd含量的测定
小麦根系用剪刀沿植株根茎交界处剪断,用流动的自来水将根系上的营养土冲洗干净,然后用去离子水冲洗3次后,吸干表面水,装入信封在80 ℃烘箱中干燥,用组织捣碎机(WARING-800 S,上海凌初环保仪器有限公司)粉碎,过筛。Cd含量测定参照BUSCEM等[29]的方法,用电感耦合等离子体(ICP)XSERISE2型高效液相色谱仪测定。
1.6 小麦叶片PC含量、PCS活性的测定
PC含量和PCS活性的测定依据试剂盒(购自上海酶联生物科技有限公司)使用说明书进行操作。
1.7 数据分析
各试验结果用DPS v 14. 10数据处理软件进行LSD -单因素差异显著性分析,使用Excel 2007对数据进行基本处理。
2 结果与分析
2.1 丛枝菌根真菌对Cd胁迫小麦叶片超氧阴离子产生速率的影响
如图1所示,Gm与CK相比,小麦叶片中超氧阴离子产生速率降低了23.91%;Cd5,Cd10与CK相比,小麦叶片中超氧阴离子产生速率分别增加了52.17%和91.30%。而Cd5+Gm,Cd10+Gm与Cd5,Cd10相比,小麦叶片中超氧阴离子产生速率分别下降了32.86%和28.41%。表明丛枝菌根真菌能在一定程度上缓解Cd胁迫造成的氧化伤害。
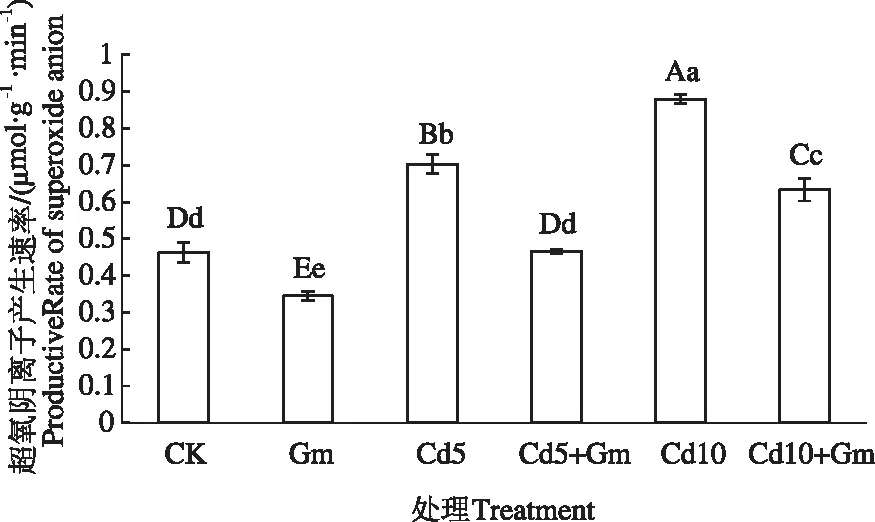
注:Gm,Cd5,Cd5+Gm,Cd10和Cd10+Gm分别表示接菌,5 mg·kg-1 Cd(NO3)2,5 mg·kg-1 Cd(NO3)2+接菌,10 mg·kg-1 Cd(NO3)2,10 mg·kg-1 Cd(NO3)2+接菌。不同大写字母表示在0.01水平上差异显著。不同小写字母表示在0.05水平上差异显著。下同。
2.2 丛枝菌根真菌对Cd胁迫小麦根际土壤中GRSP含量的影响
如图2所示,Gm与CK相比,土壤中GRSP含量极显著增加,上升了30.03%;Cd5,Cd10与CK相比,GRSP含量差异不显著;而Cd5+Gm,Cd10+Gm与Cd5,Cd10相比,土壤中GRSP含量分别上升了28.05%和28.12%。表明接种丛枝菌根真菌可以提高根际土壤中GRSP的含量。

图2 丛枝菌根真菌对Cd胁迫小麦根际土壤中GRSP含量的影响Fig.2 Effects of inoculation AMF on GRSP content in wheat soil under cadmium stress
2.3 丛枝菌根真菌对Cd胁迫小麦根系内Cd含量的影响
如图3所示,随着Cd胁迫质量浓度的增加,小麦根系中Cd含量极显著增加,Cd5,Cd10与CK相比,分别上升了1 309.75%和4 131.23%;Cd5+Gm,Cd10+Gm与Cd5,Cd10相比,小麦根系中Cd含量分别增加了189.36%和51.10%。表明接种丛枝菌根真菌可以提高小麦根系内Cd的含量。
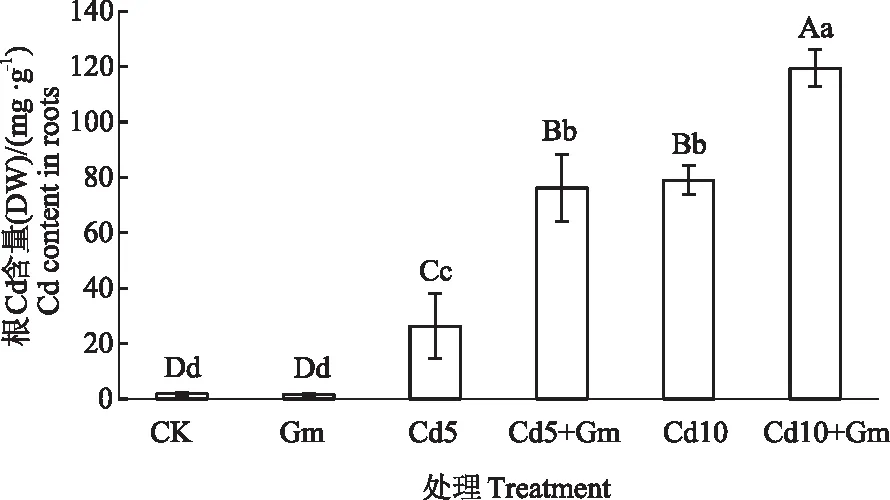
图3 丛枝菌根真菌对Cd胁迫小麦根Cd含量的影响Fig.3 Effects of inoculation AMF on Cd content in wheat roots under cadmium stress
2.4 丛枝菌根真菌对Cd胁迫小麦叶片PC质量浓度的影响
如图4所示,Gm与CK相比,小麦叶片中PC质量浓度下降了3.03%;Cd5,Cd10与CK相比,小麦叶片中PC质量浓度分别上升了16.55%和37.07%;而Cd5+Gm,Cd10+Gm与Cd5,Cd10相比,小麦叶片中PC质量浓度分别下降了21.75%和21.36%。这可能是接种丛枝菌根真菌降低了植物螯合肽合成酶(Phytochelatin synthase, PCS)的活性,从而导致PC质量浓度的下降。
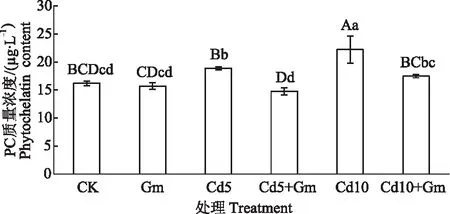
图4 丛枝菌根真菌对Cd胁迫小麦叶片PC质量浓度的影响Fig.4 Effects of inoculation AMF on PC mass concentration in wheat leaves under cadmium stress
2.5 丛枝菌根真菌对Cd胁迫小麦叶片PCS活性的影响
如图5所示,Gm与CK相比,小麦叶片中PCS的活性有不同程度下调,下降了6.23%;Cd5,Cd10与CK相比,小麦叶片中PCS活性分别上升了8.71%和24.88%,而Cd5+Gm,Cd10+Gm与Cd5,Cd10相比,小麦叶片中PCS活性分别下降了22.94%和20.29%。表明接种丛枝菌根真菌在一定程度上降低了PCS的活性。
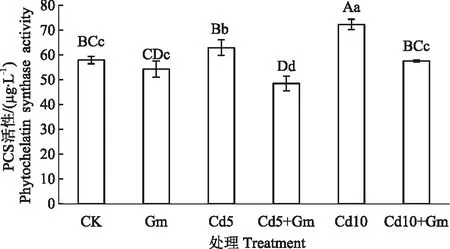
图5 丛枝菌根真菌对Cd胁迫小麦叶片PCS活性的影响Fig.5 Effects of inoculation AMF on PCS activity of wheat leaves under cadmium stress
3 结论与讨论
植物在重金属胁迫下,ROS产生与清除机制被打破,超氧阴离子等大量积累[30],造成细胞膜脂过氧化反应,蛋白质、核酸等生物大分子受到伤害,生理代谢紊乱,植物生长受阻[31-32]。本研究结果表明,Cd胁迫下小麦叶片内超氧阴离子产生速率极显著提高,说明Cd胁迫造成了氧化损伤。这与贾月慧等[33]、邓勇等[34]的研究结果一致。然而,Cd胁迫接种丛枝菌根真菌后与同等胁迫质量分数下未接种相比,超氧阴离子产生速率显著降低,这与Cd胁迫接种丛枝菌根真菌可减少小麦叶片内的Cd含量有关[35]。该结果与伍松林等[36]的研究结果一致。
GRSP是一种广泛存在的丛枝菌根真菌分泌物[37],不仅可以增加土壤颗粒的团聚性,稳定土壤结构[38],而且当重金属过量时,还可与土壤中的重金属结合,减弱重金属的毒性。丛枝菌根真菌可以抑制重金属向地上部的运输,减轻重金属对植物的生理毒害[39]。刘灵芝等[40]研究表明,在Cd胁迫下,接种丛枝菌根真菌显著增加了玉米根系中Cd的质量分数和吸收量,降低了植物地上部分的Cd含量。本研究结果表明,随着Cd胁迫质量分数的增加,小麦根中Cd含量显著增加,同质量分数Cd胁迫接种丛枝菌根真菌与未接种相比,根际土壤中GRSP及根系中Cd含量均极显著增加,说明接种丛枝菌根真菌增加了小麦根中的Cd含量,提高了根际土壤中GRSP。这也和很多的研究结论[41-45]一致。
PC是重金属诱导产生的一类多肽,由PCS以谷胱甘肽(Glutathione, GSH)为底物催化合成,能通过Cys的-SH络合重金属,并通过液泡膜上的转运蛋白-ABC运输体将其转运至液泡内,解除重金属毒性[46]。本研究结果表明,不同质量分数Cd胁迫小麦叶片中PC质量浓度和PCS活性均显著高于对照,且随着Cd胁迫质量分数的增加,PC质量浓度和PCS活性均极显著上升。这与刘媛等[47]、ANJUM等[48]、丁戈等[49]研究结论一致。Cd胁迫接种丛枝菌根真菌与同质量分数胁迫未接种相比,由于大量的Cd被固定到根系中,导致地上部Cd含量显著减少,从而造成了小麦叶片中PC质量浓度和PCS活性随之下降。说明丛枝菌根真菌在一定程度上缓解了Cd的毒性,并伴随着PC诱导量的降低。
本研究结果表明,Cd胁迫下接种丛枝菌根真菌增加了小麦根中Cd含量,提高了根际土壤中GRSP,降低小麦叶片中超氧阴离子产生速率、PC质量浓度和PCS活性,说明丛枝菌根真菌在一定程度上可缓解Cd的毒性,促进小麦幼苗生长。
