力和组织内氧气调控的骨折愈合过程仿真
2021-03-04王沫楠
王沫楠
骨折愈合过程是长期而复杂的生物学修复过程,受到多种因素的影响,包括:全身因素、骨折部位、局部因素、手术时期、治疗方案、化学因素等.计算机仿真模型可以合理地模拟骨折愈合过程,帮助研究骨折愈合机理,帮助设计和优化骨折固定器,帮助制订合理的手术方案,达到提高手术成功率和骨折愈合质量的目的.
1960 年,Pauwels[1]首次阐述了力学刺激对组织分化的影响.1988 年,Carter 等[2]在Pauwels 理论的基础上,研究了力的加载方式和组织分化之间的关系.Blenman 等[3]基于Carter 的理论,通过二维的有限元模型分析了骨折骨痂形成的三个阶段.Claes 等[4]通过动物实验、细胞培养实验结合二维有限元模型分析了骨折间隙尺寸和稳定性对骨折愈合过程的影响.该模型只描述了骨折后第1 周、第4周和第8 周的愈合过程.Claes 等[5]通过有限元分析研究了力刺激大小对组织形成的影响,得出了各组织形成的力刺激阈值.Lacroix 等[6]将应变和流速作为调控组织分化的两个力学因素,建立了两相介质有限元模型,预测了在不同骨折间隙下的骨折愈合过程.Isakksson 等[7]和Vetter 等[8]模拟了单一的力学刺激调控下的组织分化过程.Ament 等[9]提出了基于模糊控制的组织分化模型,将应变能密度作为调控组织分化的力刺激,并基于相关实验、医学知识以及临床经验建立出相应的模糊规则,模拟了骨折愈合过程中的膜内骨化、软骨骨化等阶段.2011 年,Simon 等[10]建立了力学稳定性和血运重建对骨折愈合过程中组织分化影响的动态仿真模型.模型中的血运重建过程仿真虽然与组织内氧气的运输相关联,但是没有单独研究氧气的作用.事实上,在骨折愈合过程中,组织内的氧气水平除了受到血液供给的影响之外,细胞代谢要消耗部分氧气.2014年,Steiner 等[11−12]研究了不同类型的力刺激对骨折愈合过程的影响.2016 年,王沫楠[13]对Simon 模型进行扩展,利用三维几何模型仿真力学环境和血供对骨折愈合过程的影响.
骨折愈合过程除了受力学因素影响之外,氧气参与了骨折愈合过程中多种细胞活动,是骨折愈合的重要影响因素.2013 年,Lu 等通过小鼠实验验证了骨折愈合过程中氧气的重要作用.2012 年,Burke[14]提出了通过基底刚度和氧张力调节的间充质干细胞分化的骨折愈合仿真模型,该模型模拟了间充质干细胞的增殖分化过程,但是模型没有考虑细胞代谢耗氧对组织内氧环境的影响.Wagegg等[15]研究了缺氧条件下的干细胞分化过程,得出低氧张力环境将严重损坏骨生成的结论.一些学者通过研究证实了低氧环境可以促进软骨的生成[16].Geris 等[17]通过12 个连续变量(间充质干细胞、软骨细胞、成骨细胞、成纤维细胞、内皮细胞、软骨基质、骨基质、纤维基质、血管基质、成骨生长因子、软骨生长因子、血管生长因子) 描述了骨再生的时空变化.Peiffer 等[18]对Geris 模型进行了扩展和修改,将氧作为显式变量加到模型中研究氧气对骨折愈合的影响.2012 年,Carlier 等[19]提出了一种氧气参与的多尺度骨折愈合仿真模型,该模型描述了骨折愈合从微观到宏观一系列生物学过程,研究了氧气在骨折愈合中的重要作用,但几何模型是二维轴对称的,并且将骨痂区域近似为矩形,该模型没有考虑力学刺激对骨痂形成的影响.
本文根据骨折愈合过程中的力学生物学特性,建立了骨折处的力学模型,通过有限元方法求解影响组织分化的力刺激,通过三维扩散方程模拟组织内氧张力的时空变化,兼顾力学和氧气对组织调控的作用,运用模糊控制原理,仿真组织分化的力学生物学调控过程.在Eclipse 环境下进行编程,得到在组织常氧、低氧和高氧环境下,0.5 mm 和3 mm 骨折间隙模型在骨痂内不同位置处骨组织浓度、软骨组织浓度和纤维组织浓度的时空变化.
1 方法
1.1 骨折三维几何模型
三维几何模型在ProE5.0 下建立,尺寸与Burke 等[20]测量的小鼠股骨的尺寸值一致,骨折间隙与Harrison 实验的间隙值[21]一致.
1.2 骨折力学模型及有限元计算
基于弹性力学的基本方程建立骨折愈合单元的应力应变关系:σ=Dε,其中D为弹性矩阵.弹性矩阵的参数由两个力学参数弹性模量E和泊松比v确定.各组织浓度以及各组织弹性模量决定了骨痂单元的弹性模量,各组织浓度以及各组织泊松比决定了单元的泊松比.单元的弹性模量和泊松比计算如式(1) 和(2) 所示:
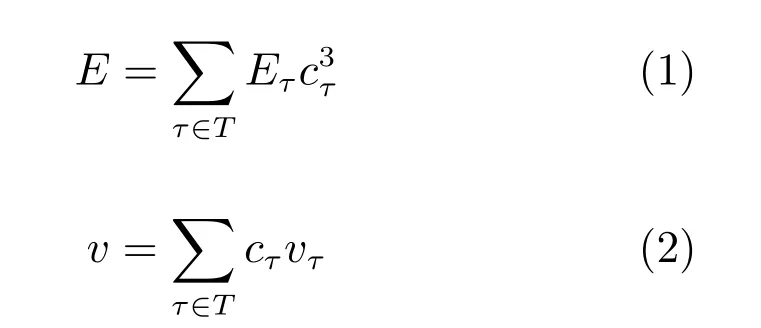
式中,T是骨、软骨和软组织集合,cτ是集合中局部各组织浓度(包括骨组织浓度Cbone,软骨组织浓度Ccart和纤维组织浓度Ccont),Eτ是混合物对应的弹性模量,vτ是混合物对应的泊松比.根据虚功原理建立单元平衡方程,采用共轭梯度法求解平衡等式.
1.3 调控组织分化的力学激励
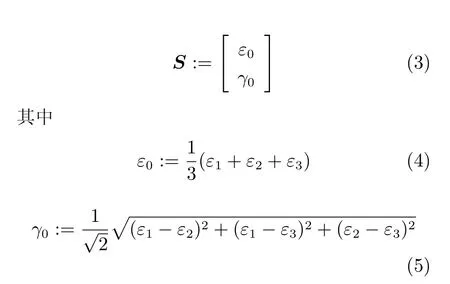
式(4) 用应变第一不变量表示膨胀应变,又称之为静力学应变,代表体积的改变.ε1,ε2,ε3是主应变.式(5) 是应变偏张量表示的畸变应变,代表形状的改变.
1.4 外固定器力学模型、外加载荷及边界条件
骨折愈合仿真所采用的外部固定器是1997 年Claes 等进行骨折间隙和骨端稳定性对骨折愈合影响实验时设计的,外固定器力学行为如图1 所示.载荷F施加在模型的顶端,大小为10 N,10 N 为鼠正常行走时,股骨可以承受的最大力.模型底端为固定约束,外固定架使得骨折部位只有轴向位移,因此其他方向自由度均为0.
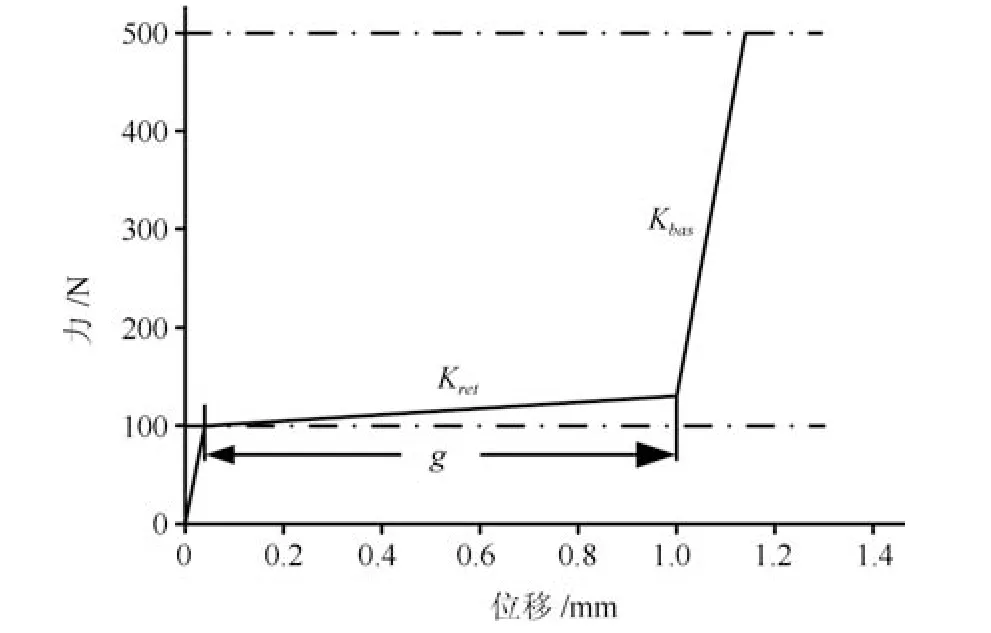
图1 外部固定器结构及力学行为Fig.1 Mechanical behavior of external fixator
1.5 氧气运输模型
在骨折愈合过程中,氧气是骨折区域内细胞成活和调节细胞代谢的重要因素,不同的细胞会分化成骨痂内不同的组织,进而影响骨折愈合的过程.在骨痂组织内,氧气会不断向组织内弥散溶解,溶解到组织内的氧气称为氧张力.骨痂组织内的氧张力来源于血液供给的同时,在骨折愈合过程中,各细胞代谢会消耗组织内的一部分氧气.因此建立组织内氧气运输的数学模型如下:
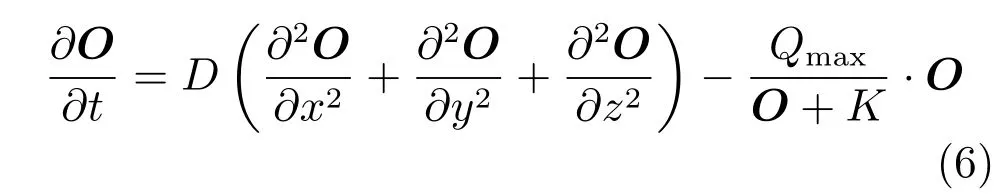
式中,O为组织内氧张力,D为组织内氧气的扩散系数.t为时间,Qmax为细胞耗氧率,K代表细胞耗氧率在其最大值一半时的氧气浓度.其中模型参数D、Qmax、K为常数,具体值如表1 所示.
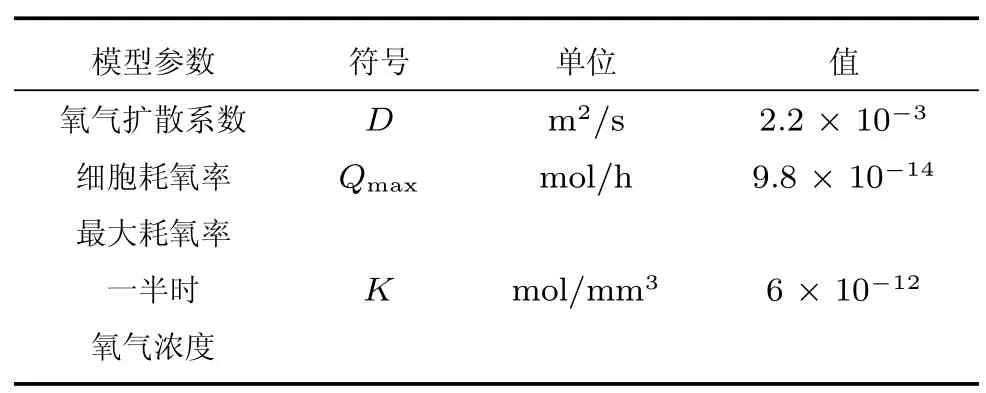
表1 模型参数[22−23]Table 1 Model parameters[22−23]
本文建立氧气运输模型模拟了组织内低氧、常氧、高氧环境下的氧气变化情况,其中常氧时的初值与Epari 实验[24]测量值相同,为74.1 mmHg,低氧和高氧情况下的初值参考Lu 的实验[25]测量值分别设置为37.05 mmHg 和162.6 mmHg.
边界条件如下:
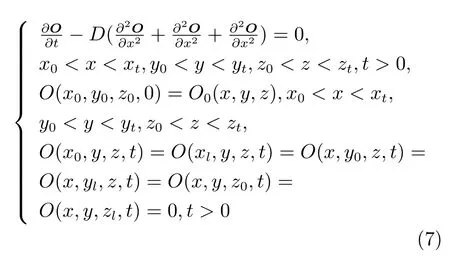
利用有限差分法求解扩散方程,首先要对所求区域离散化,本文通过Hypermesh 划分并建立了有限元三维网格模型实现了区域的离散化,求解区域由划分后的有限个四面体网格单元组成.将三维扩散方程中的导数用函数在网格节点上的值构成差分来替代,进而把表示变量连续化关系的三维扩散方程进行差分化处理,得到方程的差分格式,最后选用合适的代数方程组解法,通过求解线性方程组便可求得网格节点上浓度值的时空变化.利用有限体积法推导差分格式,将计算区域离散化,对每个网格点的控制体积进行积分得出离散方程.
1.6 骨痂组织分化的生物学调控
本文建立6 输入2 输出的模糊控制模型描述骨折愈合的骨痂组织分化过程.对语言值膨胀应变、畸变应变、相邻单元、软骨浓度、骨浓度、氧张力、软骨浓度改变量、骨浓度改变量分别建立对应的隶属度函数,如图2 所示,建立模糊推理的模糊规则共15 条.
1.7 组织分化模糊规则
在MATLAB 中Fuzzy 模糊工具箱的隶属度函数编辑器中,建立描述组织分化的输入输出隶属度函数和模糊规则.本文组织分化模糊规则如表2 所示.
规则1~3 描述骨折初期.骨受到创伤后,骨折部位营养动脉和其分支受到撕裂,导致不同程度的出血,出血外渗到周围形成血肿,血肿内氧张力降低,骨折断端破损的骨膜及其周围细胞发生坏死.组织内缺氧导致细胞无法存活并继续完成代谢和组织分化[26].随后,软骨细胞和成骨细胞出现,局部出现血管扩张、血浆渗出及水肿,破骨细胞侵入并开始清除死骨.新生血管侵入血肿内的纤维蛋白网中,并伴有大量间充质干细胞增生,随后转化为成纤维细胞和吞噬细胞等.血肿逐渐被清除,骨痂区域很快机化为肉芽组织形成纤维性骨痂.骨痂内软骨浓度、骨浓度下降.
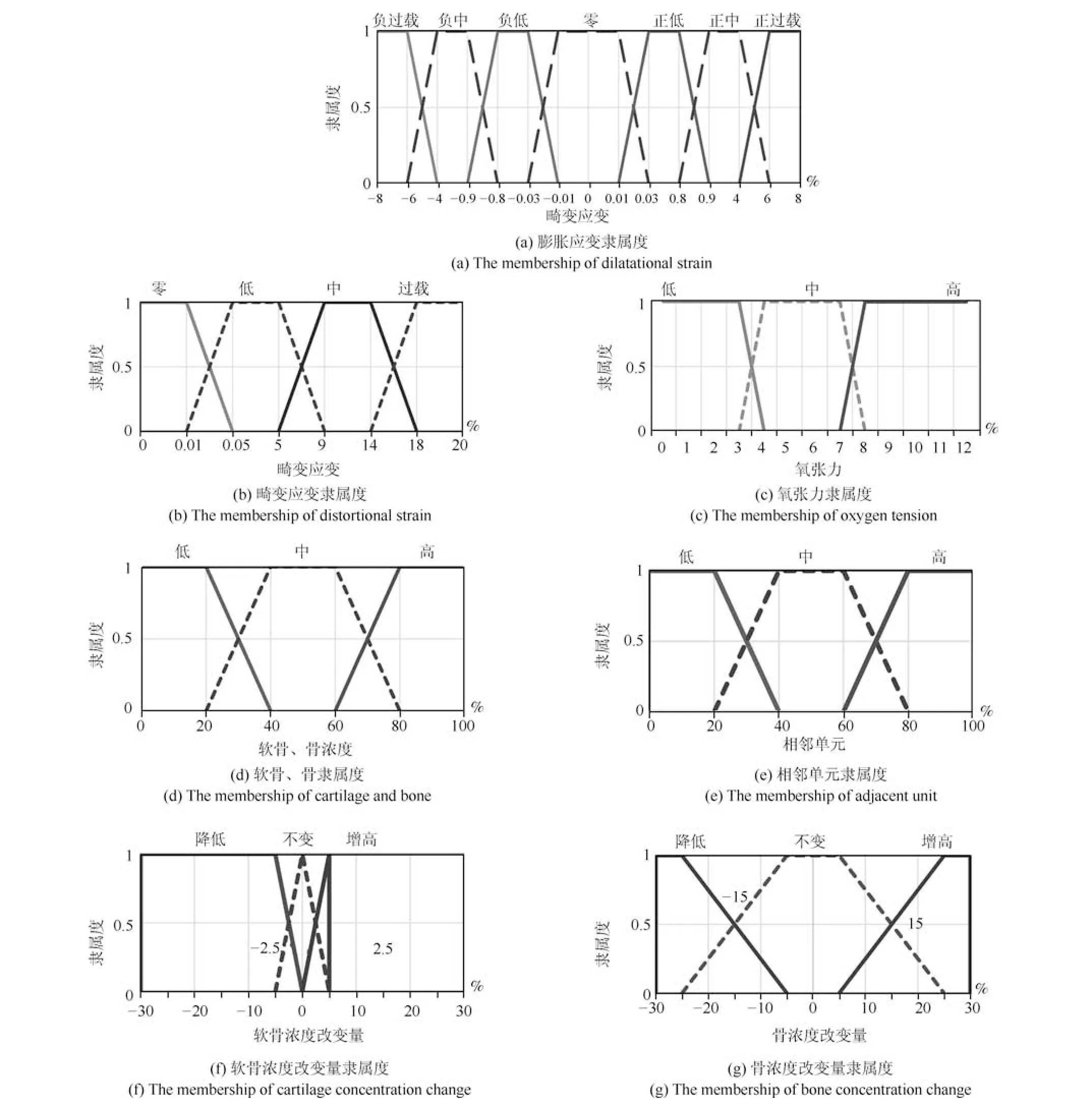
图2 隶属度函数Fig.2 Membership functions
规则4、5 描述了膜内骨化过程.膜内骨化是一种直接成骨方式,此过程中没有软骨生成.由于在骨膜处是有氧的,结缔组织直接转变为骨组织.在初始阶段时,间充质干细胞逐渐密集并分裂为骨原细胞,毛细血管也逐渐修复和生长,充足供氧使得组织内氧张力值较高.在稳定的力学环境和充足的氧气供应条件下,部分骨原细胞增大为成骨细胞,成骨细胞分泌类骨质形成早期的骨组织[27].在膜内骨化过程中,稳定的力学环境、充足的氧气供应及邻骨间浓度不能过低是此过程发生的重要条件.
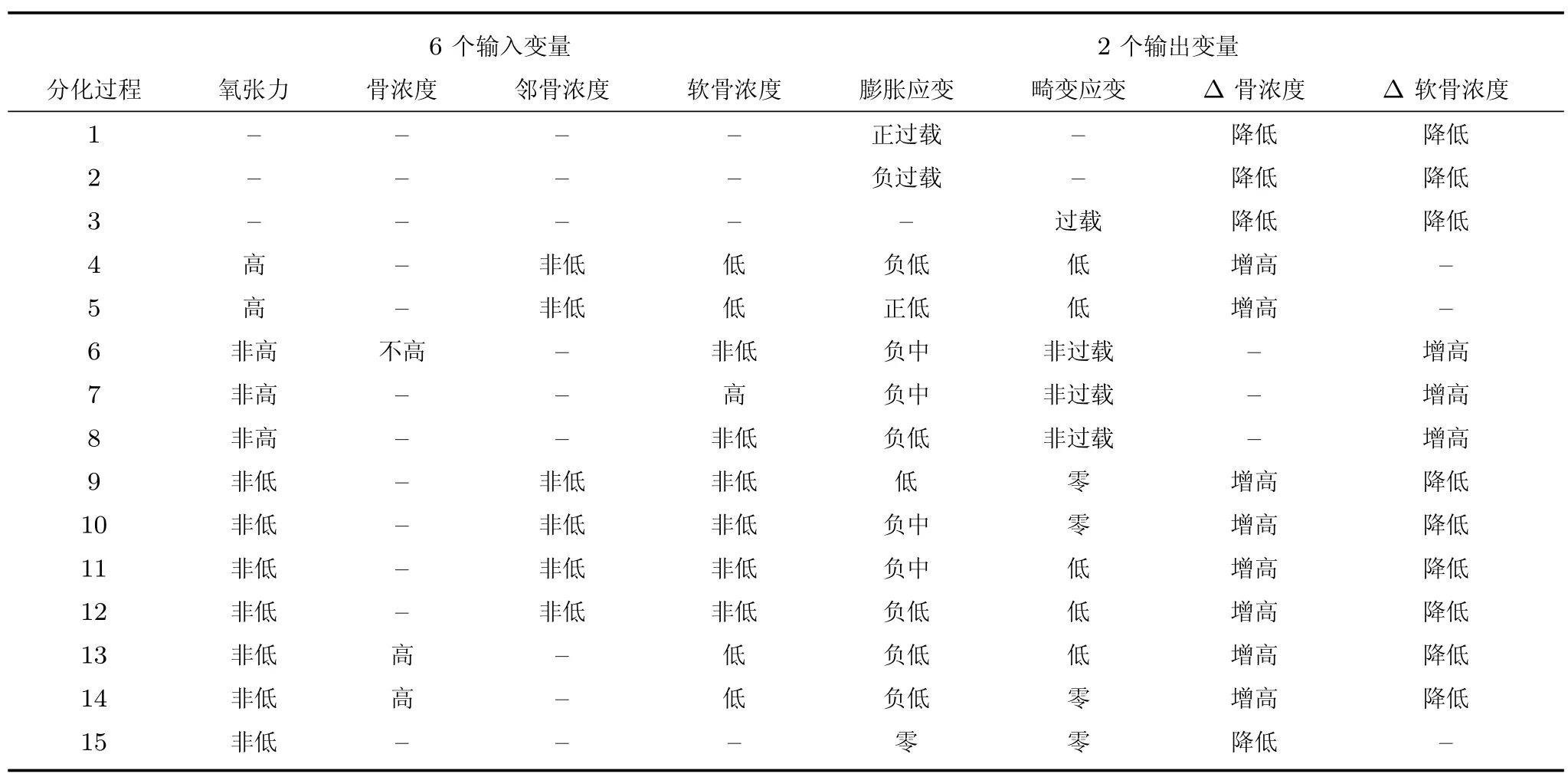
表2 骨折愈合的模糊规则Table 2 The fuzzy rules of the fracture healing
规则6~8 描述了软骨生成过程.在骨折愈合过程中,组织内低的氧张力值会促进软骨的生成[28−29].在力学环境不稳定导致较大骨折断端微动且组织内氧张力值不高的时候,组织内的间充质干细胞会向软骨细胞分化,形成软骨.
规则9~14 描述了软骨钙化、骨化过程.在骨痂内形成软骨后,随着骨折愈合时间的增加,组织内血管逐渐修复,组织内供氧充足,氧张力值较高,同时,在应力刺激下,成骨细胞合成胶原和糖蛋白构成了骨的有机基质.成骨细胞被有机基质包埋后转化为骨细胞,逐渐发生钙化,骨基质变为较坚硬的骨性骨痂.成软骨细胞在此过程也会分泌胶原,胶原纤维被钙盐沉积后,成软骨细胞会变性坏死.软骨钙化在间歇高应力刺激下发生.在软骨钙化过程中,软骨浓度降低、骨浓度增加.在骨化的过程中,血管生长因子释放,血管生成量大大增加,组织内氧气张力水平较高,成骨细胞会释放碱性碳酸酶且活性激增,碱性碳酸酶水解了血浆中有机结合的磷酸并释放磷酸盐,磷酸盐与钙盐结合为磷酸钙,最终使得骨质转变为骨组织.骨质转变为骨组织过程中,骨浓度增加、软骨浓度降低.
规则15 描述组织重建、萎缩过程.
1.8 骨痂组织浓度的迭代更新
用Java 语言对生成的mat 查询表进行查询匹配.将有限元计算的膨胀应变、畸变应变以及氧气运输模型计算的氧气张力值与查询表进行匹配查询,把符合的骨组织浓度和软骨组织浓度改变量输出值查询出来,模糊模型计算所得的组织浓度改变量为,组织分化方程为D(C(t),s(t)),∆C和组织分化方程的关系如下:
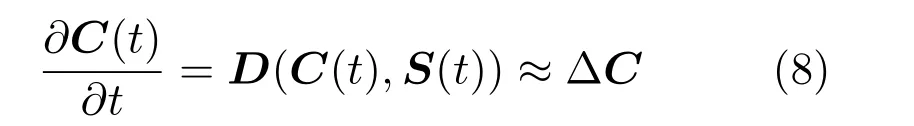
本文骨折愈合组织浓度更新采用等时间步长的欧拉迭代求解方法,任一时刻各单元的骨浓度、软骨浓度是前一时刻的迭代累加,更新组织浓度后重新对每个单元赋值.
2 结果和讨论
本文的仿真程序的开发语言为Java,软件开发环境为Eclipse.硬件运行系统为64 位的Windows 7 操作系统,处理器为Intel (R) Core (TM)i3-2350M CPU @ 2.30 GHz 2.30 GHz,安装内存4 GB,显卡1 GB.
2.1 组织内氧张力仿真结果分析
基于本文建立的氧气运输模型,利用自主开发的骨折愈合仿真程序进行计算,预测骨折愈合过程中骨膜骨痂处、皮质骨下骨痂处以及骨内骨痂处的氧张力值如图3 所示.随着骨痂内血管的生长和重建,组织内的氧张力从骨折后的第7 天开始增加,在骨折的35 天后,组织内平均的氧张力值在5%~8% 之间.此处的氧张力是指骨膜骨痂、皮质骨下骨痂以及骨内骨痂处的平均氧张力值.骨膜骨痂、皮质骨下骨痂、骨内骨痂处的最大氧张力值则分别为8.42%、6.25%、7.65%.氧张力的最大值出现在骨膜骨痂处,最小值出现在皮质骨下骨痂处,这是因为骨膜骨痂处血管修复速度要快于皮质骨下骨痂处.将仿真结果与Epari 实验测量的氧张力、Carlier 的多尺度模型仿真结果进行对比.Epari实验测量氧张力初始值为110 mmHg (14.6%),最终值为12.5 mmHg (1.65%),Carlier 模型不包括骨折愈合的血肿期,从骨折后第四天开始预测,初始氧张力值为28 mmHg (3.7%),与Epari 实验测量的骨折第三天数据一致.本文模型预测的骨折愈合前10 天的氧张力结果比Carlier 氧气模型预测的氧张力结果更贴近Epari 实验数据.对于骨折愈合10 天后的数据,本文模型预测结果与Carlier 的仿真结果曲线趋势一致,本文预测的骨膜骨痂、皮质骨下骨痂以及骨内骨痂处氧张力结果比Carlier 模型的仿真结果偏高一些.本文模型和Carlier 模型都考虑了血液供氧和细胞耗氧.本文氧气运输模型和Carlier 氧气模型的主要区别在于,Carlier 氧气运输模型为二维模型且将骨痂各处近似为矩形区域进行计算,而本文氧气运输模型是在三维几何模型上进行仿真计算的:Carlier 的多尺度模型包含了大量的偏微分方程,参数较多.对于骨折愈合仿真的前10 天,几何模型的差异是本文仿真结果比Carlier 仿真结果更接近Epari 实验测量结果的原因.对于骨折愈合10天后的仿真,本文仿真结果与Carlier 结果数据趋势相同,仿真结果数值略高的原因是几何模型的不同和Carlier 模型参数较多.
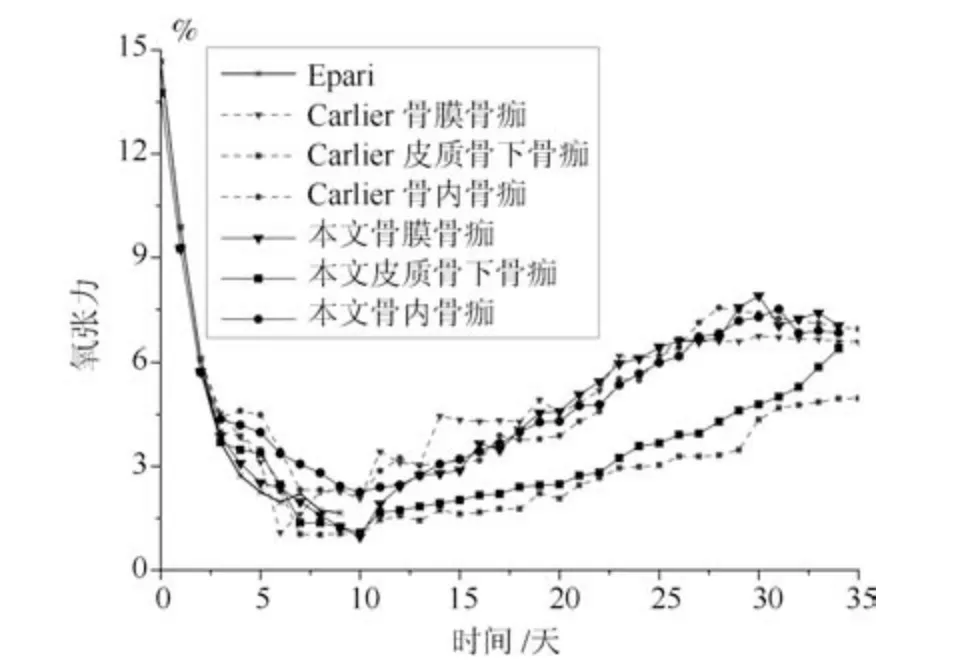
图3 不同骨痂处随时间变化的平均氧张力值Fig.3 Temporal evolution of the average oxygen tension in the different callus
2.2 组织常氧环境下的仿真结果分析
本文模拟了在组织常氧环境下0.5 mm 和3 mm两种不同的骨折间隙时的骨折愈合情况,我们预测了在组织常氧环境下骨膜骨痂处、皮质骨下骨痂处、骨内骨痂处骨痂单元的骨组织浓度、软骨组织浓度以及纤维组织浓度随着愈合时间的变化情况.0.5 mm 骨折间隙下和3 mm 骨折间隙下不同位置骨痂处的骨组织浓度变化如图4 所示,软骨组织浓度变化如图5 所示,纤维组织浓度变化如图6 所示.
在组织常氧环境下,将本文预测的0.5 mm 间隙以及3 mm 间隙不同位置骨痂处的骨组织浓度、软骨组织浓度和纤维组织浓度与Harrison 实验测量数据和Carlier 模型仿真结果进行对比,0.5 mm和3 mm 间隙下本文仿真结果中骨组织浓度逐渐增加,在0.5 mm 骨折间隙时骨组织浓度最终增加到100%,纤维组织和软骨组织最终都被骨组织替代,骨折愈合时间为32 天,愈合正常.而3 mm 骨折间隙时骨组织浓度最终未能达到100%,软骨组织和骨组织生成较慢,纤维组织也未能及时被骨组织取代,出现了不愈合的现象.0.5 mm 间隙时的骨组织浓度高于3 mm 骨折间隙时的骨组织浓度.在组织常氧环境下,两种骨折间隙时的软骨组织浓度随着仿真时间的延长,先增加后下降,表达了软骨生成、软骨钙化和骨化的过程.其中皮质骨下骨痂处的软骨浓度最高,因为在骨折愈合过程中,骨膜处以及骨内骨痂处是有氧的,因此在骨膜骨痂以及骨内骨痂处成骨细胞可以很快地向骨组织分化,而在皮质骨下骨痂处氧气含量较低,不利于成骨,因此骨浓度较低、软骨组织浓度较高.3 mm 间隙时生成的软骨低于0.5 mm 间隙时生成的软骨.在组织常氧环境下,两种间隙时纤维组织浓度逐渐下降,表达了骨折愈合过程中的骨化过程,随着愈合时间的增加,纤维组织逐渐被骨组织取代.其中0.5 mm 骨折间隙时纤维组织完全被骨组织取代,而3 mm 间隙时纤维组织未能完全被骨组织取代,因此3 mm 间隙时的骨折模型出现了不愈合的现象.0.5 mm 间隙时各组织浓度值均高于3 mm 间隙时各组织浓度,说明在组织常氧环境下,稳定的骨折断端有利于骨折愈合,不稳定的骨折断端不利于组织分化,进而导致骨折不愈合.将本文仿真结果与Harrison 实验测量结果、Carlier模型仿真结果进行对比,骨组织浓度、软骨组织浓度和纤维组织浓度在趋势上相同.本文仿真结果和Carlier 仿真结果都很接近Harrison 实验测量数据,本文仿真结果与实验数据更接近一些.
2.3 组织低氧环境下的仿真结果分析
本文仿真预测了在组织低氧环境下0.5 mm 稳定骨折间隙和3 mm 不稳定间隙时,在骨膜骨痂,皮质骨下骨痂以及骨内骨痂处的骨组织浓度、软骨组织浓度和纤维组织浓度的时空变化如图7 和图8 所示.
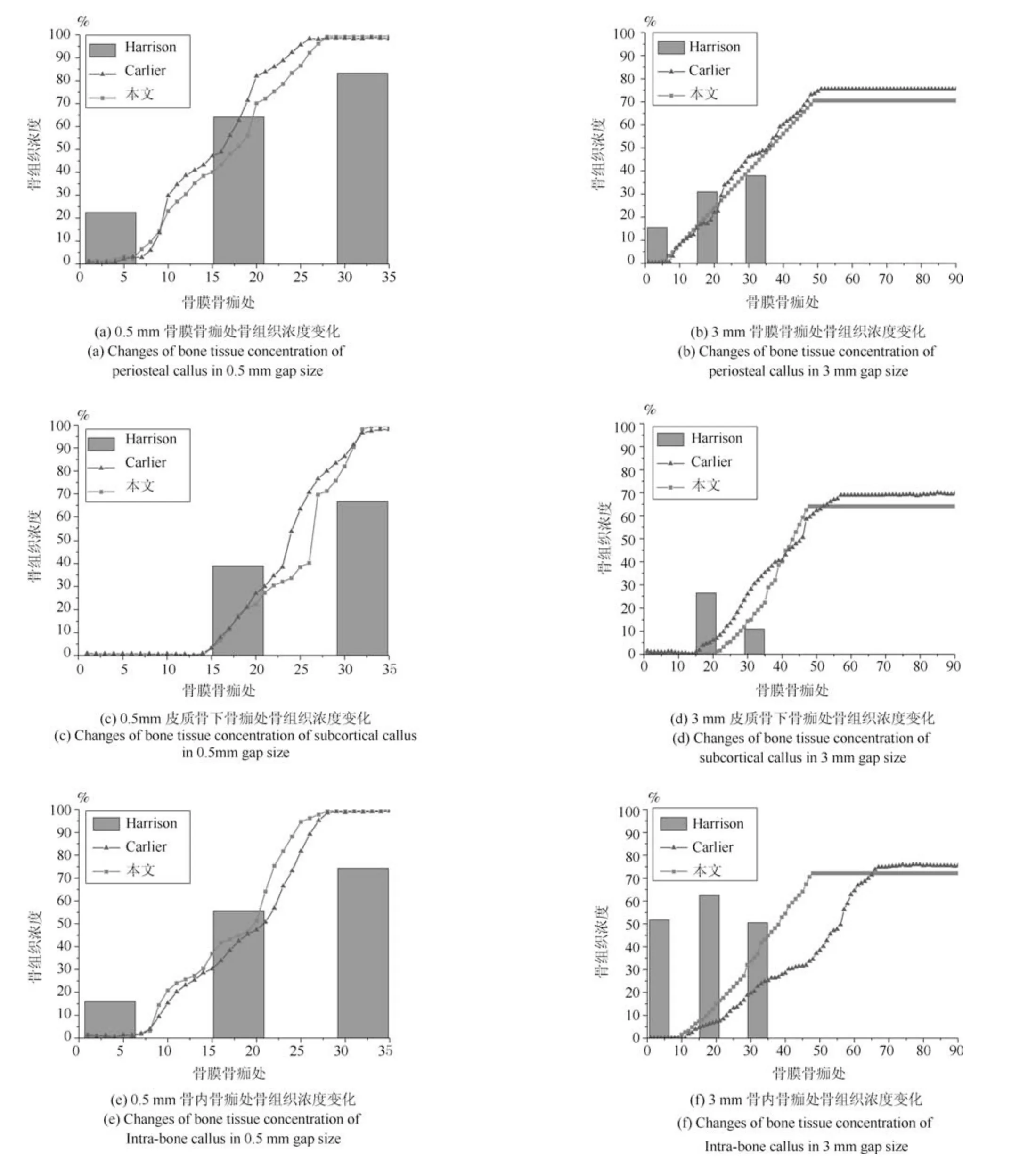
图4 不同骨折间隙的骨组织浓度变化Fig.4 Changes of bone tissue concentration in different gap size
在组织低氧环境时,随着愈合时间的增加,仿真模型预测的0.5 mm 骨折间隙时骨组织浓度最终未达到100%,纤维组织最终也未能都被骨组织取代,出现了不愈合的现象,而在3 mm 骨折间隙时,与0.5 mm 骨折间隙时的结果比较,骨组织和软骨组织生成量都更少,组织内纤维组织浓度最终还是很高,3 mm 骨折间隙时愈合更慢,85 天后,愈合的迹象停止,出现了不愈合的现象.0.5 mm 间隙和3 mm 间隙时骨组织浓度最终均未达到100%,说明组织内的低氧环境抑制了成骨细胞的增殖分化,进而影响了骨的生成.在低氧环境时骨膜骨痂处的骨浓度最高,因为在骨折愈合过程中,骨膜处以及骨内骨痂处是有氧的,因此在骨膜骨痂以及骨内骨痂处成骨细胞可以很快地向骨组织分化,而在皮质骨下骨痂处氧气含量较低,不利于成骨,因此骨浓度较低.在组织低氧环境下,两种骨折间隙时的软骨组织浓度均为先升高后下降,表达了软骨生成、软骨钙化、骨化的过程.与组织常氧环境相比,两种不同间隙骨折模型的软骨组织浓度均更高,说明低氧的环境促进了软骨细胞的生成,进而软骨生成量增多.在低氧环境下皮质骨下骨痂处的软骨浓度最高,因为在骨折愈合过程中,皮质骨下骨痂处氧气含量较低,促进了软骨细胞分化.在组织低氧环境下纤维组织浓度逐渐下降,两种不同间隙时的纤维组织最终都未能被骨组织取代,这导致了临床上的不愈合.说明低氧环境不利于成纤维细胞的增殖分化,导致纤维组织未能及时被骨组织取代.两种间隙下的仿真结果都是骨折未愈合,这说明组织内的氧气环境对骨折愈合的影响比骨折固定稳定性对骨折愈合的影响更大一些.与本文常氧环境仿真结果和Carlier 模型常氧环境仿真结果相比,两种不同间隙模型在组织低氧环境时骨的生成量均减少,而软骨生成较多,最终纤维组织未能全部被骨组织取代,骨折不愈合.3 mm 不稳定间隙时的组织生成量更少,说明低氧环境和骨间的不稳定性不利于骨折愈合.
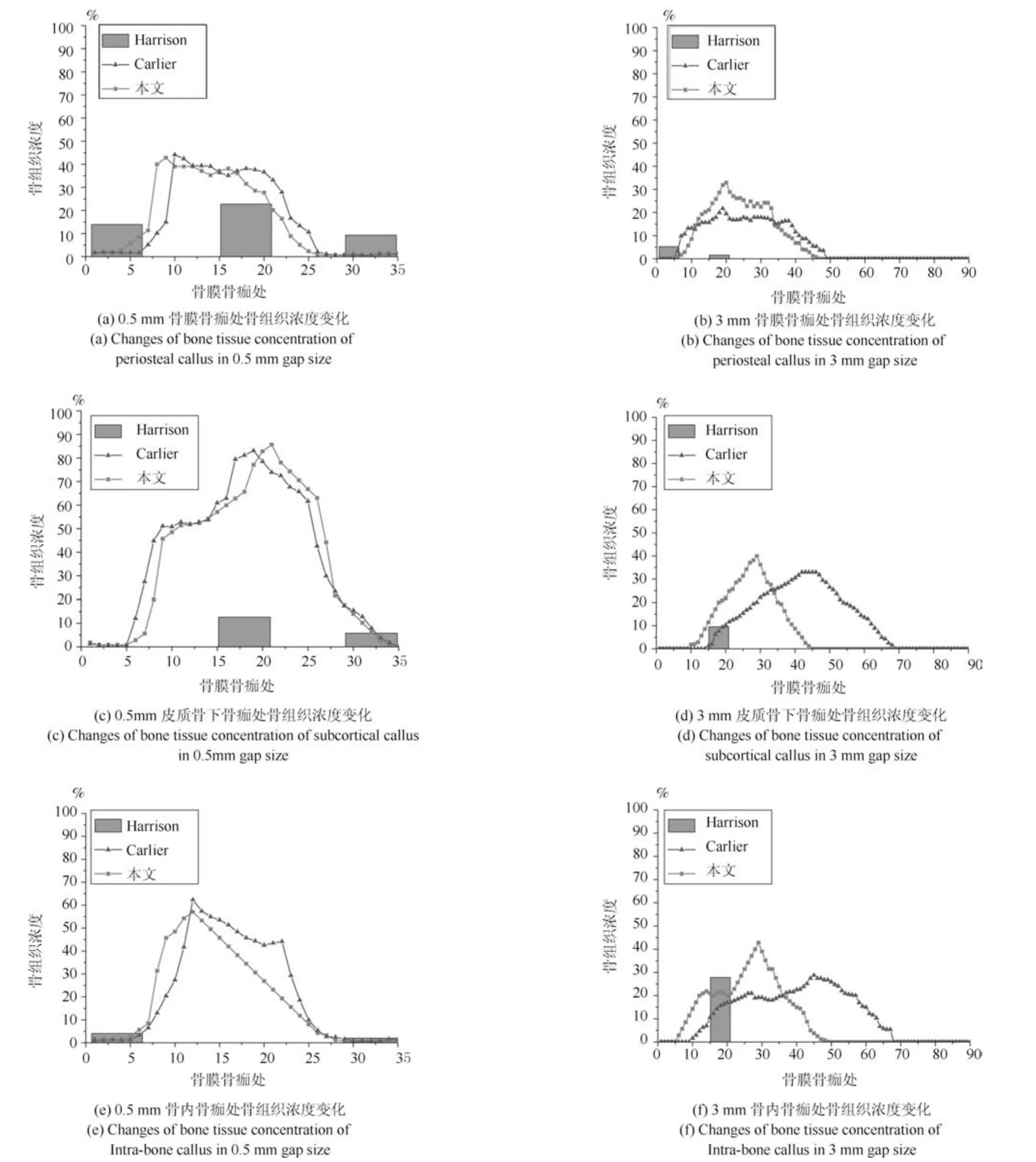
图5 不同骨折间隙的软骨组织浓度变化Fig.5 Changes of cartilaginous tissue concentration in different gap size
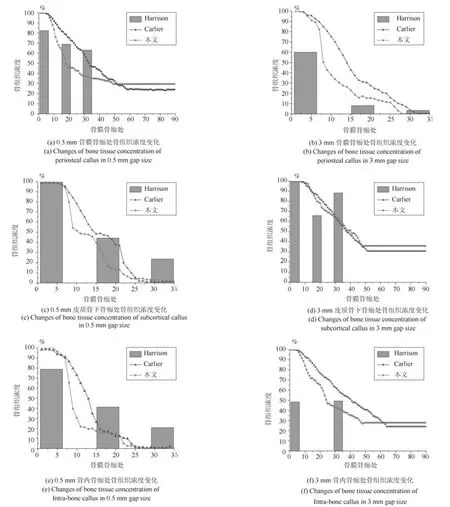
图6 不同骨折间隙的纤维组织浓度变化Fig.6 Changes of fibrous tissue concentration in different gap size
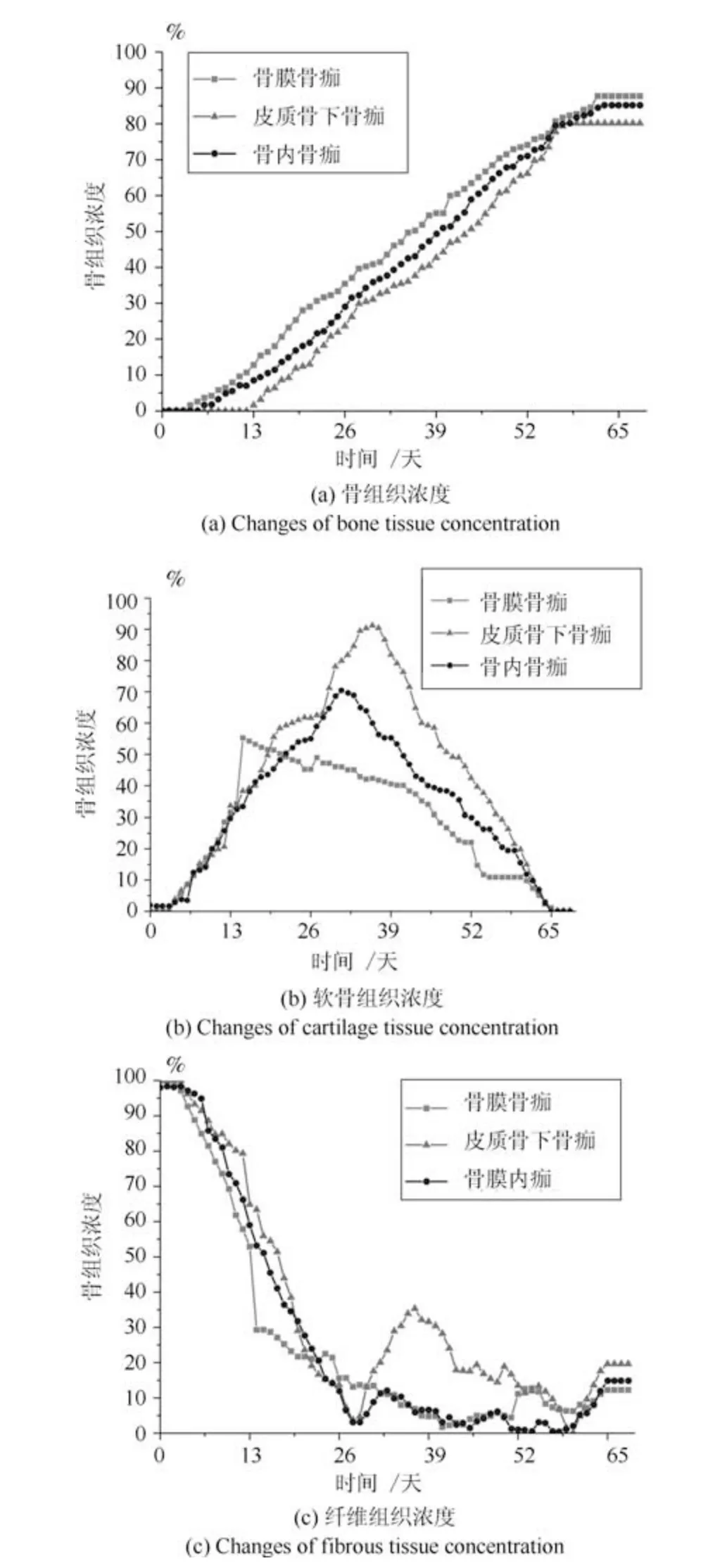
图7 0.5 mm 骨折间隙下的组织浓度变化Fig.7 Changes of tissue concentration in 0.5 mm gap size
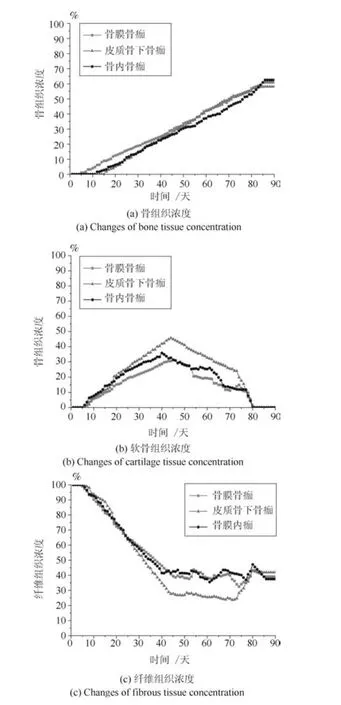
图8 3 mm 骨折间隙下的组织浓度变化Fig.8 Changes of tissue concentration in 3 mm gap size
2.4 组织高氧环境下的仿真结果分析
在组织高氧环境下,本文的仿真模型预测了0.5 mm 和3 mm 两种不同的骨折间隙时骨膜骨痂处、皮质骨下骨痂处、骨内骨痂处骨痂单元的骨组织浓度、软骨组织浓度以及纤维组织浓度随着愈合时间的变化情况,0.5 mm 骨折间隙时的仿真结果如图9 所示,3 mm 骨折间隙时的仿真结果如图10 所示.
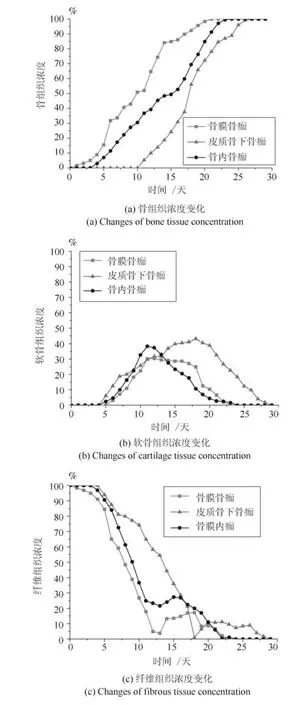
图9 0.5 mm 骨折间隙下的组织浓度变化Fig.9 Changes of tissue concentration in 0.5 mm gap size
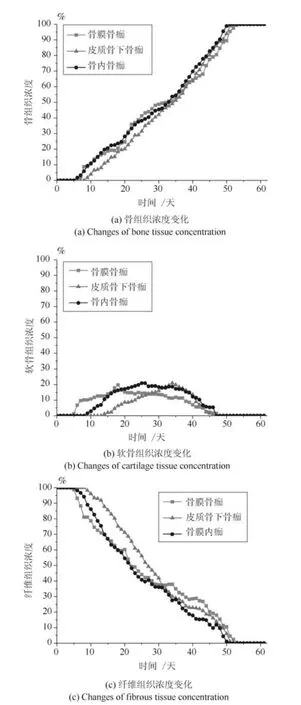
图10 3 mm 骨折间隙下的组织浓度变化Fig.10 Changes of tissue concentration in 3 mm gap size
在组织高氧环境下,随着愈合时间的增加,本文模型仿真预测的0.5 mm 骨折间隙和3 mm 骨折间隙的骨组织浓度都呈上升趋势,且最终达到了100%.与常氧环境下的愈合结果相比,0.5 mm 骨折间隙的仿真愈合时间为25 天,愈合加快,3 mm间隙仿真愈合时间为50 天.两种不同间隙时骨膜骨痂、皮质骨下骨痂和骨内骨痂处的骨组织浓度均逐渐增加,而骨膜骨痂处的骨组织最先生成,因为靠近骨膜处血供充足,氧气含量较其他骨痂处更高,所以骨先从此处生成,完成膜内骨化过程,随着愈合时间的增加,骨逐渐向骨折断端处生成.两种骨折间隙时软骨组织浓度均先升高后下降,表达了软骨生成、软骨钙化、骨化的过程.对于软骨的时空变化,在初始阶段,骨折断端处周围力刺激较高,不利于骨生成,因此在骨折断端处及周围生成软骨,完成软骨钙化过程,软骨的生成增加了骨痂对力的承受能力,有利于骨的生成,完成软骨骨化过程,因此,骨痂内的软骨含量是先增加后降低的.与组织常氧环境相比,组织高氧环境时软骨的生成量较低一些,这说明高氧环境不利于软骨细胞的分化,减少了软骨生成量.两种间隙时纤维组织浓度均呈下降趋势,因为在骨折愈合过程中纤维组织逐渐被骨组织取代.0.5 mm 间隙下断端稳定,纤维组织更快地被骨组织取代,3 mm 的不稳定断端导致纤维组织被骨组织取代延迟,进而导致了骨折愈合时间的延迟.三种组织浓度变化与常氧环境时趋势一致,但高氧环境下骨组织浓度高于常氧环境,软骨组织浓度低于常氧环境,说明高氧环境不利于软骨细胞的存活和分化,软骨生成较少,但有利于成骨,因此适当的高氧环境有利于骨折愈合.与常氧环境仿真结果相比,在组织高氧环境下,0.5 mm 间隙模型愈合时间为25 天,比常氧环境愈合时间短.3 mm 间隙模型愈合时间为50天,发生了延迟愈合.这表明骨折固定稳定性对骨折愈合有重要影响,同时,在常氧环境下,3 mm 间隙模型仿真结果为不愈合,这表明组织内氧环境对骨折愈合的影响比骨折固定稳定性更大,而组织内的高氧环境对骨折断端固定性不稳定的情况有一定促进愈合作用.
3 结论
本文建立了骨折处的力学模型,通过有限元方法求解影响组织分化的力刺激,通过三维扩散方程模拟组织内氧张力的时空变化,运用模糊控制的思想进行建模,研究组织分化的力学生物学调控.得到常氧、低氧和高氧环境下,0.5 mm 和3 mm 骨折间隙模型在骨痂内不同位置处骨组织浓度、软骨组织浓度和纤维组织浓度的时空变化,通过仿真得出以下结论:
综合考虑力刺激、氧气以及各组织浓度变量,建立包括6 输入2 输出、15 条模糊规则的骨痂组织分化的模糊控制模型,所建立的模型能够描述骨折愈合过程中骨折初期、膜内骨化、软骨生成、软骨钙化、软骨骨化等阶段.
将仿真获得的骨膜骨痂、皮质骨下骨痂以及骨内骨痂处的氧张力随时间的变化关系与实验数据、其他模型的仿真结果进行对比.得出:骨折愈合的一周内组织内的氧张力值呈下降趋势;在愈合的7 天后,随着血管的修复,组织内氧张力值逐渐增加,直到血管修复完好时,氧张力值趋于平稳;在骨膜骨痂以及骨内骨痂处氧气含量较高.
通过对0.5 mm 间隙和3 mm 间隙情况下骨折愈合过程进行仿真,分析骨间稳定性对骨折愈合的影响,得出:稳定固定更利于骨折的愈合,而骨折间隙较大时,断端稳定性较低,会引发不愈合或延迟愈合.
通过对常氧、低氧和高氧条件下的骨折愈合过程仿真,证实了氧气对骨折愈合过程的重要影响.得出:低氧环境会导致骨折延迟愈合或不愈合;常氧环境下,若骨折断端固定稳定则正常愈合;高氧环境下,对于断端固定稳定的情况骨折愈合加快,对于断端不稳定情况会延迟愈合,高氧有助于愈合过程中的组织修复.
骨折断端的力学和组织氧气环境对骨折愈合过程有极大的影响,是骨折愈合过程中最为重要的影响因素.由于骨折愈合是多因素共同调控的组织分化结果,同时多因素具有不确定性,因此使用模糊控制的方法可以更好地表达出骨折愈合过程,模拟组织分化的结果,得到更精确的预测数据.
骨折愈合过程动态仿真技术可以用于骨折固定器及相关医疗设备的设计及优化,可以为医生提供合理的手术方案以及术后康复训练方案,实现了个性化仿真,对实现临床医学的个性化、精准化具有不可替代的重要意义.同时计算机仿真减少了动物实验,节省了时间和费用,避免了人道主义争议.
本文也存在一些不足之处,比如本文研究了横形骨折的愈合情况,还应该对其他形状的骨折进行多样化的骨折愈合过程仿真.同时,在未来的研究中,还可以研究骨折愈合过程中各种细胞的代谢过程如何受氧气的影响.
