D-二聚体阴性的急性主动脉夹层的临床特点和影响因素分析
2021-03-04顾荣荣陈震罗钢
顾荣荣 陈震 罗钢
225400 蚌埠医学院附属泰兴市人民医院心血管内科
急性主动脉夹层(acute aortic dissection,AAD)是临床中的致命性心血管急症,典型的表现为急性发作的、剧烈的胸腹、腰背部疼痛,然而临床表现多种多样,缺乏特异性,典型的症状和体征并不多见,给快速诊断带来困难,容易造成误诊[1]。目前诊断AAD的主要方法有主动脉CT血管成像(computed tomography angiography,CTA)、磁共振血管成像、主动脉造影以及超声等影像手段,但上述方式或检查费用昂贵或在急诊科无法进行操作。有研究发现,AAD患者D-二聚体(D-dimer,D-D)水平明显升高,可用于其早期诊断及筛查[2]。但在临床工作中发现,D-D阴性的AAD时有发生,本研究旨在探讨其临床特点和影响因素。
1 对象和方法
1.1 临床资料
本研究为病例对照研究。入选2013年1月至2019年12月蚌埠医学院附属泰兴市人民医院确诊的发病时间小于24 h且临床症状以首次突发剧烈前胸、背部或腰腹部急性疼痛,并经主动脉CTA证实为AAD的患者67例,其中男性45例,女性22例,年龄29~96岁,平均(64.1±14.1)岁。纳入标准:(1)主动脉夹层急性起病,发病时间在24 h内,既往无主动脉夹层病史;(2)临床资料完整。排除标准:肺栓塞、深静脉血栓、主动脉瓣疾病、肝肾功能不全、凝血功能障碍、血液系统疾病、急性感染性疾病、低血压和休克的患者。所有入选患者自愿参加本研究,研究方案经泰兴市人民医院伦理委员会批准。
1.2 相关定义
发病时间根据急性主动脉夹层国际注册数据库(IRAD)提出的新的时间分类方法[3],将症状发作至24 h内定义为超急性期,本研究中患者出现初始症状距入院时间即发病时间均小于24 h。通过主动脉CTA、磁共振血管造影术或胸腹超声检查,按照2017年主动脉夹层诊断与治疗规范中国专家共识[4]进行诊断与分型。D-D参考值0~0.5 mg/L(快速ELISA法),D-D阴性的AAD患者共13例作为D-D阴性组,其他54例作为D-D阳性组。
1.3 研究方法
回顾性分析两组患者的临床资料,包括性别、年龄、既往病史和临床表现,以及实验室指标:白细胞计数、血小板计数、尿酸、中性粒细胞/淋巴细胞比值、血肌酐、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇。
1.4 统计学方法
2 结果
2.1 基线资料比较
两组患者的发病时间即出现初始症状距入院时间和Stanford A型发生率比较,差异有统计学意义(均为P<0.05),而性别、年龄、高血压病史、入院心率、血压及临床表现差异均无统计学意义,见表1。
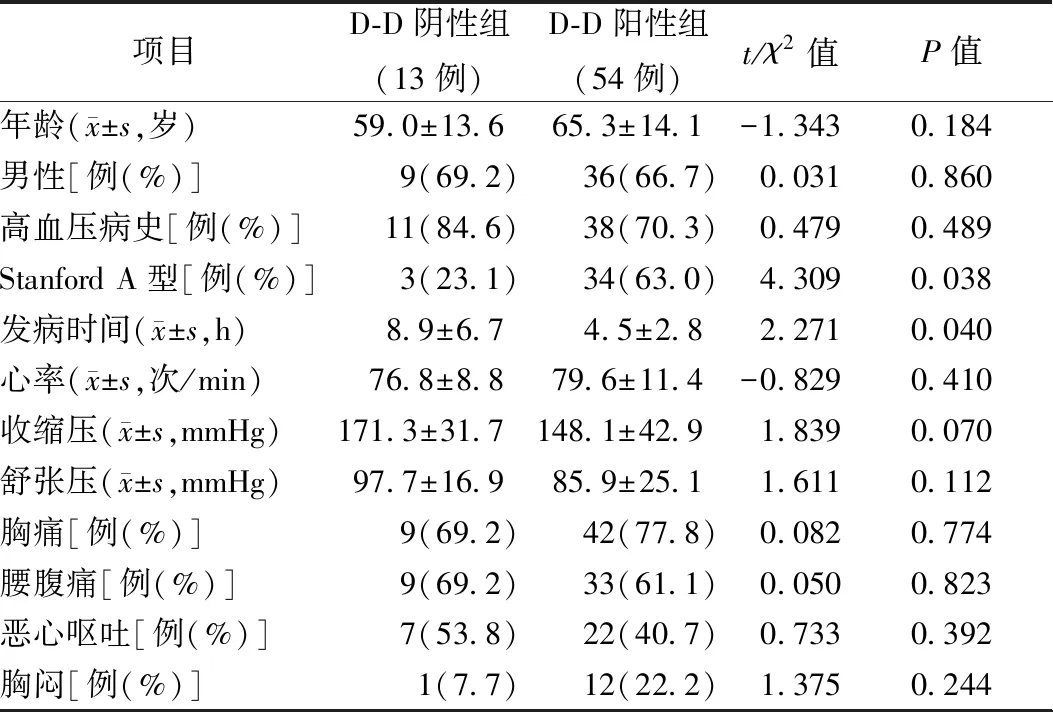
表1 两组患者的基线资料比较
2.2 实验室特征比较
两组患者的白细胞计数、血肌酐水平比较,差异有统计学意义(均为P<0.05),其他实验室指标间差异均无统计学意义,见表2。
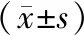
表2 两组患者的实验室特征比较
2.3 多因素logistic回归分析
以白细胞计数、发病时间、Stanford A型发生率和血肌酐水平作为自变量,以D-D是否阴性作为因变量进行logistic回归分析,结果显示发病时间、Stanford A型发生率是D-D阴性的AAD患者的独立影响因素(均为P<0.05),见表3。
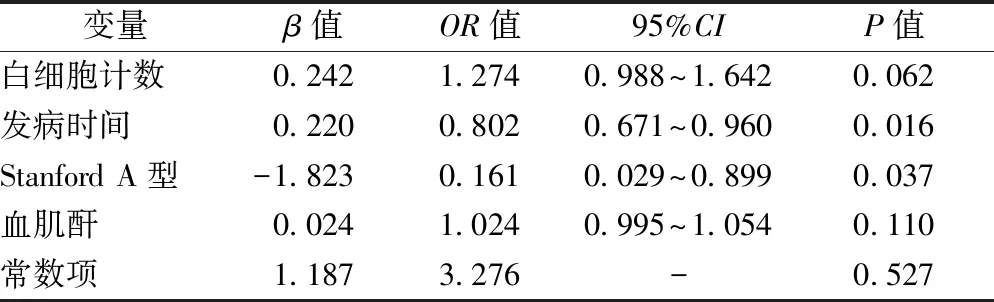
表3 D-D阴性的AAD患者影响因素分析
3 讨论
D-D是纤溶酶裂解纤维蛋白产生的降解产物,可用于诊断静脉血栓栓塞症等血栓性疾病[5],也有报道指出D-D可用于AAD的早期诊断及筛查[6]。Koch等[7]研究显示,在AAD中当D-D截断值为0.5 mg/L时,D-D诊断灵敏度较高,特异性较差,而当提高特异性时,灵敏度明显下降,提示D-D在排除AAD时容易造成漏诊及误诊。目前,D-D在排除AAD诊断中的作用已被广泛研究,而国内外对D-D阴性的AAD的相关研究鲜有报道。Brown等[8]指出,D-D阴性被认为不足以排除AAD。Nitta等[9]发现,与D-D阳性组相比,阴性组的AAD的撕裂范围较小,血小板计数较高,同时显示D-D阴性的主动脉夹层患者中有约33%的患者并发心脏压塞,提示需重视D-D阴性AAD的并发症情况。
本组数据显示,D-D阴性的AAD占AAD患者总数的19.4%,提示此类患者临床上并不罕见。与D-D阳性组比较,D-D阴性组的白细胞计数较低,既往有研究提示白细胞计数升高更容易出现在Stanford A型中,同时指出白细胞计数与撕裂范围呈正相关[10],根据Stanford的分型定义,Stanford A型夹层病变范围较广泛,累及脏器血管多,推测本研究中D-D阴性组白细胞计数低可能与其Stanford A型发生率低有关。Fan等[11]研究显示,白细胞计数升高的AAD患者心率、中性粒细胞/淋巴细胞比值和血肌酐水平较高,但血小板计数较低,与本研究结果基本一致,但本研究中未显示出白细胞计数低是D-D阴性的AAD患者的独立影响因素。
既往研究显示,D-D水平与撕裂范围相关,夹层撕裂范围越大,血D-D水平越高[12],推测D-D阴性组较阳性组撕裂范围局限,引起肾脏损伤的程度小,因此肌酐值较低。主动脉夹层患者常合并高血压,夹层常可累及肾动脉,可能会减少肾动脉供血,导致肌酐水平升高,而本研究中D-D阴性组的收缩压、舒张压水平均高于阳性组,与阳性组相比,肾脏处于高灌注状态,缺血损伤较轻,肌酐值较低。有研究提示,随着年龄的增长,肾单位的减少、肾小球毛细血管压的增加等病理改变可引起肾功能下降,会引起肌酐值升高,而本研究中两组年龄无显著差异。
周倩云等[13]研究发现,AAD病程越长,D-D水平呈现逐渐降低的趋势,与本研究中D-D阴性的AAD患者发病时间较长一致,并指出Stanford A型AAD患者的D-D水平较Stanford B型高,支持本研究中D-D阴性组Stanford A型AAD发生率低的结果。董凤雷等[14]研究发现,Stanford B型AAD常表现为典型的胸背部撕裂样疼痛,而本研究则发现Stanford B型AAD患者更容易出现D-D阴性,因此,临床医师需要提高警惕,对于典型胸背部疼痛的患者也不能仅由D-D阴性来排除AAD的诊断。
总之,D-D阴性的AAD患者在临床中并不罕见,不能仅凭D-D阴性来排除AAD。本研究显示,D-D阴性的AAD患者发病时间较长,Stanford B型更易出现,所以对于D-D阴性且发病时间较长的患者,临床医师特别是急诊医师需要根据患者的情况个体化综合评估。本研究是回顾性单中心临床研究,存在样本量较小、时间跨度大的局限,还需在今后的研究中进行多中心性、大样本量的研究。
利益冲突:无
