螺旋藻营养补充通过MEK/ERK信号途径改善运动疲劳大鼠海马损伤
2021-03-04朱洪竹邱萃珍朱梅菊丁孝民曾志刚
朱洪竹,左 铃,邱萃珍,朱梅菊,丁孝民,曾志刚
螺旋藻营养补充通过MEK/ERK信号途径改善运动疲劳大鼠海马损伤
*朱洪竹,左 铃,邱萃珍,朱梅菊,丁孝民,曾志刚
(井冈山大学体育学院,江西,吉安 343009)
探讨螺旋藻(SP)营养补充对MEK/ERK信号通路活性的调控及其在运动疲劳大鼠海马损伤中的作用。90只清洁级健康SD大鼠随机分为正常对照组(NC组)、运动模型组(EM组)、运动+SP组(ES组)、运动+MEK阻滞剂组(EPD组)、运动+SP+MEK阻滞剂组(ESPD组)、阳性对照组(PC组),共6组,每组均为15只。实验末,用免疫组化和免疫印迹法检测各组大鼠海马p-MEK、p-ERK和Actived Caspase-3蛋白的表达含量,生化法观察血清BUN和BLA含量的变化,同时行尼氏染色法观察海马神经元的病理形态学改变。(1)与NC组相比,其余组海马CA1区细胞结构呈不同程度的病理改变;与EM组、EPD组、ESPD相比,ES组损伤程度要轻,其细胞整体形态渐趋于PC组;ESPD组细胞整体形态要好于EM组,EM组要好于EPD组。(2)ES组血清BUN和BLA含量均显著低于EM组,且较PC组无明显区别。(3)ES组海马p-MEK和p-ERK表达均显著高于EM组、ESPD和EPD组,但显著低于PC组;而Actived Caspase-3表达则相反,显著低于EM组、EPD组和ESPD组,但稍高于PC组,两者无明显差别。螺旋藻营养补充能降低运动疲劳大鼠血清BUN和BLA含量,减轻海马形态损伤;其原因可能与其上调MEK和ERK的磷酸化水平和抑制Caspase-3活化而抑制细胞凋亡的神经保护作用有关。
运动疲劳;海马损伤;螺旋藻;MEK/ERK信号通路;Activated Caspase-3
细胞外信号调节激酶(extracellular signal- regulated kinase,ERK)是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路中的核心激酶,包括ERK1和ERK2。其上游为苏氨酸蛋白激酶(threonine-protein kinase,Raf)或丝裂原活化的细胞外信号调节激酶(mitogen-activated extracellular signal regulated kinase,MEK)。MEK蛋白通过磷酸化(即phosphorylated MEK,p-MEK),继而激活其下游ERK[1-2];ERK磷酸化成(phosphorylated ERK,p-ERK),并移位至细胞核内,进一步激活其下游底物,发挥促进细胞增殖、分化和抑制凋亡等生物学功能[3-5]。研究发现,激活ERK通路可减轻氧糖剥夺后大鼠海马神经元的凋亡[6]。过量运动会造成海马神经元细胞的损害,大强度运动训练可使大鼠海马CA1区神经元凋亡显著增加,凋亡可能是大强度运动引起中枢疲劳的病理生理机制[7]。但至目前为止,有关ERK信号蛋白与运动致海马神经元损伤方面的研究很少见。
螺旋藻(spirulina,SP)是一种营养全面、均衡的纯天然食品,具有抗疲劳、抗氧化、抗细胞凋亡等功效。前期研究表明,螺旋藻有改善疲劳运动机体海马脑组织损伤作用[8-9]。但有关螺旋藻抗疲劳机体海马细胞凋亡的研究报道较少。螺旋藻是否依赖其对MEK/ERK通路活性的调节而发挥疲劳机体海马组织损伤的保护作用,目前尚未阐明。
因此,本研究采用大鼠跑台运动疲劳模型,从MEK/ERK通路蛋白和Actived Caspase-3的活性变化方面,进一步探讨螺旋藻抗运动疲劳海马损伤的神经保护作用机制,为螺旋藻作为一种有效的、纯天然的抗运动诱导的中枢疲劳的功能因子提供实验证据。
1 材料与方法
1.1 实验材料
90只5周龄雄性健康SD大鼠[体质量: (180 ± 15)g],购自湖南斯莱克景达实验动物公司(动物许可证号:SCXK(湘)2011-0003,使用证:SYXK(赣)2017-0003)。饲养温度23~25℃,湿度45%~55%。兔抗鼠多克隆抗体p-MEK、p-ERK购于美国Santa Cruze有限公司,Actived Caspase-3测定试剂盒购于北京博奥森生物公司。血尿素氮(blood urea nitrogen, BUN)和血乳酸(blood lactic acid, BLA)试剂盒,均购于南京建成生物公司,严格按照试剂盒操作步骤进行。螺旋藻(SP)由宁波海鹰生物科技有限公司生产,纯度99%,临用前用生理盐水溶解。PD98059(2-(2-amino-3-methoxyphenyl) chromen-4-one,一种常用的MEK特异阻滞剂,简称PD),购自sigma公司。因人参是公认的抗疲劳的中药[10],故选为阳性对照药。昆明产人参100 g按文献[11]的方法[11]提取人参提取物10 g。提取物每mg相当于0.01 g生药,4℃保存待用。
1.2 实验方法
1.2.1 动物分组与药物剂量及给药方法
SD大鼠在SPF级环境喂养7 d后随机分为:正常对照组(NC组)、运动模型组(EM组)、运动+SP组(运动+SP灌胃,ES组)、运动+PD98059组(EPD组)、运动+SP+PD98059组(运动+SP灌胃+PD98059,ESPD组)、阳性对照组(运动+人参提取物,PC组),共6组,每组各15只。分笼饲养,每笼5只,自由饮食饮水。
螺旋藻及人参提取物:药物剂量换算参照文献[12]和预实验的结果进行。ES和ESPD组按每天300 mg/kg体重灌胃螺旋藻,灌胃体积2 mL/只;NC和EM组灌胃同等体积的生理盐水。PC组灌胃同等体积的人参提取物(1.92 g/kg.bw),1次/ d,每周7 d,连续3周,于运动前2 h内进行。
PD98059(PD):EPD组和ESPD组给药途径参照文献[13]和结合预实验经验按1 mg/kg.bw进行,采用腹腔注射方式,其余组注射等量的生理盐水,隔日注射1次,持续3周。
1.2.2 动物训练方案
除NC组外,其余组均采用跑台运动方式,让大鼠在ZH-PT电动动物实验跑台(安徽正华生物仪器设备公司)上进行为期3周的递增大强度负荷训练。运动方案参照汶希等[14]建立的大鼠跑台运动疲劳模型(见表1)。NC组以同等条件常规饲养,自由活动,不施加跑台训练干预。训练前大鼠先进行适应性跑台训练3 d(10~15 min/每次,1次/d),跑台坡度为0°,1次/d,7 d/周,连续训练3周。
表1 实验期间动物训练方案 (m/min× min)
Table 1 The program of exercise training in rats
周次星期一星期二星期三星期四星期五星期六星期日 第1周15×1515×1518×2018×2020×2520×2520×25 第2周22×2522×2525×3025×3028×3028×3530×35 第3周30×3535×3535×3535×4035×4038×4238×42
1.2.3 实验取材与指标检测
实验结束后,按完全随机法从15只大鼠中抽取10只,固定大鼠头部,眼眶取血,离心,取血清待测BUN和BLA含量。然后从以上10只大鼠中随机抽取6只制作石蜡标本,待行尼氏染色和免疫组化法;再从剩下的4只中随机抽取3只采用免疫印迹法(Western-blot)检测p-MEK、p-ERK表达。
免疫组化法和尼氏染色法:大鼠以10%的水合氯醛(剂量:0.4 mL/100 g)分批麻醉,暴露心脏后,左心室插管至主动脉,同时剪开右心耳,放静脉血;先灌注生理盐水,待肝脏变白时改灌注4%多聚甲醛100 mL;灌注完毕,断头,取出全脑,分离海马组织,左侧海马置入10%甲醛溶液中固定24 h以上,石蜡包埋。纵向连续切片,厚度为3~5 μm,用SABC法进行Actived Caspase-3免疫组织化学染色。严格按试剂盒操作说明书进行规范操作(一抗工作浓度为1:500)。加一抗(4℃冰箱过夜),加二抗(37℃孵育1 h),DAB显色,脱水,透明,封片。用BX41型光学显微镜(OLYMPUS公司,日本)来检测阳性表达。测定免疫组化阳性染色的光密度(OD)值,取平均值作为测定值,其值越大表示Actived Caspase-3阳性产物表达越强。
取上述灌注的海马组织右侧,放入10%甲醛溶液中固定24 h以上,石蜡包埋,连续切片(3~5 μm厚度)。常规方法行尼氏染色。光镜下观察海马CA1区神经元损伤情况。
Western-blot法:麻醉的大鼠,断头取全脑,冰浴上分开两侧大脑半球,小心剥去大脑皮层,分离海马组织,分装标记后置-80℃冰箱保存。取出冻存的海马组织,充分匀浆,常规方法提取总蛋白,用BCA法测定其蛋白浓度。样品30 μg经SDS-PAGE电泳后,转膜,封闭,洗膜,加一抗(工作浓度分别1:800和1:500)孵育2 h,加二抗室温摇动孵育1.5 h。充分洗膜后曝光、显色、定影,用Gel-Pro Analyzer凝胶电泳图像软件测定条带灰度值,以蛋白条带中的灰度值/内参GAPDH灰度值)的比值大小作为蛋白的相对表达量。
1.2.4 数据处理
实验结果以Mean±SD表示,并采用单因素方差(one-way ANOVA)分析行均数间差异显著性检验,< 0.05为差异显著,< 0.01为差异极显著。统计学处理均在SPSS Statistics16.0统计软件上完成。
2 结果
2.1 各组大鼠一般情况和生化指标的变化
实验期间,正常对照NC组大鼠活泼好动,毛发发亮;运动模型EM组大鼠多见活动次数减少,神情呆滞且毛发无光泽、稀疏枯黄等疲劳症状;补充螺旋藻的ES组大鼠上述疲劳症状得到改善,也要好于ESPD和EPD两组大鼠。
如表2表示,EM组血清BUN和BLA含量明显高于NC组(均< 0.01);与EM组相比,ES组的BUN和BLA含量均显著降低(< 0.01),且稍高于PC组(> 0.05);ES组BUN含量低于EPD组和ESPD组(< 0.05或< 0.01),其BLA含量显著低于EPD组。
表2 各组大鼠实验期间血清BUN和BLA含量的变化(=10)
Table 2 Changes of serum BUN and BLA content of rats in various groups
组别BUN(mmol/L)BLA(mmol/L) NC 组5.86 ± 1.541.58 ± 0.18 EM 组9.85 ± 1.23**10.93 ± 2.11** ES 组6.69 ± 1.86# #8.54 ± 1.89**# # EPD 组11.55 ± 3.64**#▲▲10.99 ± 2.23**▲▲ ESPD 组8.89 ± 1.49**▲△9.20 ± 1.72**#△ PC组6.24 ± 1.92# #△△7.94 ± 1.75**# #△△
注:*:< 0.05,**:< 0.01 与NC组比较;#:< 0.05,# #:< 0.01与EM组比较;▲:< 0.05,▲▲:< 0.01与ES组比较;△:< 0.05,△△:< 0.01与EPD组比较
2.2 各组大鼠海马CA1区尼氏染色结果
尼氏染色病理学检测结果显示,NC组海马神经元胞体、胞核大小规则,胞核呈圆形、淡染,细胞尼氏体丰富,着色清晰,神经元形态结构完整且排列紧密。与NC组比较,其余组海马形态结构出现不同程度的病理改变:细胞结构塌陷,胞体、胞核缩小,形态结构紊乱异常,尼氏体含量减少且多数消失不见等。与ESPD组、EM组、EPD组相比,ES组病变程度要轻,表现为海马神经元所含尼氏体数量逐渐增加,神经元结构渐趋完整清晰,其细胞整体形态渐趋于PC组;ESPD组要好于EM组,EM组要好于EPD组。

2.3 各组大鼠海马Actived Caspase-3免疫组化染色
免疫组化结果显示,NC组海马神经元Actived Caspase-3阳性表达不明显。与NC组相比,其余组海马Actived Caspase-3表达逐渐增加(< 0.01),阳性细胞多且染色逐渐加深,呈明显的棕黄色或棕褐色颗粒。与ESPD组、EM组、EPD组相比,ES组的该蛋白表达均降低(< 0.05或< 0.01);其中ESPD组稍低于EM组(> 0.05),EM组要低于EPD组(< 0.05)。ES组虽该蛋白表达稍高于PC组,但两者相比已无明显差别(> 0.05)。(见图2和图3)

图2 各组大鼠海马组织Actived Caspase-3免疫组化染色(×400)
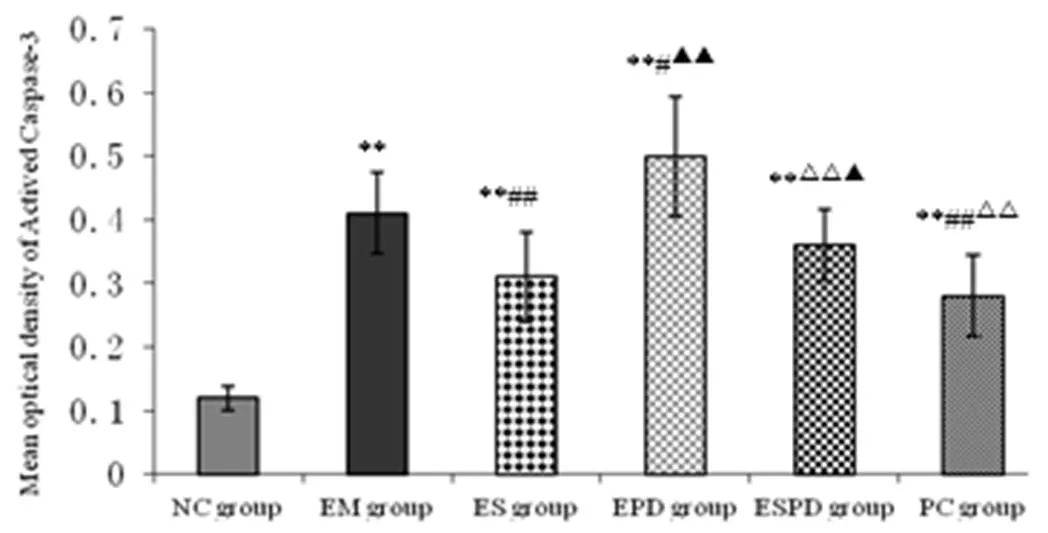
注:*: P < 0.05, **: P < 0.01 与NC组比较; #: P < 0.05, # #: P < 0.01 与EM 组比较; ▲: P < 0.05,▲▲:P < 0.01与ES 组比较;△: P < 0.05,△△: P<0.01 与EPD 组比较
2.4 各组大鼠海马p-MEK和p-ERK蛋白表达变化
如图4和图5所示,NC组海马ERK蛋白及ERK磷酸化蛋白(p-ERK)表达不明显;与NC组相比,EM组海马ERK和p-ERK蛋白表达均显著增加(< 0.01);与EM组相比,ES组、PC组的ERK和p-ERK蛋白均有明显表达(< 0.05或< 0.01),而EPD组表达则显著降低(< 0.01);ES组的两蛋白表达明显高于EPD组和ESPD组(< 0.05或< 0.01);EPD组和ESPD组相比,后者表达较前者明显(< 0.05或< 0.01)。
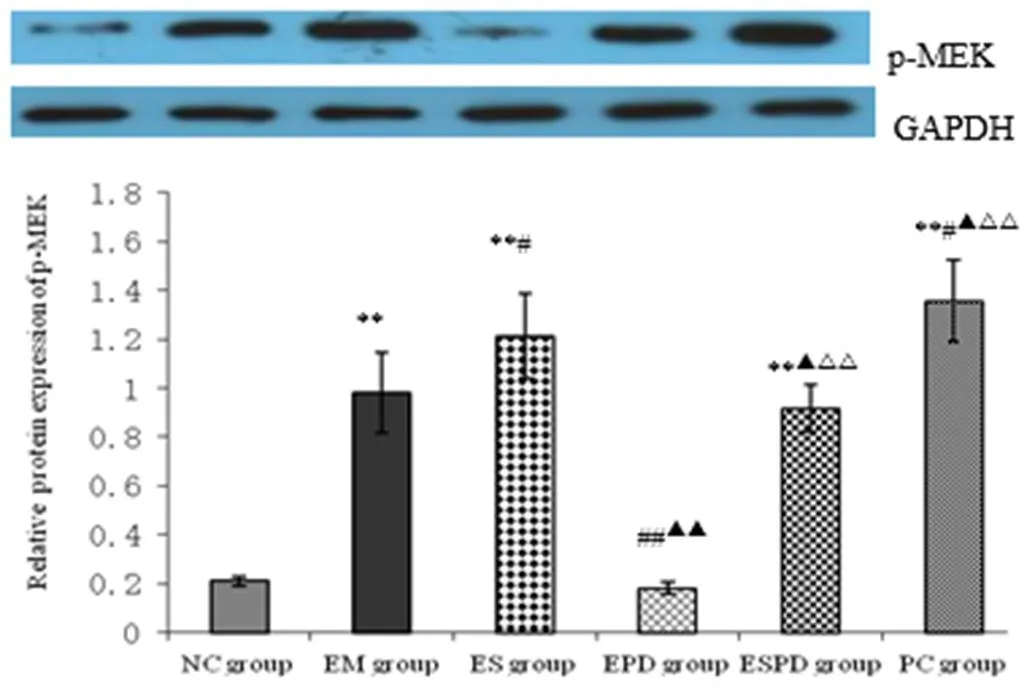
注:*: P < 0.05, **: P < 0.01 与NC组比较; #: P < 0.05, # #: P < 0.01 与EM 组比较; ▲: P < 0.05,▲▲:P < 0.01与ES 组比较;△: P < 0.05,△△: P < 0.01 与EPD 组比较。图5与此相同。
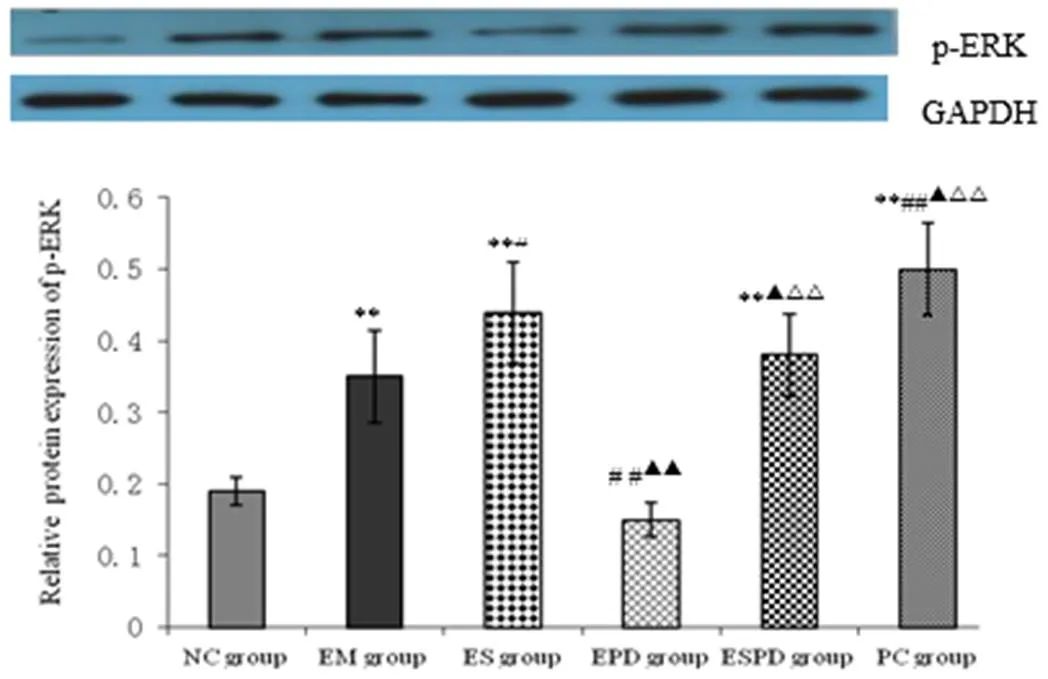
图5 各组大鼠海马组织 p-ERK蛋白相对表达量的变化(n=3)
3 讨论
血尿素氮(BUN)和血乳酸(BLA)是反映大鼠运动负荷和评价机体疲劳程度的敏感指标[15]。本研究结果表明本实验训练负荷下大鼠产生了不适应,出现了神疲乏力、活动次数减少等疲劳的某些特征;同时光镜下观察到海马CA1区神经元细胞结构异常、部分尼氏小体减少并消失不见等病理损伤现象,提示本实验的运动方式已使海马CA1区神经元发生形态改变[16]。本实验结果与前期研究[8-9]再次证明3周的递增负荷运动疲劳模型足以诱导大鼠海马神经元出现明显损伤。而螺旋藻能有效降低递增负荷运动大鼠血BUN和BLA含量,并保护运动疲劳鼠海马的形态,显示其神经保护作用。
凋亡是海马脑组织神经元死亡的一种重要形式。近年研究神经元凋亡的热点之一是探讨 MAPK信号通路的作用[17]。ERK信号途径是MAPK的家族成员,ERK及其上游蛋白MEK是MAPK信号通路的关键物质。MEK通过磷酸化后激活ERK分子,被激活的ERK进一步磷酸化下游激酶,调节转录因子活性,产生的细胞效应与细胞生长、发育、基因转录、神经细胞凋亡和保护机制等有关[18-19]。因而ERK信号途径可作为脑内神经元活动的形态标志物[20]。本研究发现,大鼠经3周递增负荷运动后,海马组织MEK的磷酸化(p-MEK)和ERK的磷酸化(p-ERK)水平均上调,MEK/ERK信号显著激活,与先前研究一致[21]。研究表明各种有害应激引起脑细胞缺血缺氧损伤后可造成海马大量神经元细胞丢失,而其病理基础主要是细胞凋亡[7]。递增负荷运动可通过抑制神经元中B细胞淋巴瘤/白血病B cell lymphoma/lewkmiabcl-2蛋白的表达从而增加Bcl-2相关X蛋白(Bcl-2 Associated X Protein, bax)蛋白的表达,这有可能是大强度递增负荷运动诱导大鼠海马CA1区神经元凋亡发生的基因调控机制[7]。半胱氨酸蛋白酶3(cysteinyl aspartate specific proteinase-3,Caspase-3)是细胞凋亡的驱动器和关键执行分子,其活化是细胞程序性死亡中细胞蛋白裂解的一个重要环节[22]。
本研究显示的运动能引起大鼠海马脑组织Activated Caspase-3(Caspase-3的活化形式)表达上调,即发生细胞凋亡。但在用MEK的特异阻滞剂 PD98059阻断ERK上游激酶MEK通路后,MEK和ERK的磷酸化水平明显降低,同时Activated Caspase-3表达最高,海马神经元损伤也更严重。这提示:(1)特异性地抑制ERK的上游激酶 MEK蛋白,它通过与非活性的MEK结合来抑制MEK的激活与磷酸化,有阻断ERK通路的作用。(2)阻断ERK通路后运动不能有效促进ERK通路激活,但特异地阻断ERK通路激活可促进细胞凋亡[6,23],说明ERK通路蛋白表达上调能抗细胞凋亡[6],通过此途径而达到脑保护作用。以往研究揭示,在脑缺血后ERK活性增加与改善神经元存活有关,促进神经元的增殖分化,减少凋亡[24];ERK信号通路的激活,介导脑缺血缺氧后神经保护,在脑缺血性神经损伤修复机制中起关键作用。研究已知,ERK信号通路是应激诱发的神经元胞内信号转导通路中的关键分子[20],可被运动[21]、缺血缺氧[24]等多种应激激活。由此可推测,本实验中递增运动造成大鼠脑相对缺氧缺血损伤海马神经元,可能应激性诱导ERK信号表达上调[20-21,24];ERK通路蛋白表达增加有可能是细胞自身针对缺血缺氧刺激而应激性的引起的修复过程,起到抗凋亡的保护机制,而该过程可能由活化的ERK蛋白激酶介导[6]。
螺旋藻是海洋生物中营养成分最全面、最均衡的天然食品,几乎含有人体所需的全部营养要素。螺旋藻营养片能明显抑制脑细胞中的单胺氧化酶B活性,提高血清乳酸脱氢酶活性及加速运动后BLA的清除;有抗中枢疲劳作用[25]。螺旋藻中的藻蓝蛋白能通过下调皮质和纹状体区重要炎性因子(NF-kB与lL-6)的表达而抑制脑缺血引起的细胞凋亡发挥其神经保护作用[26]。螺旋藻多糖也可通过修复线粒体氧化应激损伤及减少脑组织Aβ蛋白的积累来保护阿尔茨海默病模型小鼠脑功能[27]。但其研究大多只涉及螺旋藻抗氧化、抗炎症及减少Aβ蛋白积聚方面,螺旋藻对运动引起的海马神经元损伤报道较少,其神经保护作用是否通过调节MEK/ERK信号蛋白实现?目前尚不明确。本项研究进一步表明,螺旋藻能够进一步上调运动大鼠海马MEK和ERK磷酸化水平,下调Activated Caspase-3表达而降低细胞凋亡,显示出明显的神经保护作用。提示,螺旋藻可能通过MEK/ERK信号途径介导而产生脑保护效应,即抗神经细胞凋亡。李春等研究显示[28],电针处理的脑缺血再灌注大鼠,其受损神经元ERK蛋白表达明显上调,细胞凋亡指数明显下降,表明电针有助于神经元损伤修复和抗细胞凋亡。虽然两者实验对象、实验方案、运动方式和干预手段等不同,但螺旋藻与电针处理均有上调海马ERK通路蛋白表达及抑制细胞凋亡的神经保护效应。而在ESPD组中,ERK通路被抑制剂PD98059阻断的状态下,螺旋藻仍能有效激活ERK信号,使其上调,从而使其出现较PD98059阻滞剂EPD组稍轻程度的凋亡和神经元损伤。推测螺旋藻可能还通过如MAPK家族其他信号通路对运动致脑损伤进行保护,抗细胞凋亡。有关本研究相关信号通路我们将作进一步的研究。
4 小结
本研究结果表明,3周递增负荷运动增加了MEK和ERK蛋白的磷酸化水平,MEK/ERK信号途径可能参与了运动引起的大鼠海马神经元损伤的修复和保护过程。螺旋藻营养补充能进一步上调运动鼠海马MEK/ERK信号及降低活化凋亡蛋白(Activated Caspase-3)水平而抑制细胞凋亡,从而表现出明显的抗海马损伤的作用。本实验结果显示的螺旋藻调控MEK/ ERK信号通路活性,抑制神经细胞凋亡,可能是其抗运动鼠海马损伤的关键作用机制之一。因而,建议运动员在进行大强度运动时注意膳食中合理地进补适量的螺旋藻。本研究为运用运动营养措施消除疲劳和促进体能恢复的体育训练教学提供相关科学数据参考。
[1] 关永格,何昱雯,李坤寅,等.芍药甘草汤对子宫腺肌病细胞Ras、Raf、MEK-2的影响[J].辽宁中医杂 志,2014,41(7):1530-1532.
[2] 李鑫,朱文浩,高颖. ERK1/2通路及其介导多发性硬化发病的研究进展[J].世界科学技术-中医药现代化,2015, 17(4):880-884.
[3] Kamio N,Akifusa S,Yamagnchi N,et al.Induction of granulocyte colony-stimulating factor by globularadipo- nectin via the MEK-ERK pathway[J].Molec Cellul Endocrinol, 2008, 292(1-2): 20-25.
[4] 蒋丽珠,黄菊芳,李昌琪. 外源性BDNF对急性高眼压后大鼠视网膜ERK1/2磷酸化的影响[J].神经解剖学杂志,2008,24(5):492-495.
[5] 包伍叶,宋映周,图娅,等. 电针对慢性应激抑郁大鼠脑内ERK信号转导通路的影响[J].中华中医药杂志,2014, 29(6):2009-2011.
[6] 华辟,丁新生,孔岳南. 细胞外信号调节激酶对氧糖剥夺后大鼠海马神经元的作用研究[J].南京医科大学学报:自然科学版,2011,31(2):185-189.
[7] 张梅,何叶. 长期力竭性训练对大鼠海马神经元凋亡的影响[J].北京体育大学学报,2007,30(8):1060-1062.
[8] 朱洪竹,朱梅菊,曾志刚. 螺旋藻对递增大强度运动诱导大鼠海马形态结构损伤和BDNF 表达变化的影响[J].井冈山大学学报:自然科学版, 2017,38 (5):78-84.
[9] 朱洪竹,张莹,朱梅菊,等.螺旋藻对运动疲劳大鼠海马损伤的保护作用及机制研究[J].中国应用生理学杂志,2018, 34(6)562-567.
[10] 王莹,蔡东联.人参抗疲劳作用研究进展[J].氨基酸和生物资源,2005,27(3):68-70.
[11] 朱梅菊,蔡彩凤,朱洪竹,等.密穗马先蒿不同萃取部位抗运动性疲劳的体内活性研究[J].天然产物研究与开发,2012,24(11):1545-1548.
[12] 贺石林.中医科研设计与统计方法[M].长沙:湖南科学技术出版社,1988:55-66.
[13] Yang X M, Proctor J B, Cui L,et al. Multiple, brief coronary occlusions during early reperfusion protect rabbit hearts by targeting cell signaling pathways[J].J Am Coll Cardiol,2004,44:1103-10.
[14] 汶希,潘华山. 大鼠运动性疲劳模型的建立[J].中国实验动物学报,2009,17,(5):368-372.
[15] 黄诚胤,潘建华,李慧. 表没食子儿茶素没食子酸酯对小鼠运动疲劳的拮抗作用[J].中国应用生理学杂志,2015, 31(1):85-88.
[16] 满君,田野,高颀. 过度运动对海马神经元形态及脑源性神经营养因子表达的影响[J].中国运动医学杂志,2004, 23(5):510-512.
[17] 王巧云,刘凤,吴峰阶. 人参皂苷Rg1对局灶性脑缺血再灌注损伤大鼠海马p-ERK1/2与P-JNK表达的影响[J].中国中西医结合杂志,2013,33(2):229-234.
[18] Kyriakis JM,Avruch J. Mam malian mitogen-activatedprotein kinases signal transduction pathways activated bystress and inflammation[J].Physiol Rev,2001,81(2): 807-869.
[19] 罗春梅,李佩芳. 缺血性脑损伤神经修复的ERK通路及针灸对ERK通路影响的实验研究进展[J].河南中医,2012,32(9):1145-1146.
[20] Imbe H, Murakamia S, Okamoto K,et al. The effects of acute and chromic restraint stress on activation of ERK in the rostral ventromedial medulla and locus coeruless[J].Pain, 2004,112(3):361-371.
[21] Taylor L W,Wilborn C D,Kreider R B,et al. Effects ofresistance exercise intensity on extracellular signal-regulatedkinase 1/2 mitogen-activated protein kinase activationin men[J].The Journal of Strength &Conditioning Research, 2012,26(3) : 599-607.
[22] 覃艮艳,张又玮,彭晓芳,等. 密蒙花滴眼液对去势兔干眼模型泪腺细胞凋亡相关因子Caspase-3、Caspase-8的干预作用[J].中国中西医结合杂志,2019,39(9): 1072-1077.
[23] Lebesgue D,Chevaleyre V,Zukin RS,et al.Estradiol rescues neurons from global ischemia-induced cell death: multiple cellular pathways of neuroprotection[J]. Steroids, 2009,74(7):555-561.
[24] Li F,Omori N,Sato K,et al.Coordinate expression of survival p-ERK and proapoptotic cytochrome signals in rat brain neurons after transient MCAO[J].Brain Res,2002,958(1):83-88.
[25] 朱梅菊,李世成,陈灵光. NR1、NR2A和NR2B在运动性疲劳大鼠海马组织中的表达及配方的调节作用[J].体育科学,2006, 26(6): 71-74.
[26] 张冬梅. 藻蓝蛋白对脑缺血再灌注后NF-κB和IL-6表达及神经细胞凋亡的影响[J].中国海洋药物杂志,2005, 24(6):6-10.
[27] 林智君,陈煜森,郑选梅,等. 螺旋藻多糖对阿尔茨海默病模型小鼠脑线粒体氧化应激保护[J].海南医学2016, 27(11):1731-1733.
[28] 李春,周国平,尹景春. 针灸抗脑神经细胞凋亡的ERK机制探讨[J].湖南中医杂志,2014,30(2):66-68.
PROTECTIVE EFFECTS OF SPIRULINA ON EXERCISE-INDUCED HIPPOCAMPAL INJURY FOR FATIGUE RATS VIA REGULATING MEK/ERK SIGNAL PATHWAY
*ZHU Hong-zhu, ZUO Ling, QIU Cui-zhen, ZHU Mei-ju, DING Xiao-min, ZENG Zhi-gang
(School of Sports, Jinggangshan University, Ji’an, Jiangxi 343009, China)
To investigate the protective effects of spirulina(SP) on exercise- induced hippocampal injury for fatigue mice via regulating MEK/ERK signaling pathway.SD rats were randomly divided into six groups: normal control group(NC), high intensity exercise model group (EM),`exercise plus spirulina group (ES), exercise plus PD98059 group (EPD), exercise plus spirulina plus PD98059 group (ESPD), and positive control group (PC), 15 rats each group. At the end of the experiment, p-MEK, p-ERK and Actived Caspase-3 expression content were detected by immune-histochemistry and western blot analysis, serum BUN and BLA content were observed by biochemical methods, and micromorphological changes in hippocampal CA1 were detected by Nissl staining.Compared withNC group, other groups displayed abnormal phenomenons; Compared with EM, EPD and ESPD group, the damage degree of the cell structure of ES group with SP treatment was milden, and was closer to PC group; the cell structure of ESPD group was better than that of EM group, and the cell structure of EM group was better than that of EPD group. Compared withEMgroup,serum BUN and BLA content in ESgroup decreased significantly, and there was no difference compared to PC group. p-MEK and p-ERK protein expressions in ES group were significantly higher than that of EM, ESPD and EPD group, but were lower than that of PC group;while Actived Caspase-3 expression decreased obviously compared to EM, ESPD and EPD group, but was slightly higher than that of PC group.SP could reduce serum BUN and BLA content, and improve hippocampus morpholohy injury. Its mechanism was related to SP further increased p-MEK and p-ERK expression, and reduced ActivedCaspase-3 expression to inhibit cell apoptosis in the exercise rats.
exercise fatigue; hippocampal injury; spirulina; MEK/ERK signal pathway; Activated Caspase-3
R285.5
A
10.3969/j.issn.1674-8085.2021.01.014
1674-8085(2021)01-0082-07
2020-10-10;
2020-11-26
国家自然科学基金资助项目(31660291,31360255);江西省自然科学基金项目(20202BABL206124,20192BAB205092);江西省教育厅科技计划项目(GJJ190562,GJJ150770)
*朱洪竹(1976-),女,湖南娄底人,副教授,博士,主要从事运动疲劳的中医药防治与机理研究(E-mail:zhuhongzhu2007@163.com);
左 铃(1998-),女,湖南湘乡人,井冈山大学体育学院体育教育专业2016级本科生(E-mail:1535401294@qq.com);
邱萃珍(1999-),女,江西赣州人,井冈山大学体育学院社会体育指导与管理专业2017级本科生(E-mail:2529134006@qq.com);
朱梅菊(1968-),女,湖南双峰人,教授,博士,主要从事运动性疲劳的中医药防治研究(E-mail: zhu_mj@163.com);
丁孝民(1981-),男,山东济宁人,讲师,博士,主要从事运动生理学研究(E-mail:34028081@qq.com);
曾志刚(1976-),男,江西吉安人,副教授,博士,主要从事运动生理学研究(E-mail: 33083180@ qq.com).
