胸腔镜手术治疗新生儿先天性膈疝复发的影响因素分析及其对复发膈疝的治疗效果
2021-03-04张燕敏李清智吴公景赵孟天葛大海
赵 萍 刘 翔 左 伟 高 威 张燕敏 李清智 吴公景 吴 迪 赵孟天 葛大海
先天性膈疝(congenital diaphragmatic hernia,CDH)是一种先天性发育畸形,发病率为1/3 000[1],其特征是胚胎期膈肌发育缺损,腹腔脏器疝入胸腔,同时伴有不同程度肺发育不良和肺动脉高压(pulmonary hypertension,PHT)。 随着微创手术的发展,胸腔镜在CDH 治疗中的应用逐渐增多,优势显著,但仍存在术后复发率高的缺点。 国外文献报道胸腔镜治疗CDH 后复发率差异较大,为3. 6%~43%[2-6]。 本研究选择2013 年1 月至2019 年7 月在安徽省儿童医院新生儿外科经胸腔镜治疗的62例新生儿CDH 作为研究对象,旨在分析胸腔镜CDH 术后复发的影响因素。
材料与方法
一、研究对象
本研究选择2013 年1 月至2019 年7 月在安徽省儿童医院新生儿外科经胸腔镜治疗的新生儿CDH 患者作为研究对象,纳入标准: ①通过胸部X线片或上消化道造影、胸部CT 明确诊断为CDH;②年龄<28 d; ③胎龄>37 周; ④体重>2 000 g;⑤行胸腔镜CDH 修补术。 排除标准: ①术中中转开放手术; ②术后死亡且病程中未复发者。 本研究共62 例CDH 患者,排除非新生儿期(年龄1 ~3 个月)4 例,排除中转开放手术10 例,排除术后死亡且病程中未复发3 例,1 例虽术后死亡但已有明确证据表明其复发而纳入本研究,最终共纳入45 例完成胸腔镜修补术的新生儿CDH 作为研究对象。
二、手术方法
所有患者在内环境纠正至稳定之后进行胸腔镜手术。 内环境稳定需要符合以下标准: ①插管前氧饱和度为80%~95%; ②pH 值在正常范围; ③心率正常; ④毛细血管充盈时间<3 s; ⑤尿量>2.0 mL·kg-1·h-1; ⑥乳酸浓度<3 mmol/L。 待患者麻醉状态平稳后,取健侧卧位,患侧手臂上抬。 于患侧第四肋间肩胛下角处置入5 mm Trocar,注入CO2气体,压力4 mmHg,置入腔镜;再分别于患侧第四肋间腋前线和肩胛下角与脊柱连线中点处置入3 mm Trocar,放入抓钳。 将胸腔内压力逐步上调至6 mmHg,在气胸压力及抓钳辅助下,将疝内容物逐步复位至腹腔。 胸腔镜下以操作钳两钳口张开最大时的距离作为一个标准单位,在冠状面上测量膈肌缺损处的最大横径,在矢状面上测量缺损的最大前后径,换算成具体数值后,以缺损最大横径×缺损最大前后径来记录膈肌缺损范围。 随机选择切除疝囊与否。 采用不可吸收缝线间断缝合缺损膈肌;对于膈肌缺损巨大的,加用补片修补。 术毕留置胸腔引流管。
三、研究内容
总结胸腔镜CDH 术后复发患者的出生情况、合并畸形、手术情况、复发情况及预后转归等。 复发病例均经过胸部X 线片、CT 或上消化道造影确诊。根据胸腔镜CDH 术后是否复发将患者分为复发组和未复发组。 对首次胸腔镜手术时两组病例的性别、出生体重、入院年龄、产前诊断、合并心脏畸形、术前PTH 及合并粗大PDA、术前呼吸机支持、手术年龄、膈疝位置、肝疝入、脾疝入、胃疝入、膈肌缺损范围、疝囊、补片及手术时间等数据进行比较分析。
四、统计学处理
采用SPSS 22.0 统计学软件进行数据的整理与分析。 对于出生体重、手术时间等服从正态分布的计量资料以均数加减标准差(±s)表示,两组间比较采用独立样本t检验;对于入院年龄、手术时年龄等偏态分布资料以中位数和四分位数间距[M(P25,P75)]表示,两组间比较采用两样本比较的秩和检验。 对于性别、产前诊断、合并心脏畸形、术前PTH及合并粗大PDA、术前呼吸机支持、膈疝位置、肝疝入、脾疝入、胃疝入、膈肌缺损范围(≥5 cm ×4 cm)、疝囊、有无补片等计数资料采用频数分析,两组间比较采用χ2检验。 以P<0.05 为差异有统计学意义。
结 果
45 例新生儿顺利完成胸腔镜CDH 修补术。 45例均为足月儿,入院年龄1 h 至23 d;出生体重2 400 ~4 000 g,平均(3 154.88 ±407.13) g;其中男26 例,女19 例。 13 例产前明确诊断为CDH;术前合并心脏先天畸形包括房间隔缺损(atrial septal defect,ASD)、室间隔缺损(ventricular septal defect,VSD)、 动 脉 导 管 未 闭(patent ductus arteriosus,PDA),其中一项、两项或三项同时合并者共30 例。术前18 例需呼吸机支持;左侧CDH 39 例,右侧CDH 6 例;膈肌缺损范围2 cm ×2 cm 至6 cm ×6 cm;保留疝囊9 例,切除疝囊及无疝囊者共36 例;1例使用补片;手术时间38 ~210 min,平均(95.31 ±34.80)min;术后呼吸机支持时间15 h 至21 d;住院时间8 ~36 d,平均(20.29 ±8.44) d。 术后1 例出现气胸,4 例胸腔积液,1 例粘连性肠梗阻。
术后随访时间为6 个月至5 年,8 例复发,总复发率17.8%;其中2016—2019 年的术后复发率(2/26,7.7%)低于2013—2015 年(6/19,31. 6%),但差异无统计学意义(χ2=2.807,P=0.09)。 复发组中术前有2 例(25. 00%)同时合并PHT 和粗大PDA,未复发组术前无一例合并PHT 和粗大PDA,差异有统计学意义(P=0.03)。 大型膈肌缺损(缺损面积≥5 cm ×4 cm)的CDH 患者术后复发率为45.5%(5/11),高于小、中型膈肌缺损(缺损面积<5 cm×4 cm)患者(8.8%,3/34),差异有统计学意义(χ2=5.329,P=0.02)。 2013—2015 年复发组手术时间为(132. 83 ± 49. 32)min,长于未复发组(87.92 ±22.47)min,差异有统计学意义(t=2.779,P=0. 01);而2016—2019 年复发组手术时间为(91.50 ±12.02)min,与未复发组手术时间(90.50±33.01)min 相比,差异无统计学意义(t=0.042,P=0.97)。 患者一般资料如性别、出生体重、入院年龄、伴发心脏畸形及术前单纯PHT 在复发组与非复发组比较无明显差异(P>0.05);复发组与非复发组在是否产前明确诊断、术前是否呼吸机支持、手术年龄、膈疝左右侧位置、有无肝疝入、有无脾疝入、有无胃疝入、保留或切除/无疝囊及有无使用补片方面比较无明显区别,差异无统计学意义(P>0.05),详见表1。
8 例复发患者中,男5 例,女3 例;左侧膈疝6例,右侧膈疝2 例。 复发患者初次手术时膈肌缺损范围在4 cm×3 cm 至6 cm×6 cm,1 例使用补片,3例有疝囊。 8 例复发患者一般情况及首次手术治疗情况见表2。

表1 复发组与未复发组CDH 相关因素的比较Table 1 Comparison of variables between recurrence and non-recurrence groups

续上表
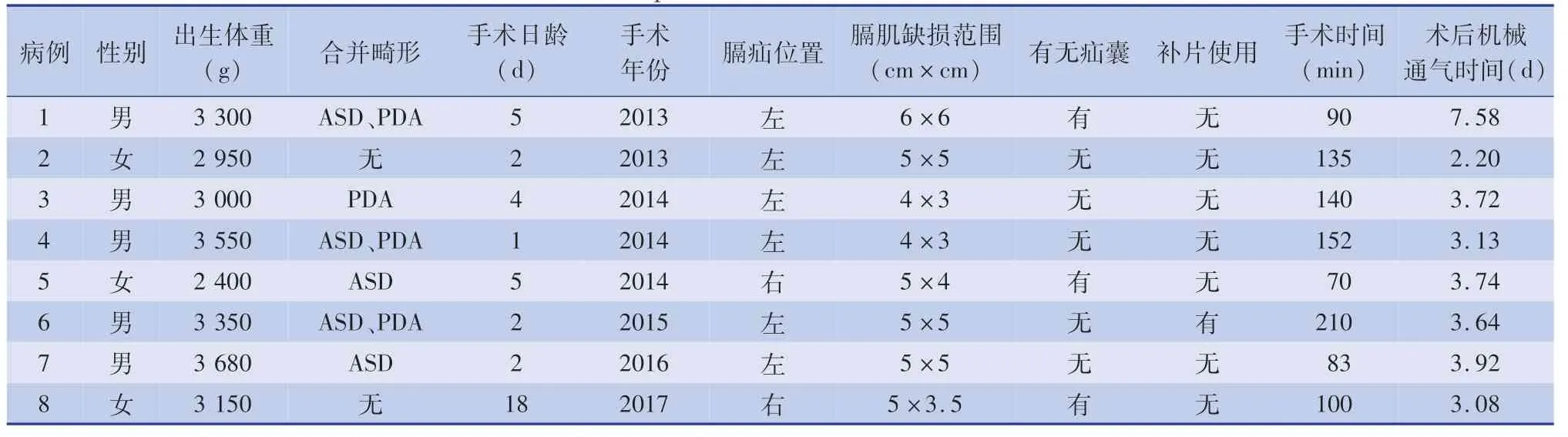
表2 复发患者初次手术资料Table 2 Initial operative data of children with recurrence
复发最早出现在术后2 d,最迟发生在术后446 d。 关于再次手术方式,病例1、病例2、病例7均经腹再次手术;病例4、病例8 再次经胸腔镜手术;病例5、病例6 再次经胸手术。 病例2 复发两次,在第三次手术时加用补片修补;其余手术病例均复发1 次,再次手术时均未使用补片。 除病例3 家长拒绝再次手术最终死亡外,其余均恢复良好。 8 例复发患者复发时间及再次手术治疗情况详见表3。

表3 复发患者再次手术资料Table 3 Reoperation data of children with recurrence
讨 论
治疗CDH 的手术包括开放手术和微创手术,其中开放手术包括经腹手术和经胸手术,微创手术包括腹腔镜手术和胸腔镜手术。 Silen 等[7]于1995 年报道首例应用胸腔镜治疗青少年CDH。 Liem[8]于2003 年报道第一例新生儿胸腔镜治疗CDH 获成功,此后新生儿胸腔镜CDH 手术逐渐开展。 胸腔镜手术的优点包括恢复快、住院时间短、胸部和脊柱畸形发生率更低、住院费用低及切口瘢痕小而美观[9]。 《先天性膈疝修补术专家共识及腔镜手术操作指南》也指出胸腔镜治疗新生儿CDH 在还纳疝内容物、操作空间以及缝合难度方面都较腹腔镜具有一定优势[10]。 然而,随着胸腔镜在新生儿CDH治疗中应用增多,一些研究指出新生儿胸腔镜治疗CDH 术后复发率高于开放手术[3,11,12]。 文献报道CDH 术后复发的危险因素包括右侧膈疝、肝疝入、膈肌缺损较大、需ECMO 治疗及补片使用等[13-16]。鉴于新生儿CDH 胸腔镜修补术后高复发率以及复发影响因素的不确定性,本研究将新生儿胸腔镜CDH 修补术后复发的病例和修补成功的病例进行比较,以发现影响CDH 术后复发的危险因素。
本研究显示,患者出生体重、性别与复发无关,这与多数文献报道一致[3,4,6]。 由于本组病例平均体重为3 154 g,总体上体重均较重,因为重症低体重患者(如<2 000 g)被排除在胸腔镜治疗外,故样本入组存在偏倚,得出的结论也可能产生偏倚。 考虑到诊断时机及就诊早晚的影响,本研究对两组产前诊断情况和入院年龄分别进行对比,结果显示无差别,这与Al-lede 等[3]的研究结果相似。 本研究显示是否伴发ASD、VSD 或PDA 这些心脏结构畸形对术后复发无明显影响,这与一些研究结论一致[3,4,15]。 CDH 伴发的肺发育不全和PHT 是主要的病理生理机制,也是患者能否存活的主要因素。 有研究表明术前需NO 治疗的严重新生儿持续性PHT(persistent pulmonary hypertension of the neonate,PPHTN)术后复发率高[3];但也有研究显示术前PPHTN 对术后复发无明显影响[4]。 本研究发现伴有PHT 患者膈疝复发率与不伴PHT 患者膈疝复发率无差异。 另外,我们在临床中发现,多数患者心脏彩超提示PDA 未闭直径较小,即使在合并ASD、VSD 或PHT 基础上也未产生明显影响,但较粗大的PDA 对患者心肺功能影响较大,尤其在合并PHT 的基础上。 本研究表明术前有PHT 合并粗大PDA 患者术后膈疝复发率更高。 当PTH 达到一定程度时,粗大PDA 可出现双向分流及右向左分流,易引起低氧血症和酸中毒,进一步影响心脏和已发育不良肺的功能、呼吸功能和血流动力学,从而影响患者术后恢复。 此外,术前需要呼吸机支持多反映患者入院时病情较严重,本研究中复发组与未复发组术前呼吸机支持率无差异。
本研究结果中,新生儿CDH 手术时年龄对复发无明显影响,这与Gander 等[11]结论一致。 曾有文献提出右侧CDH 是复发的危险因素[13],本研究显示右侧CDH 复发率虽高于左侧,但差异无统计学意义(P=0.62)。 其它研究也未发现CDH 侧别与术后复发有关[3,4,6,11,15]。 CDH 的疝入物以肠管最为多见,少数伴有肝、脾或胃疝入。 有研究指出,肝疝入、脾疝入与CDH 术后复发存在一定相关性[4,14]。然而在本研究中,肝疝入、脾疝入及胃疝入在复发组与未复发组中均无区别。 其它研究也未发现肝疝入及胃疝入与复发有关[3,4,6,11]。 关于疝囊对术后复发的影响,Kamran 等[6]报道有疝囊患者比无疝囊患者术后复发率更低(5%vs.26%,P=0.05),并认为疝囊是一个降低复发率的因素,术中可以不切除,胸腔镜下可以很容易地将疝囊推入腹腔,其最终紧贴于闭合膈肌的下侧,疝囊可以作为天然的衬垫起到支撑膈肌的作用,从而降低复发率。 但本研究发现,是否保留疝囊与术后膈疝复发无关。
关于膈肌缺损程度,国际先天性膈疝研究组[17](Congenital Diaphragmatic Hernia Study Group,CDHSG)将膈肌缺损大小分为A、B、C、D 四个级别,即A级缺损最小,D 级缺损最大。 Putnam 等[15]研究显示膈肌缺损大小与术后复发率密切相关,通过多变量Logistic 回归分析,C 级和D 级膈肌缺损可作为CDH术后复发率的重要预测因素。 本研究中采用的膈肌缺损测量方法,可进一步将膈肌缺损范围量化到具体数值,相对更精确地评估膈肌缺损程度。 本研究显示,大型膈肌缺损的CDH 患者术后复发率高于小、中型膈肌缺损者,虽然膈肌缺损程度评估方法不同,这同样提示有较大的膈肌缺损的新生儿CDH通过胸腔镜手术将面临更高的复发风险。 既往研究中对于补片和膈疝复发关系方面的研究结论不一致。 Al-lede 等[3]提出初次手术时使用补片组比未使用补片组术后复发率更高。 感染、缝合张力过高是补片修补患者术后复发率较高的原因[18]。 但Tsai 等[19]通过对比研究显示,术中使补片呈无张力的穹窿形,补片组和无补片组术后复发率无差别,认为高复发率可能是技术原因而不是补片本身的问题。 我们在胸腔镜下需使用补片时绝大多数病例都是中转开放手术来缝合补片,故胸腔镜下缝合补片的例数较少,本研究数据显示胸腔镜下缝合补片与术后复发无明显关系(P=0.18)。
本研究中,新生儿胸腔镜CDH 术后总复发率为17.8%,受手术学习曲线的影响,在开展胸腔镜手术的前三年复发率较高(31.6%),随着手术技术的进步和手术经验的积累,尽管差异尚未达到统计学意义,后四年的术后复发率(7.7%)已明显下降。 黄金狮等[21]分析CDH 复发可能与以下因素有关:经胸腔镜手术修补时,近胸壁部膈肌边缘缝合困难,缝合可能欠牢固;缝线直径及张力不够;有时为避免误伤腹腔脏器缝合膈肌组织不够厚实。 针对复发问题,一些降低复发率的改进措施也被提出,如近肋缘处膈肌缺损可采用皮下进针将膈肌与肋骨缝合固定[9];Kamran 等[6]报道胸腔镜下采用夹层式支撑物修补可降低CDH 术后复发率。
Al-lede 等[3]报告与未复发组相比,复发组手术持续时间更长。 本研究中,在刚开展胸腔镜CDH 手术早期,2013—2015 年复发组手术时间长于非复发组;而在技术相对成熟后,2016—2019 年复发组手术时间较前有缩短,且与非复发组相比无差别(P>0.05)。 分析原因,影响手术时间主要有两个因素,分别是手术难度和术者技术水平,在手术学习曲线早期技术不熟练时,较长的手术时间对术后复发有影响;在手术难度不变的前提下,术者技术水平提高后手术时间相应缩短,对术后复发率无明显影响。 在CO2气胸压力下,手术时间及麻醉时间延长,术中心肺压力增加,易导致高碳酸血症和呼吸性酸中毒,会增加术中和术后并发症的风险。
Kamran 等[6]研究指出,新生儿期胸腔镜CDH术后复发率高于婴幼儿期CDH(P=0.03)。 国内文献也报道了类似的结果,婴幼儿、儿童期的胸腔镜CDH 术后复发率(3.8%)低于新生儿期腔镜CDH术后复发率(10.3%)[22,23]。 新生儿CDH 与迟发出现症状的婴幼儿、儿童期CDH 在许多方面有所不同。 迟发性CDH 病例,肺发育不良及PTH 程度轻,多数缺损相对较小;而新生儿CDH 由于体型小、术中操作相对困难,呼吸和血流动力学也常不稳定等因素,都可能影响术后复发率。
新生儿CDH 术后复发率高与病例的选择也有一定关系。 为排除膈肌缺损大小和疾病严重程度的影响,Criss 等[5]排除了胎龄小于36 周、出生体重低于1 500 g 及接受ECMO 治疗的病例,入选了51例轻-中度膈肌缺损的低风险新生儿CDH 进行统计分析,结果发现胸腔镜组与开放组的术后复发率差异无统计学意义(P=0.28)。 这说明对于低风险新生儿CDH 病例,选择胸腔镜手术还是开放手术对复发影响不大,提示行胸腔镜CDH 修补术时需考虑病例选择的影响。 胸腔镜不是每个新生儿CDH 的常规治疗方法,选择适合的病例至关重要。 然而,目前对新生儿胸腔镜手术的指征仍缺乏统一的标准。 Cha 等[24]认为应在膈肌缺损小、血流动力学稳定且没有伴发畸形的新生儿CDH 中进行胸腔镜手术,以获得良好的疗效。 何秋明等[25]建议新生儿胸腔镜CDH 手术适应证为体重>2 000 g、无肝疝入、无肠梗阻、无肺动脉高压或严重心脏畸形、无需HFOV 或ECMO 的使用。 总之,新生儿胸腔镜CDH修补术的病例选择标准取决于每个机构的经验,还没有完全达成一致共识。
本研究中8 例复发病例,87.5%(7/8)的病例复发出现在术后1 年内。 8 例中,除1 例家长拒绝再次手术最终死亡外,接受治疗的7 例复发患者远期恢复良好。 该预后情况表明术后复发患者经过积极再次手术治疗,仍可获得较好疗效。 关于复发病例再次手术方式,我们早期主要选择经腹手术,近年来以经胸或经胸腔镜手术为主,对于右侧膈疝复发病例,考虑到肝脏原因,也选择经胸或胸腔镜再次手术。
本研究表明,胸腔镜CDH 修补术对于选择合适的新生儿病例是安全可行的。 术前有PTH 合并粗大PDA、缺损范围≥5 cm ×4 cm 的大型膈肌缺损、胸腔镜手术学习曲线早期手术时间更长的新生儿CDH 胸腔镜手术后复发率更高;手术适应证的选择对复发率也有一定影响。 CDH 复发患者经过再次修补手术后,仍有治愈机会。 CDH 最重要的治疗结局是持久的修复,因此新生儿胸腔镜CDH 术后的复发率是一个值得长期关注的重要问题。 合理应用胸腔镜技术,有选择地对新生儿CDH 病例实施胸腔镜修补术,提高手术技巧,将有助于降低术后复发率,增加手术成功率,使更多的患者受益。
总之,未来对于新生儿CDH 的研究方向,一方面可通过多中心前瞻性临床试验,探索预测胸腔镜CDH 术后复发的重要因素,从而制定出统一的新生儿CDH 胸腔镜术前病例的选择标准;另一方面,可尝试改进手术技术,以突破易引起复发的技术方面的限制,提高手术成功率。 此外,对于膈肌缺损巨大者修补材料的选择与新型材料的开发,也是今后研究的方向。
