红曲米酒糟对山羊生长性能与脂质代谢的影响
2021-03-03简仕燕吴文海郭子義马政发吴文旋陈鑫珠吴佳海
简仕燕 吴文海 王 菲 郭子義 马政发 陈 祥 吴文旋,2* 陈鑫珠 刘 景 吴佳海 牟 琼 赵 鹏
(1.贵州大学动物科学学院,新农村发展研究院,高原山地动物遗传育种与繁殖教育部重点实验室,动物营养与饲料科学研究所,贵阳 550025;2.贵州省山地畜禽养殖污染控制与资源化技术工程实验室,贵阳 550025;3.福建省农业科学院畜牧兽医研究所,福州 350013;4.贵州省草业研究所,贵阳 550006;5.遵义市动物疫病预防控制监测站,遵义 563000)
红曲米(亦称红曲、赤曲)是以曲霉科真菌紫色红曲霉(MonascuspurpureusWent.)的菌丝体及孢子经人工培养使菌丝在粳米内部生长,经发酵而成的红色米曲,具有一千多年的药食两用历史。红曲米中含有的多种活性物质,包括酶类、红曲色素、莫纳可林(monacolin)类化合物、氨基酸、脂肪酸及麦角甾醇类[1],使红曲米具有降血压[2-3]、降血脂[4-5]、降血糖[6]、抗氧化[7]、抗炎症[8-9]以及抗肿瘤[10-11]等药理作用,在生物医药领域逐渐受到重视。红曲米酒糟是红曲米酒酿造完成后的副产物,以福建等东南沿海省份为主产区,具有产量巨大、来源稳定、营养丰富等特点,但目前鲜见其在动物饲粮中应用的相关报道。因此,本试验拟在饲粮中添加不同水平的红曲米酒糟,研究其对山羊生长性能及血液脂质代谢指标的影响,为其在山羊饲粮中的应用提供数据积累。
1 材料与方法
1.1 试验材料
试验用红曲米酒糟常规养分含量见表1,经粉碎后备用。

表1 红曲米酒糟常规养分含量
1.2 试验设计与饲养管理
选取28只4月龄、体况良好、体重一致的山羊,按照随机区组设计,将其分为4个组:对照组、试验Ⅰ组、试验Ⅱ组、试验Ⅲ组,每组7个重复,每个重复1只羊。对照组饲喂不含红曲米酒糟的基础饲粮,试验Ⅰ组、试验Ⅱ组、试验Ⅲ组分别饲喂含10%、20%和30%红曲米酒糟的试验饲粮。各组山羊饲粮精粗比均为50∶50,其组成及营养水平见表2。
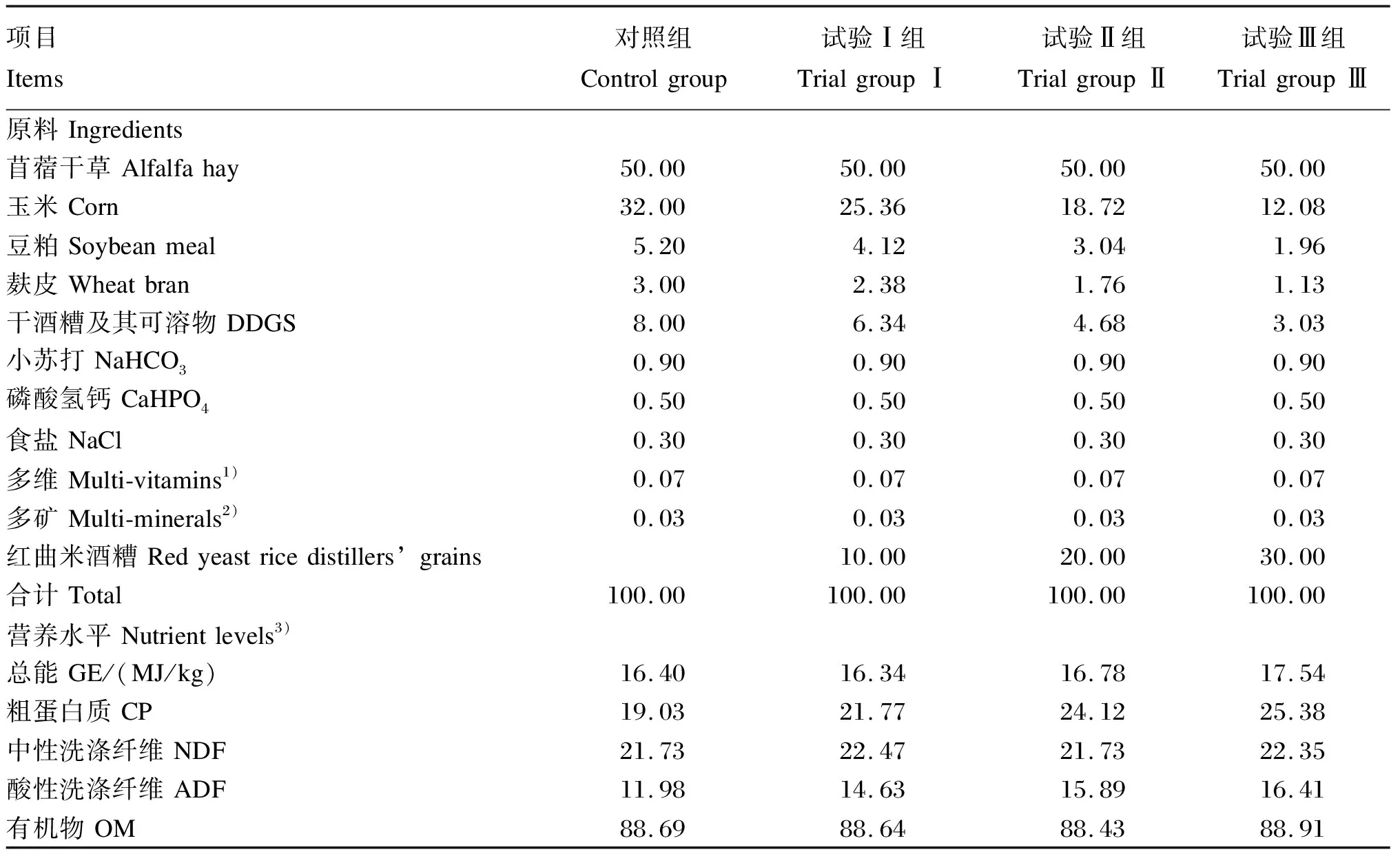
表2 各组山羊饲粮组成及营养水平(干物质基础)
试验持续38 d,其中预试期10 d,正试期28 d。在预试期内,观察试验羊的健康状况、对饲粮的适应性以及确定采食量,正试期内严格按照已确定的采食量供饲。试验羊单笼独立饲养,每天09:00、18:00各饲喂1次,自由饮水,保证笼舍光照、干燥通风。
1.3 指标检测
1.3.1 饲粮营养成分
从正试期开始每天采集饲粮样品100 g,置于-20 ℃冰箱中冷冻保存。每个阶段试验结束后,将饲粮样品置于65 ℃烘箱中烘干,粉碎制成分析试样,参照《饲料分析及饲料质量检测技术》[12]测定概略养分含量。其中,干物质(DM)含量采用烘干法测定,粗蛋白质(CP)含量采用凯氏定氮法测定,有机物(OM)含量采用灼烧法测定,中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)含量采用纤维素分析法测定,总能(GE)采用氧弹式量热仪(6400 CALORIMETER,Parr)测定。
1.3.2 生长性能
每天饲喂前将饲槽打扫干净,准确记录每天饲粮的饲喂量和剩余量,在正试期开始和结束时称量试验羊空腹重,分别记为始重和末重,计算干物质采食量(DMI)、平均净增重(ANG)、平均日增重(ADG)、料重比(F/G)。
DMI(g/d)=饲喂量-剩余量;ANG(kg)=末重-始重;ADG(g/d)=ANG/试验天数(28 d);F/G=DMI/ADG。
1.3.3 血液脂质代谢指标
山羊称重后,使用一次性肝素钠抗凝血真空采血管于颈静脉采血10 mL,常温静置10 min后以3 000 r/min离心15 min,分离得到血浆,分装于1.5 mL离心管中,置于-20 ℃冰箱中保存待测。采用全自动生化分析仪(BS-240VET,Mindray)完成对血浆甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)及高密度脂蛋白胆固醇(HDL-C)含量的测定,所用试剂盒购于深圳迈瑞科技有限公司。
1.4 数据处理与分析
试验数据先采用Excel 2010软件进行初步处理,再用SAS 9.2软件进行单因素方差分析。采用Duncan氏法进行平均值的多重比较,各组间差异显著性水平定为P<0.05。试验数据均以平均值±标准差(mean±SD)表示。
2 结果与分析
2.1 红曲米酒糟对山羊生长性能的影响
由表3可知,各组山羊的DMI、末重、ANG、ADG与F/G没有显著差异(P>0.05),但总体来看,3个试验组均优于对照组,且以试验Ⅰ组效果最佳。
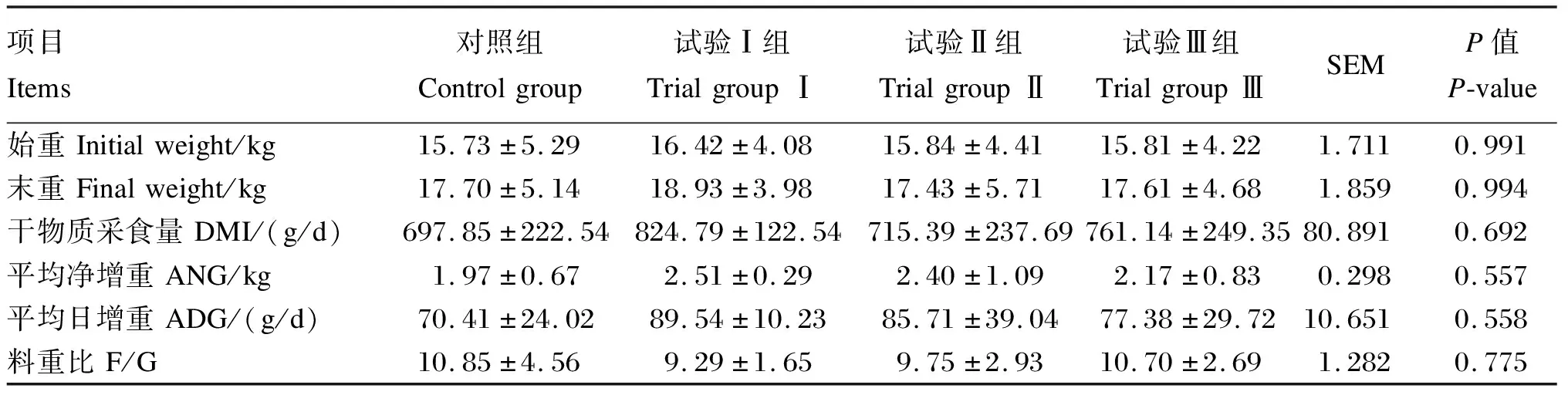
表3 红曲米酒糟对山羊生长性能的影响
2.2 血浆脂质代谢指标
由表4可知,试验Ⅲ组血浆TG含量较对照组高45.00%,差异显著(P<0.05)。试验Ⅱ组、试验Ⅲ组血浆TC含量较对照组分别高35.20%、35.71%,差异显著(P<0.05)。试验Ⅰ组、试验Ⅱ组、试验Ⅲ组血浆LDL-C、HDL-C含量均高于对照组,但差异不显著(P>0.05)。
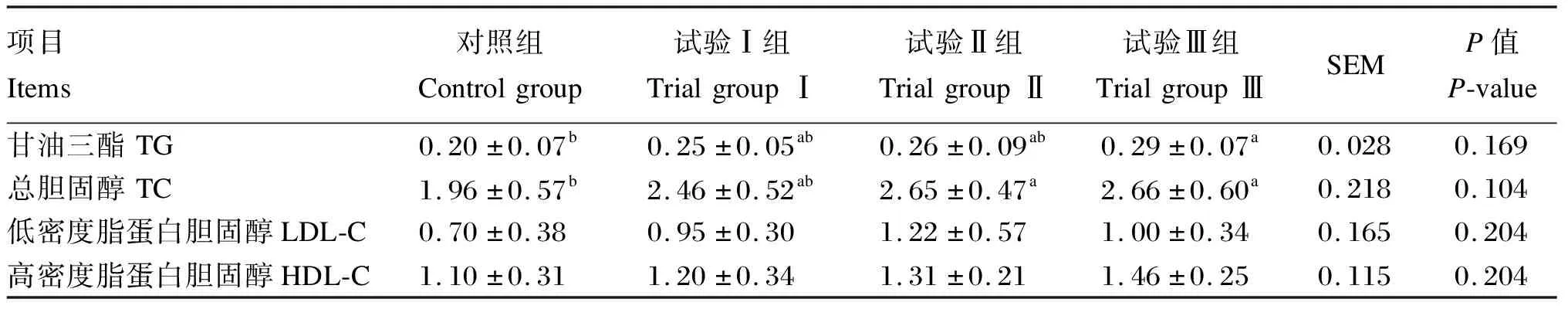
表4 红曲米酒糟对山羊血浆脂质代谢指标的影响
3 讨 论
3.1 红曲米酒糟对山羊生长性能的影响
采食量是影响动物生长性能极为重要的因素,而饲粮的适口性是影响采食量的重要因素之一。本试验中,红曲米酒糟对山羊的DMI没有产生显著影响,说明山羊可适应红曲米酒糟的适口性。但结果也显示,在3个试验组内,随着红曲米酒糟水平的增加,DMI逐渐下降,说明过高的红曲米酒糟会降低适口性。这可能与红曲米酒糟内的酒精含量逐渐增加有关。从所查阅文献来看,有关红曲或酒糟对动物生长性能影响的研究结果不尽相同。傅剑云等[13]研究了红曲对实验性高脂血症大鼠体重的影响,结果发现,红曲能降低大鼠的体重。贺鸣等[14]、陶忠海等[15]分别以发酵高粱酒糟、发酵酒糟饲喂肉牛,结果均显示试验组肉牛的DMI和ADG显著高于对照组,王斌星等[16]在舍饲育肥藏绵羊上应用发酵酒糟也得出相似结论。Schroer等[17]研究结果显示育成牛饲粮中添加20%的酒糟对日均DMI和生长性能无显著影响,布登付等[18]也有类似结论。高川等[19]、杨志勇等[20]分别得出6%、10%的白酒糟酵母培养物对育肥猪的生长性能未产生显著影响,魏来[21]及张慧等[22]也得出类似结论。造成上述结果差异的原因可能与所用试验动物、酿造原料及处理方式有关。
3.2 红曲米酒糟对山羊脂质代谢的影响
血液生化指标能够反映动物机体的健康和生理状况。胡毅等[23]指出,血液中的TG及TC是脂类在血液中存在和运输的形式及衡量机体脂质代谢强弱的指标。血液TG含量的高低反映脂肪沉积能力的强弱,TG含量下降,表明脂肪分解增强或转化为体脂的能力加强,同时适量的TG有助于维持内环境的稳态[24];血液TC含量可评价机体对脂类营养吸收代谢状况。LDL-C与HDL-C是血液中胆固醇存在的2种形式。血液中LDL-C含量升高,会增加动脉粥样硬化发生的几率,但其可将肝脏合成的TC转运到肝外组织中;HDL-C含量减少是冠心病发生的危险因素之一,同时HDL-C可把过剩的TC运回肝脏代谢转化为其他物质,并能够减少TG的沉积[25];故LDL-C和HDL-C可维持动物体内脂类代谢的稳定,是反映机体脂质代谢情况的指标。
目前认为红曲的降血脂作用机制是其是3-羟基-3-甲基戊二酸单酰辅酶A还原酶(HMG-CoA)的抑制剂,而HMG-CoA是胆固醇合成过程中的关键酶[26]。丁素菊等[27]报道,红曲可上调患者的血卵磷脂胆固醇脂酰转移酶,揭示了红曲降脂作用的另一种可能机理。傅剑云等[13]研究表明,1.00 g/kg BW红曲组高脂血症大鼠血清TC、TG含量显著降低,0.17、0.33 g/kg BW红曲组血清HDL-C含量显著升高,而陆继红等[28]指出,红曲可使人的血清TC、TG和LDL-C含量分别降低16.6%、25.2%和24.0%,HDL-C含量升高14.3%;Lee等[29]、Wang等[30]的研究同样发现红曲能显著降低大鼠血清TC和TG含量,且可降低血清LDL-C含量;韩梅等[31]、周大伟[32]以及Liu等[33]也有类似报道,他们分别指出红曲可降低大鼠血清TC含量、红曲色素可使小鼠血清TC与LDL-C含量下降以及红曲培养物可使大鼠血清TC含量降低,而杨康等[34]发现,在颗粒型全混合日粮中添加白酒糟对山羊血浆TC、TG含量的影响不显著。
本试验结果显示,红曲米酒糟对山羊血浆TC与TG含量均有上调作用,但作用效果不显著,提示红曲米酒糟不影响山羊体内脂类的转运反应以及对营养物质的吸收效果。此外,3个试验组血浆LDL-C、HDL-C含量在数值上均高于对照组,表明红曲米酒糟可增强山羊血液中LDL-C将TC由肝内转运到肝外组织的作用,降低肝脏胆固醇的合成速度,同时可提高血液中HDL-C的合成速率,加快组织间的胆固醇转化效率。这进一步证实了红曲米酒糟具有降低血脂的功能。
4 结 论
在本试验条件下,饲粮中添加一定量(10%~30%)的红曲米酒糟对山羊的生长性能没有负面影响,并能有效改善脂质代谢状况,综合来看,以红曲米酒糟添加量为10%时饲喂效果最佳。
