采用焦亚硫酸盐/过二硫酸盐体系去除水中卡马西平的研究
2021-03-03
(四川大学建筑与环境学院,四川成都,610065)
1 前言
药品和个人护理用品(PPCPs)全称是Pharmaceutical and Personal Care Products,这一类物质主要用于包括人类健康或化妆护理的各种处方药和非处方药,如抗生素、消炎药、香料和洗发水等,是一类新兴环境污染物[1]。近年来,由于PPCPs的大量使用,这些物质大多逃过了现有的水质标准控制,且目前的水处理技术对其中相当一部分物质没有明显的去除效果[2]。其中,卡马西平(CBZ,5H-二苯并[b,f]氮杂卓-5-甲酰胺)作为一种典型的抗癫痫药物,是比较有代表性的一种PPCPs,由于CBZ的广泛使用,导致其大量排放到环境中,在废水中已被广泛检测到,包括工厂废水、地下水甚至饮用水中(分别为6.3 μg/L、0.61 μg/L和0.03 μg/L)[3]。因此,解决水体中CBZ污染问题刻不容缓。
在过去的研究中,对于CBZ的去除方法主要包括物理处理,如膜过滤、活性炭吸附;生物处理,如活性污泥法等,但是都存在成本高、处理条件受限等问题[4,5]。在过去的十年里,高级氧化技术(AOPs)发展迅速,特别是基于过二硫酸盐(PDS)的高级氧化技术被广泛应用于污水处理中,但由于PDS自分解缓慢,氧化能力有限,传统的活化方式如热活化、紫外活化、过渡金属活化等通过产生强氧化性活性氧(ROS)来提高氧化性能已被广泛研究,且它们存在成本高,能量消耗高、二次污染风险大等问题,因此寻找更加高效、绿色的PDS活化方法成为目前的研究热点[6, 7]。为了克服这些挑战,天然还原剂,包括有机化合物和无机化合物已被用作加速ROS形成的PDS活化剂[8]。焦亚硫酸盐(S2O52-)作为一种化学工业中天然的无机还原剂,常用作食品的漂白剂、保存剂和抗氧化剂,但近年来它在食品行业中过度使用,废水中过量的焦亚硫酸盐对生物产生了明显的毒害、抑制作用。因此将这些行业过剩的焦亚硫酸盐回收利用作为PDS的活化剂具有广阔的研究前景,能有效减轻环境压力,还能对于PDS的活化方式提出新的思路。
在本项研究中,构建了焦亚硫酸盐/过二硫酸盐体系用于去除水中的卡马西平。首先,通过单一因素控制实验优化K2S2O5/PDS体系中的关键参数(PDS浓度、K2S2O5浓度、初始pH值);下一步,通过设置对照试验研究协同效应和反应体系的优势;接着通过淬灭实验研究体系的自由基的产生及鉴别主要优势活性物种;最后探究了体系在不同阴离子背景下的受影响程度,分析了其实际应用潜力。
2 实验试剂、仪器和方法
2.1 实验试剂
卡马西平(CBZ,≥98.0%)、过二硫酸盐Na2S2O8(PDS,分析纯)、焦亚硫酸盐K2S2O5(分析纯)、糠醇(FFA,分析纯)均购自于上海阿拉丁试剂有限公司;甲醇(MeOH,分析纯)、无水乙醇(C2H6O,分析纯)、氯化钾(KCl,分析纯)、硝酸钾(KNO3,分析纯)、碳酸氢钠(NaHCO3,分析纯)、磷酸二氢钾(KH2PO4,分析纯)均购自于成都科隆化学品有限公司;叔丁醇(TBA,分析纯)购自于上海麦克林生化科技有限公司,整个实验过程均使用去离子水。
2.2 实验仪器
CBZ浓度由Agilent 1260型HPLC进行检测。CBZ的检测条件如下:以美国安捷伦公司的Eclipse XDB C-18(5 μm, 4.6 × 250 mm)为色谱柱,检测波长为 286 nm,进样体积为20 μL,流动相为比例为60%的乙腈与40%的超纯水,流速为0.8 mL/min,柱温为30 ℃;pH计型号为PHS-3C,上海仪电科学仪器公司。
2.3 实验方法
对于CBZ的降解实验全部在装有100 mL溶液的250 ml的烧杯中进行,CBZ浓度为2 mg/L,整个实验过程中温度控制为25 ℃,磁力搅拌器的速度为300 rpm,溶液初始pH值使用0.1 mM的H2SO4溶液和0.1 mM的NaOH溶液调节,然后向烧杯中投加所需的PDS和K2S2O5剂量,根据预先设定好的取样时间点进行取样(1 mL),并迅速加入40 μL的无水乙醇溶液终止反应,最后用HPLC分析样品中CBZ的浓度。实验首先通过单因素控制实验确定了PDS浓度、K2S2O5浓度、初始pH值,然后K2S2O5/PDS体系的协同作用通过对照实验确定,同时监测实验过程中pH值的变化。此外,本研究结合淬灭实验探究了体系可能产生的活性自由基以及不同阴离子背景下体系受影响的程度。
3 结果与讨论
3.1 参数优化
3.1.1 K2S2O5的浓度的优化
不同梯度浓度的K2S2O5对于K2S2O5/PDS体系降解CBZ的结果如图1(a)所示。当K2S2O5的浓度为3 mM时,在120 min反应时间后CBZ的去除率超过了90%,当继续增加K2S2O5的浓度时,CBZ的降解率有所下降,出现这样的结果是因为S2O52-水解为HSO3-(公式(1)),HSO3-和S2O82-产生的SO3·-(公式(2))可以在氧的参与下转变为SO4·-(公式(3)—(4)),而过量的HSO3-会消耗体系中产生的SO4·-(公式(5))[8],使其攻击污染物的SO4·-浓度降低,CBZ的降解效率降低,因此,在接下来的实验中选择K2S2O5的浓度为3 mM。
S2O52-+H2O→2HSO3-
(1)
2S2O82-+2HSO3-+2H2O→6SO3·-+3O2·-+6H+
(2)
SO3·-+O2·-→SO52-
(3)
SO52-+H+→SO4·-+HO·
(4)
SO4·-+HSO3-→SO3·-+H++SO42-
(5)
3.1.2 PDS的浓度的优化
不同梯度浓度的PDS对于K2S2O5/PDS体系降解CBZ的结果如图1(b)所示。当PDS的浓度依次由2 mM增加至5mM时,在120 min反应时间后CBZ的去除率由50%增加至90%,当继续增加PDS的浓度时,CBZ的去除率增加并不明显,这是因为溶液中PDS过量时,PDS会消耗SO4·-(公式(6)—(7)),使其攻击污染物的SO4·-浓度降低[9],CBZ的降解效率降低,因此,在接下来的实验中选择PDS的浓度为5 mM。
S2O82-+ SO4·-→ SO42-+ S2O8·-
(6)
SO4·-+ SO4·-→ S2O82-
(7)
3.1.3 初始pH值的优化
不同初始pH值对于K2S2O5/PDS体系降解CBZ的结果如图1(c)所示。当体系初始pH值2.0时,在120 min反应时间后CBZ的去除率仅为49%,当初始pH值增加至3.5时,CBZ的去除率超过了90%,当继续增加体系初始pH值时,CBZ的去除率有所下降,这是因为SO4·-在酸性和中性条件下才能发挥其较好的氧化作用,而在过碱的条件下,SO4·-能被OH-消耗,生成的HO·在碱性条件下强度较小(公式(8))[10],同时在过酸的条件下,过量的H+清除SO4·-和HO·(公式(9)—(10))[11],因此,在后续的实验中选择初始pH值为3.5。
SO4·-+ OH-→ SO42-+ HO·
(8)
SO4·-+ H++ e-→ HSO4-
(9)
HO·+ H++ e-→ H2O
(10)
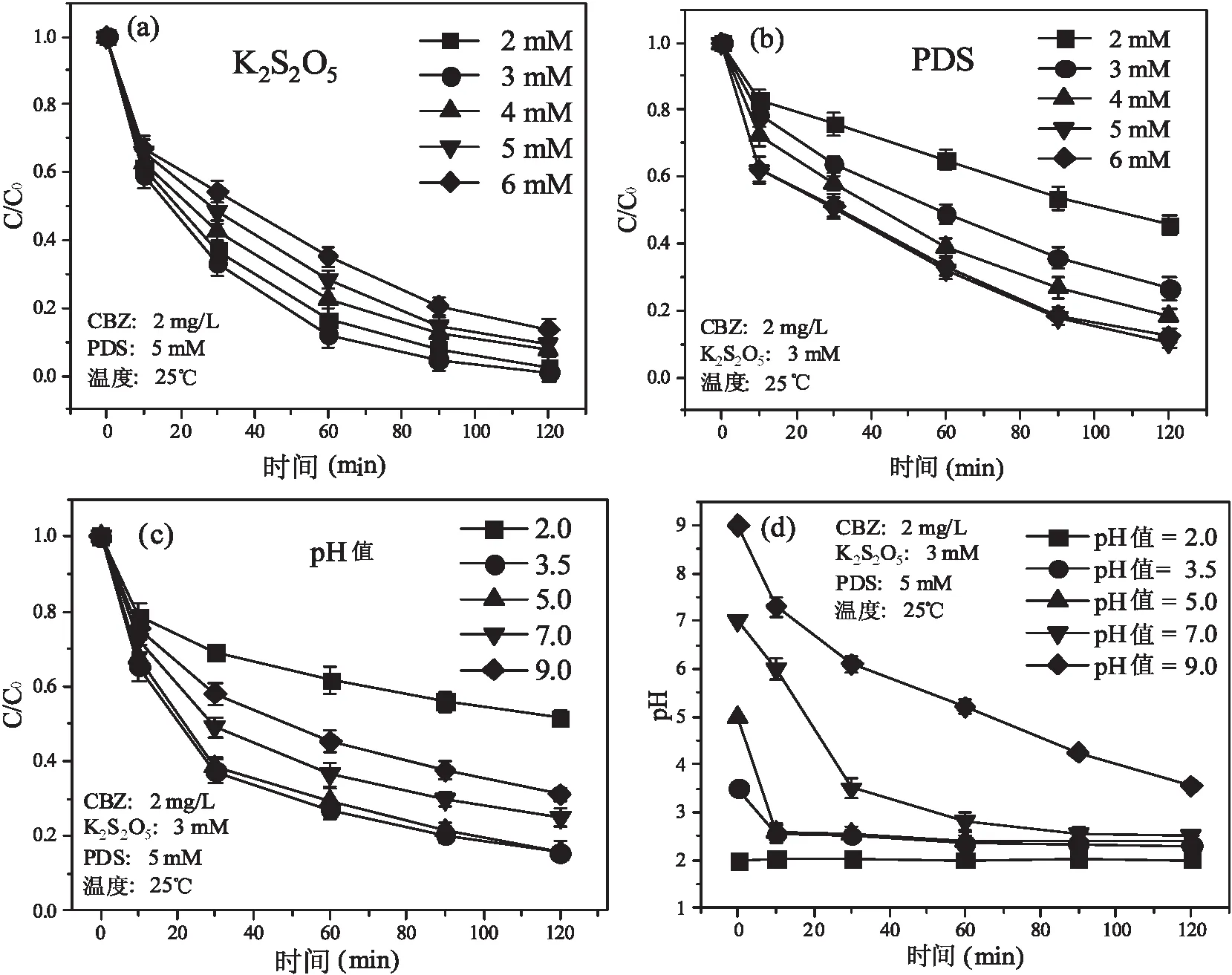
图1 (a)K2S2O5浓度的优化;(b)PDS浓度的优化;(c)初始pH值的优化;(d)不同初始pH值随时间的变化
3.2 对照实验
为了探究K2S2O5/PDS体系之间的协同作用,设置了对照实验组包括单独的K2S2O5、单独的PDS和K2S2O5/PDS用于CBZ去除,都在相同的实验条件下完成(CBZ浓度为2 mg/L、K2S2O5浓度为3 mM、PDS浓度为5 mM、初始pH值为3.5、温度为25 ℃、反应时间120 min)。结果如图2(a)所示,单独的K2S2O5实验组对于CBZ的降解仅不到20%,且由图2(b)所示降解速率kobs为0.014 min-1,单独的PDS实验组对于CBZ的降解也仅不到30%,降解速率kobs为0.021 min-1,而K2S2O5/PDS体系实验组对于CBZ的降解能达到95%,降解速率kobs达到了0.064 min-1,由图2(b)所示,K2S2O5/PDS实验组体系的降解速率远大于单独的K2S2O5实验组和单独的PDS实验组速率,因此表明K2S2O5和PDS的耦合对于CBZ的降解产生了显著的协同作用。
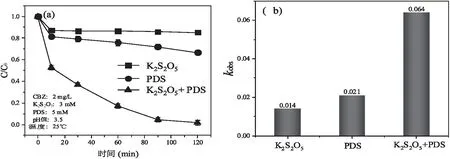
图2 (a)实验组和对照组随时间CBZ的降解;(b)实验组和对照组的降解速率kobs
3.3 淬灭实验及阴离子影响实验
已有研究表明,羟基自由基(HO·)和硫酸根自由基(SO4·-)是PDS-AOPs中主要的ROS,而TBA可以用来淬灭HO·,MeOH可以同时淬灭SO4·-和HO·,而FFA可以用来淬灭1O2[12-14]。如图3(a)所示,分别往K2S2O5/PDS体系中加入200 mM的TBA,200 mM的MeOH以及5 mM的FFA进行淬灭,结果表明TBA的淬灭效果很微弱,120 min内仍有96%的CBZ被去除,说明体系里产生的HO·很少且其贡献较小。MeOH和FFA的淬灭效果明显,反应受到明显抑制,120 min内CBZ去除率仅有52%和30%,说明体系里产生了SO4·-和1O2,且这些自由基是体系中攻击污染物的主要活性物种。
此外,我们还研究了不同共存阴离子对反应体系污染物去除的影响,结果如图3(b)所示。5 mM 的Cl-和NO3-的加入对K2S2O5/PDS体系的CBZ的降解效率没有明显的影响,仅有轻微的抑制作用。而HCO3-和H2PO4-的加入对体系的影响下要更加显著,这可能是HCO3-和H2PO4-本身也是自由基的清除剂,消耗了体系内产生的SO4·-和HO·,同时它们作为缓冲盐还会对溶液pH值产生强烈的干扰,从而导致CBZ去除效率的下降[15, 16]。

图3 (a)PDS/ K2S2O5体系的淬灭实验;(b)PDS/ K2S2O5体系受Cl-、NO3-、HCO3-和H2PO4-阴离子的影响
4 结论
在这个实验中,K2S2O5/PDS体系已被证明对于水中卡马西平的去除非常有效。首先,在最佳工艺条件下(CBZ浓度为2 mg/L、K2S2O5浓度为3 mM、PDS浓度为5 mM、初始pH值为3.5、温度为25 ℃),处理120 min后CBZ去除率超过了90%,相比对照试验组(单独K2S2O5实验组、单独PDS实验组),K2S2O5/PDS体系处理效率大大提高,这是由于体系中产生了更多的HO·、SO4·-和1O2,其中SO4·-是体系中攻击污染物的主要活性基团。同时,Cl-、NO3-、HCO3-和H2PO4-阴离子对K2S2O5/PDS体系有一定程度的影响,其中仅H2PO4-对反应有明显抑制,说明该体系在实际水体的应用有一定潜力。
