Cu2(NO3)(OH)3催化过硫酸盐降解苯酚
2021-03-03王祥名吴松海孙世玮孟子贺
王祥名,吴松海*,王 琮,李 蕊,孙世玮,孟子贺,韩 煦,2*
(1.天津大学化工学院,天津 300350; 2.天津大学环境科学与工程学院,天津 300350)
苯酚(phenol)是一种对生物有强烈毒性的有机污染物[1]。化学工业排放的废水往往包括较高含量的酚类物质[2]。废水中苯酚的自然降解速度非常缓慢,10 mg·L-1的苯酚废水在pH值为 7.0和10 ℃条件下经自然降解5 d后仅能去除75%[3]。在中国,饮用水中苯酚的最高允许浓度为0.002 mg·L-1(GJ94-1999)。到目前为止,物理方法(萃取[4]、吸附[5-6]和液膜法[7])、生化方法(酶处理技术[8])、活性污泥法[9]和化学方法(电解[10]和氧化[1])已经被用于降解工业废水中的苯酚污染物。

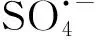
近年来,以过硫酸盐为基础的AOPs处理酚类废水吸引了越来越多的研究兴趣。Lin等[27]研究表明,在pH值为 3.0、7.0和11.0的条件下,通过UV活化过硫酸盐能有效降解0.5 mmol L-1苯酚而且没有二次污染,k值可达0.14~0.16 min-1。Lei等[28]合成了一种CuO-Fe3O4催化剂用于激活过硫酸盐降解苯酚。在这个体系中,pH值为11.0时反应2 h可使9.4 mg·L-1苯酚完全矿化而不会产生二次污染。此外,他们还发现体系中的主要活性物种是被吸附在催化剂上的硫酸根自由基以及催化剂表面的Cu(Ⅱ)在活化过硫酸盐后形成的Cu(Ⅲ)[28]。
Cu2(NO3)(OH)3(铜硝石)是一种存在于大自然中的含铜矿石,一般分为2种晶系(正交晶系和单斜晶系)[29]。先前已有研究将层状的Cu2(NO3)(OH)3用于催化过氧化氢降解偶氮染料[30]。Zhan等[30]使用Cu2(NO3)(OH)3在pH值为 3.4~9.4条件下催化过氧化氢降解直接蓝15,反应30 min后降解率可以达到80%左右。相比于H2O2和过一硫酸盐,过硫酸盐具有化学稳定性高,运输、储存方便,成本低等优点。同时,非均相催化活化过硫酸盐的反应也更加经济、环保。Cu2(NO3)(OH)3已被用于催化H2O2降解有机污染物,但对活化过硫酸盐的研究尚未见报道。因此,本研究将主要探讨过硫酸盐和Cu2(NO3)(OH)3体系降解苯酚的效率和机理。
1 实验部分
1.1 实验试剂与仪器
实验所用试剂详见表1,所有试剂均为分析纯,阿拉丁化学试剂有限公司生产。实验所用仪器详见表2。

表1 实验试剂一览表Table 1 Chemical reagents used in the experiments

表2 实验仪器一览表Table 2 Apparatus used in the experiments
1.2 Cu2(NO3)(OH)3的制备
采用溶剂热法合成催化剂Cu2(NO3)(OH)3[30]。将4.8 g三水合硝酸铜和0.8 g硝酸铵缓慢加入60 mL的无水乙醇中,搅拌30 min。然后将搅拌后的悬浮液转移到1个100 mL水热釜中,在150 ℃下反应48 h。反应后得到的产物分别用经氮气除氧后的去离子水(3次)和无水乙醇(3次)洗涤,然后将产物收集放入真空烘箱中,保持在80 ℃下烘干8 h。制备好的样品在经过研磨后储存在厌氧手套箱中。
1.3 苯酚降解实验
苯酚降解反应借助250 mL锥形瓶进行。将250 mg的Cu2(NO3)(OH)3和一定量的去离子水加入锥形瓶中,用1.0 mol·L-1NaOH或HCl溶液来调节pH值到反应需要的pH值。然后将一定体积具有相同pH值的过硫酸盐溶液和苯酚溶液先后加入到锥形瓶内,搅拌均匀。锥形瓶被放置在1个设定温度为25 ℃,避光的恒温摇床中。摇床的转速设定为150 r/min。苯酚溶液加入的时间被设定为反应的起点,定时取样,取出的样品以7 000 r/min的速度离心3 min后取上清液。检测苯酚浓度及过硫酸盐含量;同时按照相同的实验条件,Cu2(NO3)(OH)3或过硫酸盐单独存在的对照组被用来明确体系对苯酚的氧化作用。所有反应均进行平行实验。最适宜的反应条件通过测试不同pH值、过硫酸盐用量和苯酚初始浓度来确定。
1.4 Cu2(NO3)(OH)3的表征及分析方法
2 结果与讨论
2.1 催化剂的表征
采用XRD分析了所制备Cu2(NO3)(OH)3的晶体结构。从图1上可以看出Cu2(NO3)(OH)3的主峰在2θ=5°~45°之间,与Cu2(NO3)(OH)3标准卡片(JCPDS, No.45-0594)一致,这说明我们成功合成了Cu2(NO3)(OH)3晶体。晶体的峰型较为尖锐,这表明合成的产物纯度较高,结晶度较好(图1)。其中,2θ=6.4°和12.8°这2个衍射角分别对应了Cu2(NO3)(OH)3晶格内的(001)和(002)晶面。SEM分析(图2)进一步表明,合成的Cu2(NO3)(OH)3形貌主要有颗粒状和片状2种,颗状形貌的直径范围主要是5~20 μm,片状形貌的长度约为10 μm,与文献报道的基本相同[30]。从样品的FT-IR图可以看出,催化剂在3 300~3 600 cm-1处表现出了较宽的吸收峰,这是明显的羟基吸收峰(图3),其中3 544 cm-1处的吸收峰为样品结晶水中的羟基吸收峰;3 431 cm-1处的吸收峰为Cu2(NO3)(OH)3与羟基形成氢键后的特征峰(图3)[32];880、775和674 cm-1为Cu—O—H键的特征峰;1 047、814和1 418 cm-1为NO3的特征吸收峰;2 342 cm-1处为CO2的特征峰(图3)[33]。
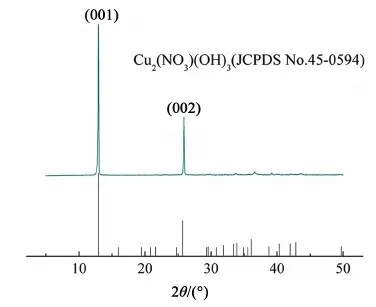
图1 Cu2(NO3)(OH)3的XRD分析图Fig.1 X-Ray powder diffraction patterns of Cu2(NO3)(OH)3

图2 Cu2(NO3)(OH)3的扫描电子显微镜分析图Fig.2 SEM analysis of the synthesized Cu2(NO3)(OH)3

图3 Cu2(NO3)(OH)3的傅里叶红外光谱图Fig.3 FT-IR spectra of Cu2(NO3)(OH)3
2.2 苯酚降解的动力学研究
为了确定Cu2(NO3)(OH)3/过硫酸盐体系降解苯酚的动力学参数,利用式(1)对实验数据进行了准一级动力学拟合。
ln(C/C0)=-kt
(1)
k代表苯酚氧化准一级动力学常数,min-1;C和C0各自代表苯酚在反应的t时刻和初始时的浓度,拟合后的准一级动力学常数见表3。并且对照试验发现,只有在Cu2(NO3)(OH)3和过硫酸盐共存时才会观察到较高的苯酚降解效率,缺少其一都不会发现苯酚的降解或者被吸附(见图4)。
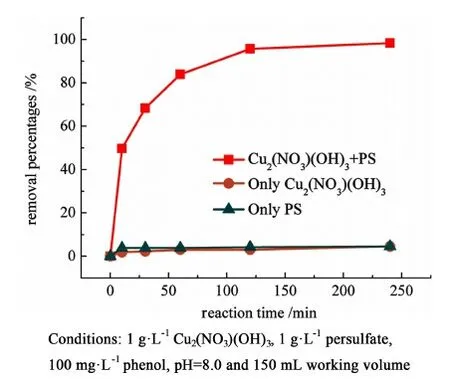
图4 苯酚降解对照试验Fig.4 Control experiment in the degradation of phenol
2.3 不同pH值对Cu2(NO3)(OH)3催化过硫酸盐降解苯酚的影响
调整苯酚溶液的初始pH值从 2.0到12.0来研究pH值对降解速率的影响。反应的准一级动力学常数,列于表3中。
从图5可以看出,在pH值为 8.0时, 苯酚降解效率最好,此时的反应速率常数为3.11×10-2min-1(表3)。然而,当pH值大于10.0或小于5.0时,反应速率均有明显的下降。

图5 不同pH值条件下苯酚降解效率及pH 值为8.0时Cu2+活化过硫酸盐降解苯酚Fig.5 The removal efficiency of phenol under different pHs and the activation of persulfate by Cu2+ at pH 8.0 on the removal efficiency of phenol

表3 过硫酸盐和Cu2(NO3)(OH)3催化的苯酚氧化反应速率常数Table 3 Reaction rate constants in the phenol oxidation by persulfate and Cu2(NO3)(OH)3
2.4 不同过硫酸盐用量对苯酚降解的影响
在pH 值为8.0条件下,调整过硫酸盐用量从0.5~4.0 g·L-1来研究其对苯酚降解过程的影响(图6,表3)。反应的准一级动力学常数列于表3中。

图6 不同PS浓度条件下苯酚降解效率Fig.6 The removal efficiency of phenol at different concentrations of persulfate
从图6可以看出,在过硫酸盐浓度达到1.0 g·L-1时,反应进行彻底。继续加大过硫酸盐用量对于反应速率的提升不大。
2.5 不同催化剂用量对Cu2(NO3)(OH)3催化过硫酸盐降解苯酚的影响
在pH值为 8.0, 过硫酸盐用量为1.0 g·L-1条件下,本研究考察了Cu2(NO3)(OH)3用量对苯酚降解速率的影响。反应的准一级动力学常数列于表3中。
从图7可以看出,当Cu2(NO3)(OH)3用量为1.0 g·L-1时,苯酚降解效率最佳。

图7 不同催化剂浓度条件下苯酚降解效率Fig.7 The removal efficiency of phenol at different dosage of Cu2(NO3)(OH)3
2.6 Cu2(NO3)(OH)3催化过硫酸盐降解苯酚的稳定性实验
非均相反应可以实现催化剂的回收利用以及减少二次污染。因此,我们通过多次使用Cu2(NO3)(OH)3进行降解苯酚的实验对其进行了重复利用测试。在经过5次循环后,Cu2(NO3)(OH)3仍然保持了约90%的苯酚降解效率(图8)。这表明催化剂有着良好的稳定性以及重复利用性能。我们也通过ICP-AES检测反应后溶液中的Cu2+析出量。结果发现,在pH值为8.0下反应4 h后,溶液中的Cu2+析出量约为3.0 mg·L-1。并且,我们向同样的过硫酸盐/苯酚体系中同样加入3.0 mg·L-1的Cu2+进行实验,反应4 h后没有发现明显的苯酚氧化(图5)。因此,可以证明Cu2(NO3)(OH)3具有良好的重复利用性以及析出的Cu2+对于过硫酸盐的激活在本研究中没有起明显的作用。

图8 Cu2(NO3)(OH)3降解苯酚的循环实验Fig.8 The repeated cycles of Cu2(NO3)(OH)3 in the degradation of phenol
2.7 Cu2(NO3)(OH)3催化过硫酸盐降解苯酚过程中的TOC变化
我们通过测定溶液中TOC的变化来确定苯酚降解过程中是否产生二次污染。反应条件为:pH值为8.0,苯酚初始浓度为100 mg·L-1,1 g·L-1的Cu2(NO3)(OH)3和过硫酸盐。反应开始前,苯酚溶液的TOC含量为79.3 mg·L-1。随后我们在10、30、60、120以及240 min时分别取样测定TOC变化。结果显示,溶液的TOC含量逐渐下降,依次为45.1、23.9、11.6、3.9和2.2 mg·L-1。同时,我们根据HPLC法测得反应过程中的苯酚浓度依据式(2)计算此时溶液TOC值。m碳表示碳元素相对分子质量,m苯酚表示苯酚相对分子质量,C苯酚表示取样时苯酚浓度(mg·L-1)。经过计算,TOC值分别为35.1、15.9、7.2、1.9和0.3 mg·L-1,该数值与仪器测得TOC值基本吻合,说明降解过程中苯酚完全转化为CO2与H2O,没有生成其它小分子造成二次污染。
(2)
2.8 Cu2(NO3)(OH)3催化过硫酸盐降解苯酚过程中的自由基淬灭实验
为了明确苯酚氧化降解过程中,不同活性物种的贡献,我们在pH值为 8.0条件下进行了淬灭剂实验(图9)。
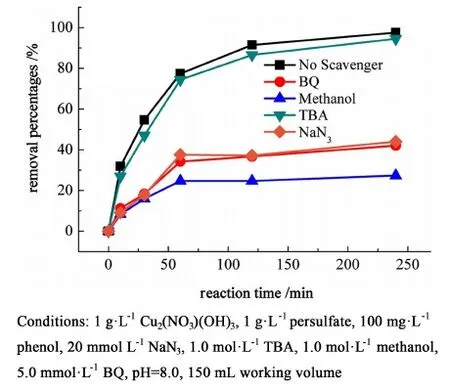
图9 不同淬灭剂存在下苯酚降解效率Fig.9 The removal efficiency of phenol in the presence of various scavengers
2.9 EPR表征
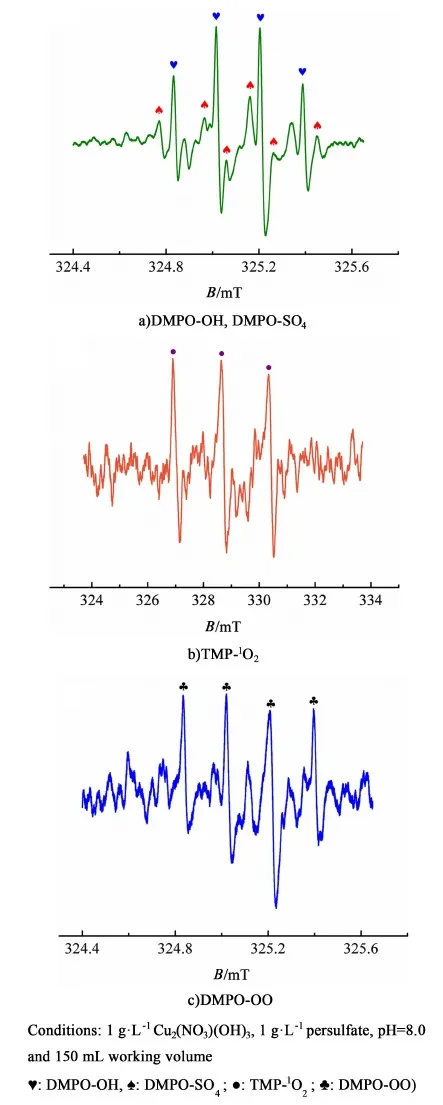
图10 Cu2(NO3)(OH)3-过硫酸盐体系的EPR谱, a)DMPO-OH, DMPO-SO4, b)TMP-1O2和 c)DMPO-OOFig.10 EPR spectra of a) DMPO-OH, DMPO-SO4, b)TMP-1O2 and c)DMPO-OO for Cu2(NO3)(OH)3-persulfate system in the presence of DMPO or TMP
2.10 机理分析
(3)
Cu3++OH-→·OH+Cu2+
(4)
(5)
(6)
(7)
(8)
(9)
3 结论

