miR-29a对MPP+诱导PC12细胞凋亡影响及机制
2021-03-03
(河南大学第一附属医院老年神经内科,河南 郑州 475000)
帕金森病(PD)是一种多发于中老年的慢性神经退行性疾病[1]。研究表明,PD的病理进展与细胞氧化应激[2]、凋亡率增加[3]、线粒体功能障碍[4]等紧密相关。微小RNA(microRNA,miRNA)是一类长度为18~25 nt的短链小RNA,目前已被证实在人类多种疾病包括PD的发生发展中发挥重要的调控作用[5-7]。研究表明,miR-29a在PD病人血浆中表达量明显减少[8-10],表明miR-29a可能参与PD的发生发展和恶化过程。然而,miR-29a在PD中的作用及其具体的作用机制尚不明确。因此,本文通过1-甲基-4-苯基吡啶离子(MPP+)诱导PC12细胞构建PD细胞模型,观察miR-29a对细胞中活性氧(ROS)以及凋亡率的影响,为阐明PD发病的病理机制提供理论基础。
1 材料与方法
1.1 实验材料
PC12细胞由北纳生物公司提供,胎牛血清、DMEM培养基购自美国Gibco公司;MPP+、2′,7′-二氯二氢荧光素二乙酸酯(DCFH-DA)和噻唑蓝比色法(MTT)试剂购自美国Sigma公司;Trizol试剂、PCR逆转录试剂盒、荧光定量PCR(qPCR)试剂盒、荧光素酶试剂盒购自上海吉玛制药技术有限公司;细胞凋亡检测试剂盒购自美国BD公司;Lipofectamine 2000购自美国Life Technologies公司;对照质粒、anti-miR-29a质粒(5′-UAACCGAUUUCAGAUGGUGCUA-3′)均购自广州锐博生物科技公司。7500荧光定量 PCR 仪购自美国ABI公司,荧光显微镜购自日本OLYMBUS公司。
1.2 实验方法
1.2.1细胞培养方法以及模型构建 将PC12细胞培养在含体积分数0.10胎牛血清和青霉素-链霉素的DMEM培养基中,培养条件设为体积分数0.05 CO2、37 ℃,待细胞生长达到90%融合时加入胰蛋白酶按1∶3传代。取对数期的PC12细胞以5×105个接种到6孔板中,过夜分别培养,加入终浓度为0、100、300、500 μmol/L的MPP+,放置在37 ℃培养箱继续培养24 h。
1.2.2qPCR实验 收集PC12细胞,采用Trizol试剂提取细胞总RNA,根据逆转录试剂盒说明书操作,合成cDNA。以cDNA为模板,由上海生工生物技术公司设计、合成miR-29a和U6引物(见表1),进行qPCR扩增实验。以U6作为参照。反应条件:95 ℃、8 min;95 ℃、20 s,60 ℃、30 s,35个循环。使用2-ΔΔCt法计算miR-29a 的相对表达量。
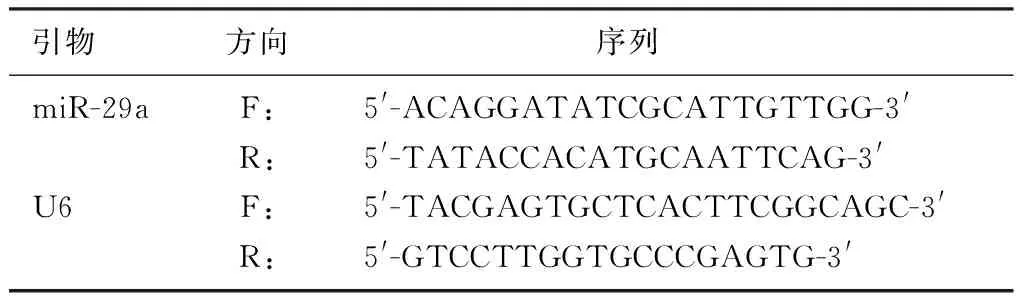
表1 qPCR扩增引物及其序列
1.2.3MTT实验 分别向不同浓度MPP+溶液孵育24 h后的PC12细胞中添加100 μL MTT溶液(500 mg/L),37 ℃孵育4 h,除去MTT溶液,再加入150 μL二甲基亚砜,反应10 min,使用酶标仪测定490 nm波长处吸光度值(A),计算各组PC12细胞的存活率,细胞存活率(%)=(实验组A-空白组A)/(对照组A-空白组A)×100%。
1.2.4细胞的转染 选取对数期PC12细胞,根据前期实验结果随机分为4组:0 μmol/L MPP++anti-NC组(A组)、0 μmol/L MPP++anti-miR-29a组(B组)、500 μmol/L MPP++anti-NC组(C组)、500 μmol/L MPP++anti-miR-29a组(D组)。A组、B组PC12细胞中加入0 μmol/L的 MPP+孵育24 h,并在Lipofectamine 2000介导下分别转染对照质粒和anti-miR-29a质粒。C组、D组PC12细胞中分别加入500 μmol/L 的MPP+孵育24 h后,再分别转染入对照质粒和anti-miR-29a质粒。继续培养48 h。
1.2.5细胞ROS的检测 收集各组PC12细胞接种至24孔板中,每孔加入10 μmol/L 的DCFH-DA,37 ℃孵育30 min。荧光显微镜下随机选取5个视野分析平均绿色荧光强度。
1.2.6流式细胞术实验 收集细胞,用PBS冲洗3次,调整细胞密度至1×109/L。根据细胞凋亡试剂盒说明书,在室温下每孔分别加入膜联蛋白 V-FITC和碘化丙啶各5 μL,混合均匀,孵育15 min。采用流式细胞仪检测凋亡率。
1.2.7双荧光素酶报告基因实验 用TargetScan(http://www.targetscan.org/vert_71/)软件预测miR-29a与重组人转化生长因子诱导因子同源框2(TGIF2)基因的靶向关系,荧光素酶进一步验证。野生型(TGIF2-wt)荧光素酶报告载体(含有与miR-29a结合位点)以及突变位型(TGIF2-mut)荧光素酶报告载体均购买自广州锐博生物科技公司。将TGIF2-wt和TGIF2-mut分别与对照质粒以及anti-miR-29a质粒共转染入PC12细胞,37 ℃培养48 h,采用荧光素酶试剂盒测定PC12细胞相对荧光素酶活性。
1.3 统计学分析

2 结 果
2.1 不同浓度MPP+对PC12细胞miR-29a表达量及细胞活力的影响
与0 μmol/L相比较,100、300、500 μmol/L 的MPP+诱导PC12细胞中miR-29a的表达量显著上升,差异具有统计学意义(F=590.067,P<0.05),PC12细胞存活率明显降低,差异具有统计学意义(F=153.561,P<0.05)。见表2。
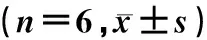
表2 不同浓度MPP+对PC12细胞miR-29a表达量及细胞活力影响
与A组相比,B组细胞中miR-29a的表达量明显降低,C组、D组细胞中miR-29a的表达量明显增加,差异具有统计学意义(F=574.765,q=8.106~45.723,P<0.05);与C组相比,D组PC12细胞中miR-29a的表达量明显降低,差异具有统计学意义(q=40.457,P<0.05)。见表3。
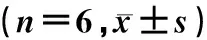
表3 转染anti-miR-29a质粒对miR-29a表达、ROS和凋亡影响
2.3 下调miR-29a对细胞ROS、凋亡的影响
与A组相比较,B组PC12细胞中ROS水平、细胞凋亡率无显著差异, C组、D组PC12细胞中ROS水平、凋亡率明显增加(F=254.120、301.044,q=7.076~36.233,P<0.05);与C组相比较,D组ROS的水平、凋亡率显著降低,差异均具有显著性(q=13.629、26.247,P<0.05)。见图1和表3。
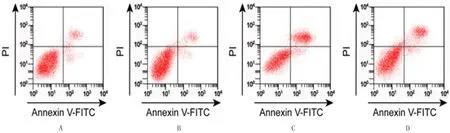
A:0 μmol/L MPP++anti-NC,B:0 μmol/L MPP++anti-miR-29a,C:500 μmol/L MPP++anti-NC,D:500 μmol/L MPP++anti-miR-29a。
2.4 miR-29a靶基因的预测和验证
TGIF2基因3′端非翻译区域与miR-29a靶向结合;与anti-NC与TGIF2-wt共转染相比,anti-miR-29a与TGIF2-wt共转染提高PC12细胞荧光素酶相对活性(t=21.266,P<0.05);但anti-miR-29a与TGIF2-mut共转染对PC12细胞荧光素酶相对活性无明显影响。见图2和表4。

图2 TargetScan预测miR-29a与TGIF2靶向关系
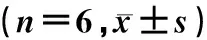
表4 miR-29a与TGIF2靶向关系的验证
3 讨 论
PD是一种运动障碍性疾病,随着年龄的增加患病风险增加,严重影响老年人的身体健康。研究表明,细胞凋亡在PD发生、恶化过程中具有重要作用[11-12]。研究证实,miRNA参与神经退行性疾病的发生发展,影响神经细胞的分化、凋亡等,从而影响病人的病理进程[13]。miRNA在PD病人中的表达量显著异常,表明miRNA可能在PD的病理演进过程中发挥重要的作用[14-16]。研究表明,miR-29a表达量异常在人类多种疾病中发挥重要作用,如结直肠癌、胰腺癌、胃癌、子宫内膜癌等[17-20]。邱峰等[21]通过μParaflo®微流体芯片技术发现,miR-29a在PD病人表达量明显上调。韩凯等[5]的研究也进一步证实,miR-29a在PD病人外周血清中表达量较对照组明显增加,可作为PD临床诊断的潜在新血清标志物。但miR-29a在PD发生发展过程中的具体作用尚不清楚。
目前,采用MPP+诱导PC12细胞构建PD细胞模型是国内外公认的研究模型[22-23]。本文研究结果显示,miR-29a表达量随着MPP+浓度的增加逐渐升高,表明miR-29a可能参与PD的发生发展过程。MPP+浓度越高,miR-29a的表达量越高,其中浓度为500 μmol/L的MPP+诱导PC12细胞的存活率为(45.674±3.152)%,因此选择500 μmol/L的MPP+作为后续实验干预浓度。此外,本实验结果还显示,转染anti-miR-29a质粒可明显降低PC12细胞中miR-29a的表达量,表明转染成功,可用于后续实验。本文进一步研究显示,抑制miR-29a的表达量可降低PC12细胞中ROS水平以及凋亡率,表明抑制miR-29a表达可能通过影响细胞的氧化应激水平和凋亡率,从而参与PD的病理进展。
miRNA主要通过靶向阻碍下游靶基因的转录或翻译,调控细胞的生物学特性,从而抑制或诱导疾病的病理进程[24]。TGIF2蛋白是三胺酸环延伸(TALE)蛋白家族成员之一,参与多种肿瘤如胶质瘤、前列腺癌、胃癌等的发生发展过程,对细胞的增殖、凋亡具有重要的调控作用[25-28]。TGIF2对胶质瘤和胶质瘤干细胞同样具有调控作用[29-33]。此外,TGIF2能够参与神经干细胞的调控,在调节神经系统发育中扮演重要角色。因此,推测TGIF2对神经细胞PC12的凋亡可能存在一定的调控作用[34-36]。在本实验中,在线预测显示miR-29a与TGIF2存在靶向结合位点,表明TGIF2可能是miR-29a的下游靶基因。双荧光素酶进一步验证表明,下调miR-29a与野生型TGIF2荧光素酶报告载体共转染可显著增加PC12细胞的荧光素酶活性,而与突变型TGIF2荧光素酶报告载体共转染对PC12细胞荧光素酶活性无显著影响,证实TGIF2是miR-29a的下游靶基因,表明miR-29a可能通过靶向TGIF2抑制MPP+诱导的PC12细胞凋亡和氧化应激反应,从而阻碍PD的进一步恶化。
综上所述,miR-29a在MPP+诱导的PC12细胞中表达量增加,且具有一定的浓度依赖性;下调miR-29a可能通过靶向TGIF2抑制MPP+诱导的PC12细胞凋亡,阻碍其氧化应激反应,这为PD基因靶向治疗提供新的方向。但本实验仅在细胞水平进行了相关研究,且本实验未涉及干扰TGIF2进行验证,本研究尚显不足,后续实验将对此进行补充。此外未来会进一步通过构建动物模型等深入探究miR-29a在PD发生发展中的作用及机制。
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
