新辅助免疫治疗对微卫星高度不稳定胃肠肿瘤的有效性和安全性病例探讨*
2021-03-02张哲宁程思远龚继芳陆明周军张小田李健沈琳彭智
张哲宁 程思远 龚继芳 陆明 周军 张小田 李健 沈琳 彭智
免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)中,如纳武利尤单抗(nivolumab)和帕博利珠单抗(pembrolizumab)已被批准用于局部进展或转移性不可切除胃肠肿瘤的晚期姑息治疗[1-5],然而其治疗效果在个体间表现出较大的差异性。既往研究表明:ICIs在某些患有错配修复基因缺陷(deficient mismatch repair,dMMR)或微卫星高度不稳定(microsatellite instabilityhigh,MSI-H)晚期恶性肿瘤的患者中具有非常良好的疗效[6]。根据Ⅱ期临床研究Keynote-158和Keynote-164的结果,帕博利珠单抗200mg每3周给药、共持续2年的治疗方案,在患有经治、dMMR/MSI-H晚期胃癌或转移性结肠癌的患者中分别产生了46%和33%的缓解率[4-5]。在另一项Ⅲ期临床研究Keynote-062中,患有经治、不可切除的、MSI-H胃癌的患者相较于微卫星稳定对照组,从挽救性免疫治疗中获益更多,表现出更长的无病生存期(progression-free survival,PFS)和总生存期(overall survival,OS)[7]。基于一项Ⅱ期研究CheckMate-142,当纳武利尤单抗和伊匹木单抗(ipilimumab)联用时,患者的生存指标更加良好[8]。姑息性免疫治疗的巨大成功使得肿瘤学研究者进一步探索早期新辅助免疫治疗在可切除恶性肿瘤中的潜力。近期NICHE研究发布了其完整的研究报告,20例dMMR结直肠癌患者经新辅助免疫治疗后达到95%主要病理学缓解率(major pathologic response,MPR)定义为切除组织和淋巴结中有≤10%残余的有活性的肿瘤细胞),其中60%患者达到病理学完全缓解(pathologic complete response,pCR)[9]。非小细胞肺癌(non-small cell lung cancer,NSCLC)、恶性黑素瘤和胶质瘤领域的先锋研究同样展现出令人鼓舞的结果[10-12]。尽管有这些前驱的报道,在胃癌方面目前的治疗数据仍十分有限。此外,尚缺乏研究阐明dMMR/MSI-H患者是否能从术前ICIs联合手术治疗中获益。本研究评估了dMMR/MSI-H胃肠恶性肿瘤患者行新辅助免疫治疗的有效性和安全性。
1 材料与方法
1.1 病例资料
回顾性选取2018年1月至2020年2月于北京大学肿瘤医院就诊的6例患者纳入本研究。纳入标准:1)患者年龄大于18 岁且小于70 岁;2)患有局部进展、转移或复发的不可切除胃肠道肿瘤,并经PCR法验证肿瘤为MSI-H型;3)包含至少1处影像学可评估靶病灶;4)ECOG 评分0~1 分;5)接受了包含免疫检查点抑制剂在内的新辅助治疗及后续手术治疗。不符合上述纳入标准,或临床、病理、影像学资料不完整的病例被排除在外。本研究通过北京大学肿瘤医院机构审查委员会批准。
1.2 方法
6例患者均接受全面的临床评估和影像学检查,后者包括CT 和/或MRI 检查。研究收集患者的人口学信息、病理和临床特征、治疗及随访策略,并使用二代测序技术(next-generation sequencing,NGS)获取每例患者活检标本的错配修复基因/微卫星不稳定性(MMR/MSI)状态,肿瘤突变负荷(tumor mutation bur⁃den,TMB)和驱动基因突变信息,使用免疫组织化学(immunohistochemistry,IHC)染色或原位杂交(in situhybridization,ISH)技术来判断标本PD-L1、HER2、EBER和EGFR的分子表达情况。
2 结果
2.1 患者的基线特征
6 例患者中男性4 例,女性2 例,中位年龄为62(46~79)岁。3例患者(50%)ECOG体力状态为0分,另3 例患者(50%)ECOG 体力状态为1 分。4 例患者诊断为胃癌,多数原发肿瘤位于胃窦(3/4),另外2例诊断为结直肠癌。所有患者的术前临床分期为Ⅲ期。IHC 染色和NGS 均证实了每例患者的dMMR/MSI-H 状态。根据IHC 染色结果,6 例患者中MLH1和PMS2 表达缺失是最常见的(3/6)。2 例(患者4 和患者6)的活检标本为EGFR 过表达(强阳性)。患者2 和患者4 的活检标本PD-L1 呈阳性,而其他患者标本为阴性。根据ISH检测的结果,全部标本EBER 和HER-2表达阴性。本研究进行了NGS检测以发现免疫治疗前活检组织的基因组变化和TMB。2 例患者(患者1和患者3)的肿瘤表现为高TMB。患者1和患者6 分别携带有BRCA2 移码突变和KRAS12 号外显子突变(p.G12D)(表1)。
2.2 患者治疗疗效及安全性评价
6例患者中,2例(患者2和患者6)初期接受过化疗,在前线化疗失败后转为免疫治疗(患者2接受niv⁃olumab,患者6接受信迪利单抗sintilimab和贝伐珠单抗bevacizumab 治疗)。其余4 例患者中,3 例接受了同期化疗(XELOX 方案)联合ICIs,1 例接受了双联ICIs(nivolumab 联合ipilimumab)(表2)。免疫治疗中位持续时间为10.8(6~15)周。新辅助治疗结束后,根据RECISCT 1.1 标准由CT 评估患者的临床反应。3 例患者达到部分缓解(partial response,PR)(50%),另外3 例患者达到疾病稳定(stable disease,SD)(50%)。经组织学评估证实,5 例(87%)患者达到pCR。图1 为来自患者2 具有代表性的病理缓解图像。没有达到pCR 的另1 例患者(患者3)也实现了TNM 降期(cT3N3M0),很大程度降低了后续进行根治性手术的难度。图2 展示了患者3 在新辅助免疫治疗前后的CT 扫描影像。值得注意的是,这例患者在新辅助免疫治疗4个周期后呈现出MMR/MSI 空间异质性。他的活检结果显示MLH1 在60%的视野中阳性,PMS2 在60%的视野中阳性,MSH2 和MSH6 在所有视野中为阳性(60%)(图3)。6例患者均对术前ICIs 耐受良好。1 例患者(患者3)发生1 度腹泻和2度腹痛,2例患者(患者4和患者5)发生1度恶心。没有观察到3/4 度不良反应或免疫相关不良反应的发生。所有患者均成功完成了根治性手术,并且没有手术相关并发症(出血、狭窄、瘘或全身并发症)后续产生。除了患者1和患者3接受了2剂辅助免疫治疗以外,其余4例患者在术后停止了支持治疗以外的抗肿瘤治疗。所有患者被要求以3 个月为周期规律随访,对肿瘤标志物和CT 扫描图像进行评估和监测。中位术后随访时间是10.5(7~18)个月。截止到目前,尚未观察到远期并发症或肿瘤复发的迹象。
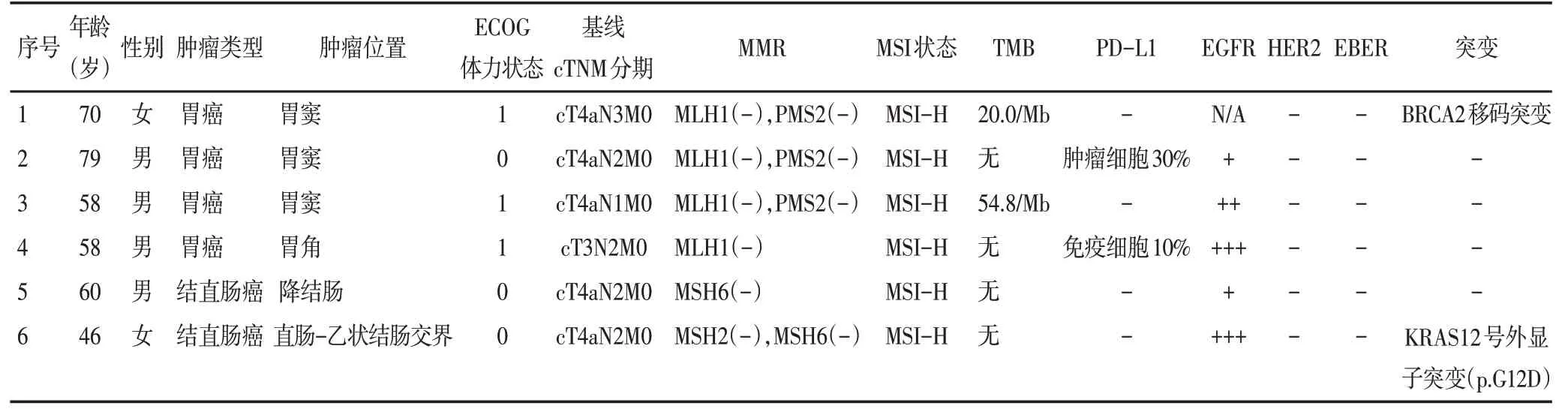
表1 6例患者特征总结
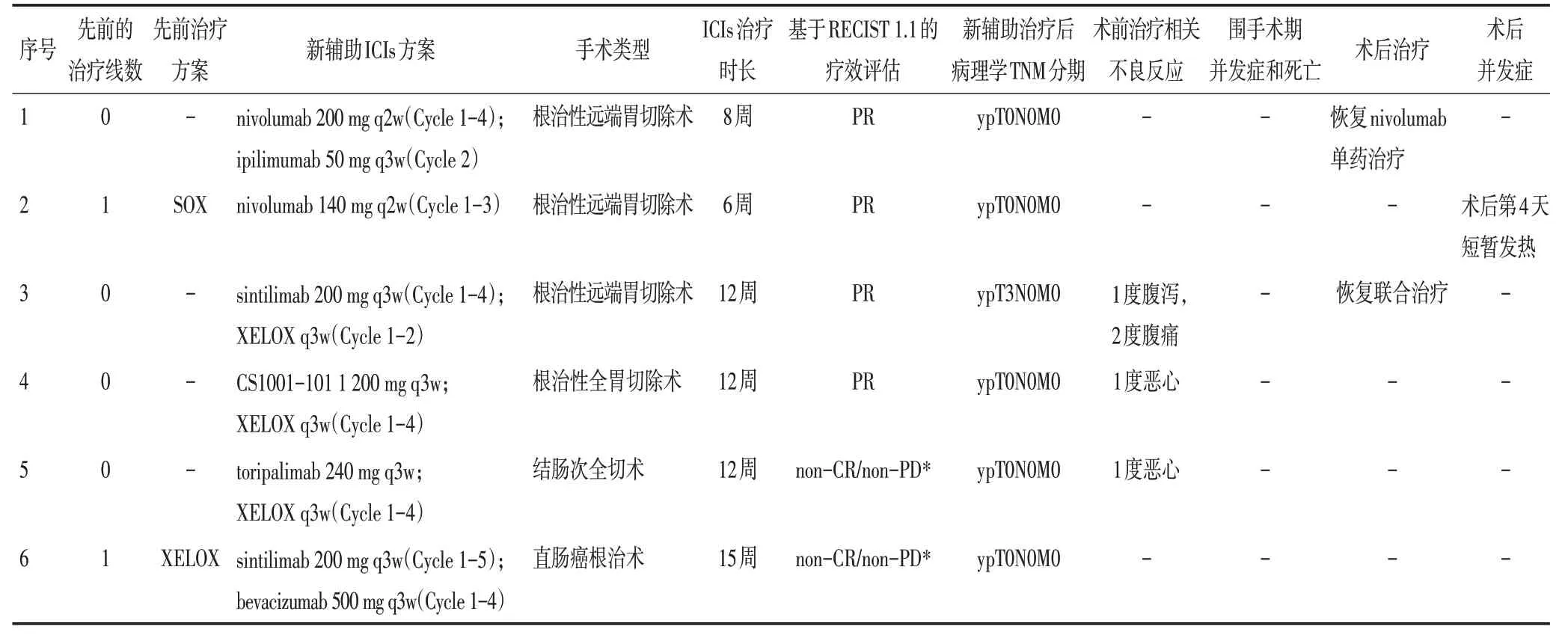
表2 6例患者治疗方案、疗效和不良反应总结
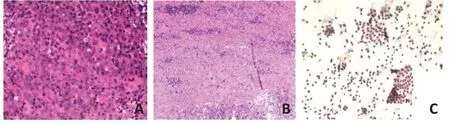
图1 患者2在新辅助免疫治疗后达到pCR
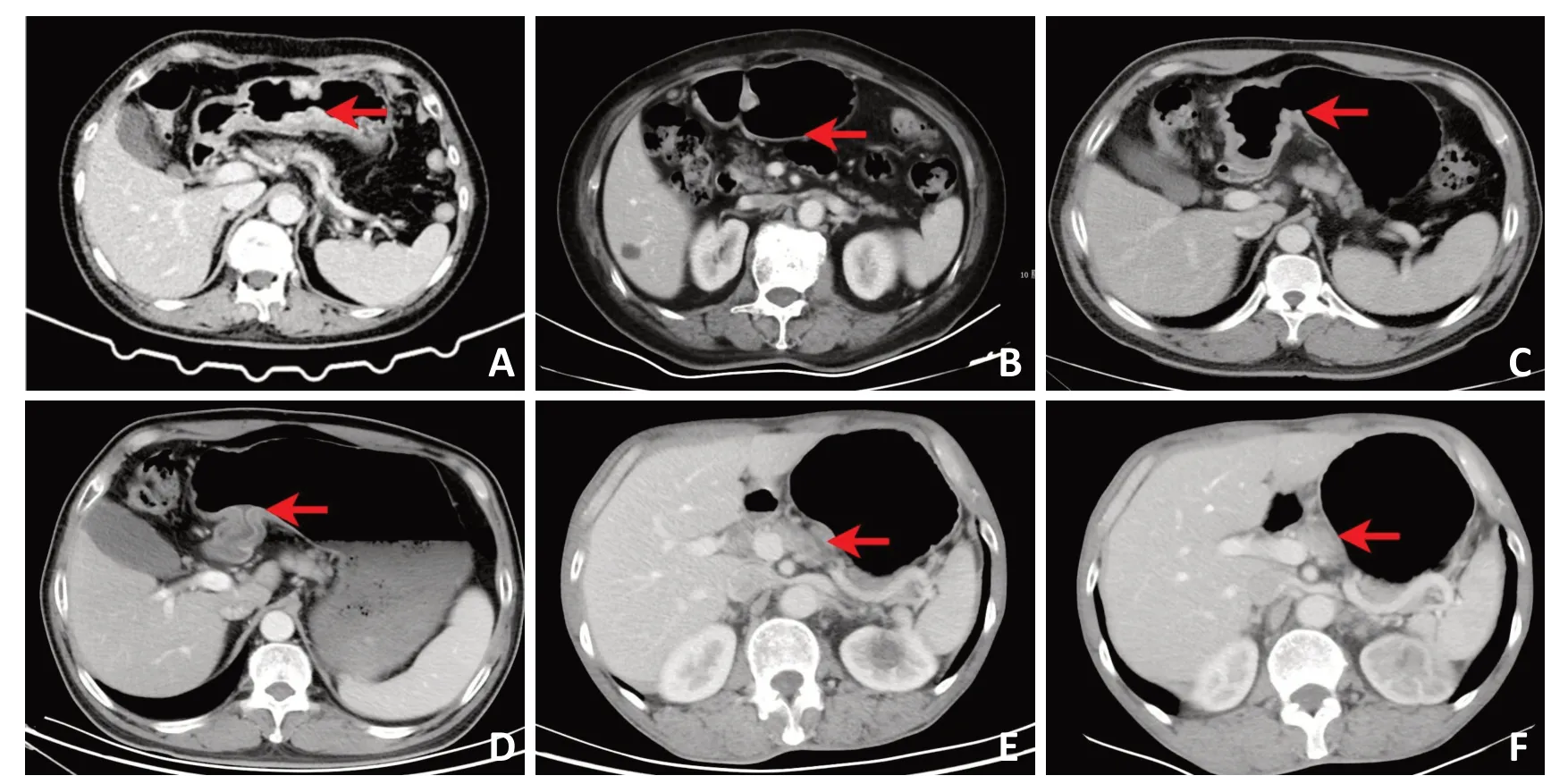
图2 新辅助免疫治疗前后影像学改变

图3 患者3在新辅助免疫治疗后的MMR/MSI状态异质性(×100)
3 讨论
dMMR/MSI-H 肿瘤在胃癌中占比8%~10%,在结直肠癌中占比15%~20%,属于肿瘤中一种特殊亚型,以肿瘤免疫原性高、免疫浸润强为特点[13-14]。既往研究报道,患有不可切除的dMMR/MSI-H 肿瘤的患者对挽救性免疫治疗反应良好[1-5,15-16]。但尚缺乏研究探索可切除的dMMR/MSI-H 肿瘤是否也能对免疫治疗有这样强效的反应。一般而言,新辅助治疗的目的是使根治性手术更容易、更安全地完成。然而近年来的研究表明,患有MSI-H 胃癌或结直肠癌的患者不能从围手术期或术前化疗中获益[14,17-18]。ICIs 的出现颠覆了晚期dMMR/MSI-H 恶性肿瘤的治疗模式。免疫治疗在近年来也获得了越来越多的关注。
既往的研究阐述了可手术切除肿瘤前期新辅助免疫治疗的原理。根据文献报道,未经治疗的肿瘤组织相较邻近正常组织更高表达PD-L1,此外一些肿瘤浸润T细胞过表达PD-1和CTLA-4[19-20]。这表明免疫抑制微环境在未经治疗的肿瘤组织中已然存在。另外,T细胞抗肿瘤反应的启动需要一定的肿瘤体积。由此肿瘤组织释放更丰富的抗原,以促进肿瘤细胞和免疫细胞间相互作用[21-23]。有研究表明ICIs难以在根治手术后建立保护性抗肿瘤免疫,这可证明上述的必要关系[24]。此外,新辅助免疫治疗相较于辅助治疗,可在早期建立免疫记忆,因而可更好地消除微转移病灶,后者则是导致肿瘤复发的关键因素[20,25]。
临床前研究也显示出新辅助ICIs相较辅助ICIs在生存结局方面的优越性。Liu等[26]建立了两种转移性乳腺癌的小鼠移植模型。该研究表明,同样的免疫治疗方案(抗PD-1联合抗CD-137)下,新辅助给药相较于辅助给药,总体生存率和转移病灶的控制率明显提高。
在2018年,Forde等[10]发表了一项先锋研究的结果。20 例患有未经治疗、可切除NSCLC 的患者接受了2 剂纳武利尤单抗的治疗。新辅助免疫治疗未导致任何1 例手术延误,并使得9 例患者(45%)在术前达到MPR。自此之后,国内外开展了一系列临床试验,证实了新辅助免疫治疗在可切除NSCLC 中的可行性[27-28]。在Ⅱ期探索性研究NADIM中,卡铂、紫杉醇和纳武利尤单抗三联用药可使得pCR 率达到69.2%,总体缓解率(MPR+pCR)达到84.6%[29]。Ⅲ期研究Keynote-189 和Keynote-407 更加展现出帕博利珠单抗联合化疗一线治疗NSCLC 的有效性[30-31]。这些NSCLC的研究结果为将新辅助ICIs应用于消化系统肿瘤提供了参考。
在本研究中,6例dMMR/MSI-H患者均积极地使用了新辅助ICIs。考虑到如果治疗不够强效,部分患者肿瘤进展风险较大,可能会失去根治性手术机会。因此其中3 例患者保留了同期最佳化疗。所有dMMR/MSI-H 患者,包括2 例前期化疗失败的患者,均对新辅助免疫治疗反应良好,耐受性佳。需要强调的是,尽管6 例患者肿瘤分期较高,其病灶皆可切除。然而考虑了既往的文献和本中心经验,如果仅进行手术切除,患者复发的风险很高,这是进行新辅助免疫治疗的原因。
本研究首先报道了患有晚期可切除dMMR/MSIH胃肠肿瘤的患者可从新辅助免疫治疗中获益,然而并未探索同期化疗与新辅助免疫治疗之间可能存在的相互影响。正如NSCLC临床研究所报道,一线ICIs或可增加后续化疗的效果和长期生存获益[32-33]。因此有理由推断,同期免疫治疗在治疗中起到了关键作用。未来的研究应除外混杂因素,以得出更加谨慎的结论。目前胃癌和结直肠癌中的新辅助免疫治疗临床试验总结见表3。
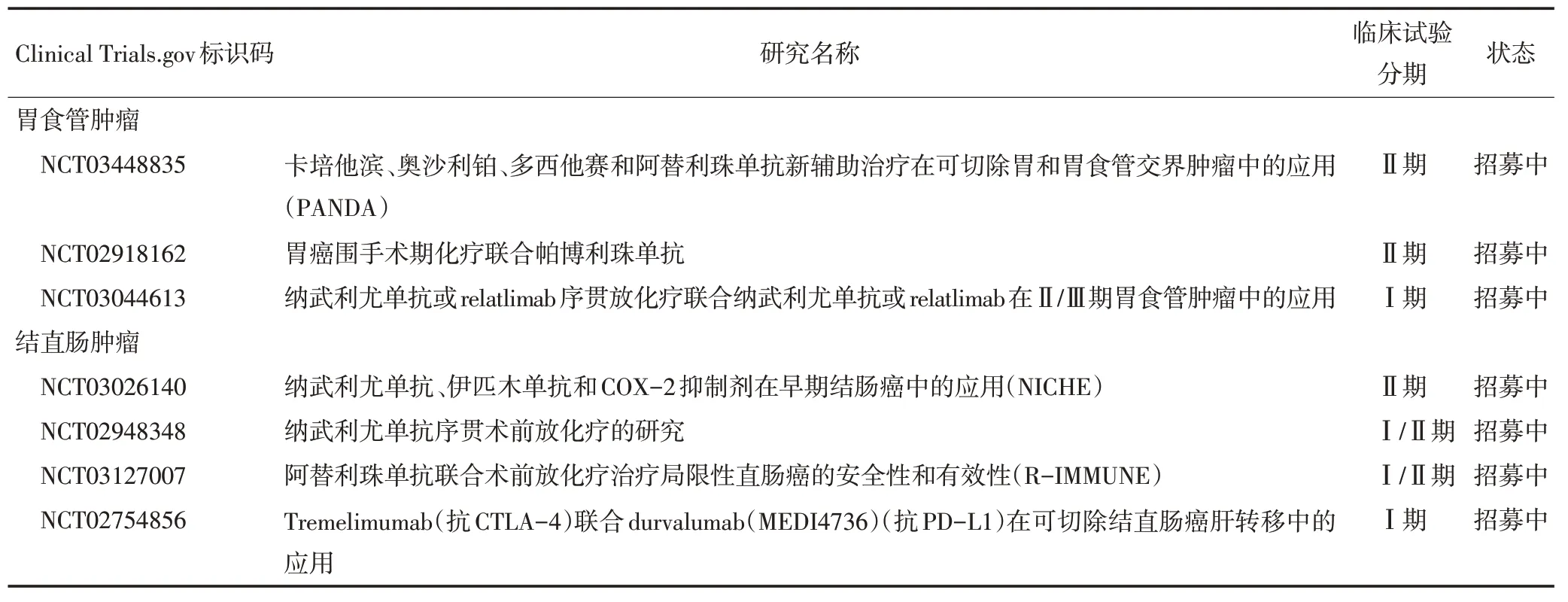
表3 正在进行的胃肠道恶性肿瘤的新辅助ICIs临床研究
值得一提的是,患者3的二次活检显示MLH1和PSM2 表达具有空间异质性,即在新辅助免疫治疗4个周期之后患者同时存在阳性和阴性区域。不同于其他患者,该患者未能达到pCR,但临床分期从cT4aN1 降到cT3N0。根据既往研究,MMR/MSI 异质性在MSI-H胃癌患者中的发生率为8.9%。该状态预示患者对免疫治疗反应不佳[34]。研究者推测,从MSI-H 转变为异质状态是导致治疗抵抗的原因。未来需要更大样本的研究来阐明这种MSI 异质性的临床意义。TMB定义为肿瘤基因组中每千个碱基对中非同义突变的数量,其反映肿瘤的免疫原性[35]。本研究结果显示:新辅助免疫治疗疗效与TMB 水平相关,与PD-L1 水平无关。这与Ford 等[10]研究中的结论一致。考虑到不同患者有不同的最佳治疗时间,因此未来的研究应着眼于新辅助免疫治疗“时间窗”的个体化。
新辅助治疗期间发生的不良反应较为轻微,且在围手术期或手术后未发生严重的并发症。6例患者中仅1例产生了1~2度胃肠道不适,且经对症处理后可缓解。因此,新辅助免疫治疗联合手术治疗在本研究中是安全可耐受的。研究者希望能从更大样本的研究中来获取更详实的安全性信息。
本研究衍生出许多有待解决的问题。首先,为评价ICIs的疗效,应开拓除影像学以外的替代评价手段。在本研究中,2例患者无法通过RECIST 1.1标准判断疗效。某些特定的情形下,尽管在CT 上肿瘤体积明显增大,而病理学活检却证实仅有很少或没有残余肿瘤组织。这种病理学和影像学表现的不一致性归因于免疫治疗后密集的免疫细胞浸润,这使得肿瘤体积增大,该现象被称为假性进展[36-37]。为了能更好地评估治疗疗效,研究者需要进一步研发能够真实反映病理学缓解或者提示分子特性(例如液体活检)的新检测方法[38-39]。考虑到液体活检不太可能广泛应用于一般医院,PET-CT 或可成为一种理想的替代选项。其能探查微小残留病灶,并可定量分析肿瘤代谢强度。PET-CT 已经被广泛应用于其他实体肿瘤的疗效评估中。第二,在新辅助治疗临床研究中,应探索新的、实用且准确的研究终点。除了OS和PFS 之外的备选终点,例如MPR,在新辅助化疗中已经初步展现出了评估病理缓解率方面的有效性[40]。其在新辅助免疫治疗中的应用仍需进一步探索。此外,pCR 是否意味着患者长期获益,这也需要进一步探索。第三,手术的最佳时机和新辅助ICIs的合适治疗时间应当予以规范。手术前不充分治疗或过度治疗有可能使得手术延误或增加不必要的风险。一项临床前研究模型显示,从最后一剂新辅助ICIs 到手术之间的最佳间隔对患者取得良好预后起决定性作用[41]。第四,未来的研究应着眼于筛选可能与受益者有关的生物标志物。截止到目前。TMB、PD-1表达、MSI状态和治疗结局间的相互联系,以及它们在免疫治疗中的动态演变鲜有研究。在癌症治疗中,新生物标志物正逐渐发挥重要的指导作用。这些分子标志物的临床应用可以协助研究者们进一步挖掘dMMR/MSI-H肿瘤新辅助免疫治疗的潜能。
本研究的局限性是样本量较小和随访时间较短。因此就目前而言,患者的长期生存数据无法获得。
总体来说,对患有dMMR/MSI-H 胃肠肿瘤的患者实施术前ICIs,可有效诱导病理学缓解,且治疗相关不良反应较少。新辅助免疫治疗后的手术可以安全有效地开展。新辅助ICIs的最佳治疗时间,以及新的生物标志物应在后续的研究中逐步阐明。此外还需开展大队列、随机化的临床研究来检验新辅助免疫治疗在dMMR/MSI-H 胃肠恶性肿瘤中的有效性和安全性。
本文于European Journal of Surgical Oncology刊载信息如下:Efficacy and safety of neoadjuvant immunotherapy in patients with microsatellite instability-high gastrointestinal malignancies:A case series[J].Eur J Surg Oncol,2020,46(10):e33-e39.
