一株产胶原蛋白酶海洋菌株的筛选及鉴定
2021-03-02郑刚王奇肖金星杨志坚陈冲赵小立
郑刚,王奇,肖金星,杨志坚,陈冲,赵小立*
(1.浙江大学舟山海洋研究中心,浙江舟山 316100;2.浙江大学生命科学学院,浙江杭州 310058)
胶原蛋白酶是能在一定的pH和温度下切割胶原蛋白主体螺旋多肽链的酶类[1];胶原蛋白降解酶指的是一类能降解天然非变性胶原蛋白的酶[2]。胶原蛋白酶是重要的商业化酶,许多细菌来源的胶原蛋白酶已被成功鉴定和表征。尽管海洋中的生物资源丰富,但是这些商业化酶中很少有海洋来源,特别是海洋细菌。本研究旨在筛选出一株产胶原蛋白酶的海洋细菌,提高水产品加工厂中废弃物的利用率。通过透明圈法筛出一株产胶原蛋白酶菌株,通过肉眼初步观察其形态学特征,随后提取其16S rRNA序列进行比对,以确定其种属来源;同时构建进化树,确定其亲缘关系。
1 材料与方法
1.1 仪器与设备
UNIVERSAL HOOD凝胶成像仪,BIO-RAD;eStain L1蛋白染色仪,金斯瑞;R 134 a冷冻离心机,Eppendorf;H1850R医用离心机、TG16-WS台式高速离心机,湖南湘仪;DW-86L386超低温冰箱,青岛海尔;YXQ-LS-50 S Ⅱ高压蒸汽灭菌锅、SPX-250B-Z生化培养箱,上海博讯;eclipse E200光学显微镜,Nikon;HS-840超净工作台,苏净安泰;UV-1800分光光度计,Shimadzu;ZQZY-88CN摇床,上海知楚;AL204电子天平、FiveEasy pH计,METTLER TOLEDO。
1.2 材料与试剂
葡萄糖(99%),琼脂粉、蛋白胨、酵母粉、Triton X-100为分析纯,购自上海生工;明胶,三氯乙酸、乙二醇甲醚为分析纯,购自阿拉丁;二水还原茚三酮,分析纯,购自源叶生物;水合茚三酮,分析纯,购自阿法埃莎公司;乙酸、乙酸钠、氯化钙等为分析纯,购自国药公司;SDS-PAGE凝胶配制试剂盒、5×非变性蛋白上样缓冲液,购自上海碧云天。
1.3 溶液制备
划线培养基:1.0%明胶、1.0%酵母粉、1.0%葡萄糖,加去离子水至1 000 mL,调节pH至7.5,115 ℃下高温灭菌20 min;固体培养基还需加入1.5%的琼脂。
种子发酵培养基:1.5%蛋白胨、1.5%的葡萄糖、1.0%的酵母粉,再加上七水硫酸镁0.2 g、磷酸氢二钾0.1 g、磷酸二氢钾0.5 g、氯化钙0.2 g,加去离子水至1 000 mL,调节pH至7.5,115 ℃下高温灭菌20 min。
基础发酵培养基:0.5%明胶、1.0%蛋白胨、1.0%氯化钠、1.5%的葡萄糖,加去离子水至1 000 mL,调节pH至7.5,115 ℃下高温灭菌20 min。
2 mol/L pH 5.4的乙酸缓冲液:86 mL 2 mol/L的乙酸钠与14 mL 2 mol/L乙酸混匀,调节pH至5.4。
茚三酮显色液:称取0.85 g水合茚三酮和0.166 8 g二水还原茚三酮,溶于100 mL乙二醇甲醚中,现配现用,避光保存。
0.1 mol/L pH 7.5的Tris-HC1(50 mmol/L氯化钙)缓冲液:称取1.21 g Tirs用少量去离子水溶解,并加入0.555 g氯化钙,调节pH为7.5,定容至100 mL。
底物溶液:2 g/L的明胶溶液。
洗脱液:称取0.605 g Tris、0.555 g氯化钙,吸取2.5 mL Triton X-100溶液,加水混匀定容至100 mL,调节pH为7.5。
孵育液:称取1.0%明胶、0.5%氯化钠,加去离子水至1 000 mL,调节pH至7.5,115 ℃下高温灭菌20 min。固体培养基还需加入1.5%的琼脂。
1.4 产胶原蛋白酶菌株的筛选
1.4.1 初筛
在浙江舟山水产品加工厂污水处理厂中,采集不同处理池的污水和污泥以及近海域的海水。在无菌环境中,分别取1 mL污水、海水和1 g污泥样品,使用0.9%的生理盐水溶液对样品进行连续10倍的梯度稀释。取0.2 mL不同稀释倍数的样品均匀涂布在明胶初筛选培养基平板上,于30 ℃下恒温培养。由于胶原蛋白酶可以降解明胶,而35%的三氯乙酸溶液会使蛋白质变性。因此,当明胶被水解后,菌落周围的培养基在三氯乙酸作用下会形成肉眼可见的透明圈,以透明圈的大小作为筛选产胶原蛋白酶菌产酶能力的标准。通常情况下,透明圈直径的大小与菌株产酶能力成正比。因此,挑取透明圈较大、长势较好的单菌落再培养,作为进一步筛选工作的出发菌株。
1.4.2 复筛
经过菌株初筛后,分离得到一定数目的菌株。分别取少量菌液点在明胶初筛培养基平板中央,并将平板置于30 ℃恒温培养箱中培养2 d后,取出平板,均匀涂布35%的三氯乙酸溶液,观察并记录平板上形成透明圈的情况。选取透明圈直径与菌落比值(HC值)较大的初筛菌株进行后续研究。进一步将所选菌株接入种子培养基中,30 ℃、180 r/min条件下在气浴摇瓶中培养至OD值达到1.0后得到种子培养液。随后,取2.5 mL不同样品的种子培养液分别接种至50 mL发酵培养基中(装液量为50 mL发酵液的250 mL锥形瓶)继续培养。培养2 d后收集得到的发酵液(取2 mL样品,于12 000 r/min、4 ℃下离心10 min,取上清液)。由于茚三酮显色液检测甘氨酸浓度时,会受到发酵液中存在的其他氨基酸分子的干扰,影响实验的准确度。因此,收集得到的上清液还需进行进一步的处理:经过10 kD、0.5 mL的超滤管超滤,用无菌水冲洗3次,12 000 r/min、4 ℃下离心10 min,再将酶液定容至原体积,即为最终需要检测的样品。由于此过程会有酶损耗,实际酶活会比测量值大。每组样品重复3次平行实验。
1.5 酶活测定
1.5.1 标准曲线
取6只相同规格的试管,依次加入浓度为0 mmol/L、0.06 mmol/L、0.12 mmol/L、0.18 mmol/L、0.24 mmol/L、0.30 mmol/L的甘氨酸标准溶液1.0 mL。然后加入1 mL乙酸缓冲液并混匀,加入1 mL茚三酮显色液,混合后沸水浴15 min,随后放在自来水中冷却5 min,加入3 mL 60%乙醇,充分混合后,使用分光光度计在570 nm下测量吸光值。以甘氨酸浓度为横坐标,吸光值为纵坐标,绘制标准曲线。
1.5.2 样品测定
以0.2%的明胶溶液为底物,反应体系为:0.2%的明胶溶液50 μL和0.1 mol/L、pH 7.5的Tris-HCl(含50 mmol/L CaCl2)溶液50 μL混合,粗酶液25 μL,在37 ℃反应0.5 h,加入10%三氯乙酸溶液125 μL终止反应。随后,加入乙酸缓冲液250 μL,混匀,再加入茚三酮显色液250 μL,混匀。再将混合溶液置入沸水浴中15 min,后于冷水中冷却5 min,再加入60%乙醇750 μL。充分混合后,使用分光光度计测量溶液在570 nm下的吸光值。由于茚三酮显色液不是很稳定,在显色1 h内需测完OD值,否则结果不准确。茚三酮显色法可以测定体系中的水溶性氨基酸和短肽。通常在采用该方法时会以甘氨酸为标准氨基酸进行检测。酶活力单位定义为:在37 ℃、pH 7.5条件下,每分钟水解胶原蛋白产生相当于1 μmol甘氨酸所需的酶量为1个酶活力单位U。为了尽量减小误差,要求发酵液现取现测[3]。
1.6 菌种分离纯化
经过菌株的复筛后,将得到的菌液通过划线法在明胶划线培养基上进行纯培养,得到单菌落。
1.7 菌种的保存
将划线得到的单菌落接种入种子培养基中摇瓶培养,培养条件为30℃、180 r/min。菌液OD值达到1.0后,取1 mL的菌液与等体积的50%甘油混合,后将混合液移至冻存管,保藏于-80 ℃冰箱中备用。
1.8 生长曲线和产酶曲线的绘制
取冻存管中的菌液,在平板上划线活化菌株。挑取生长良好的单菌落接种至种子培养基中,30 ℃、180 r/min条件下的气浴摇瓶中培养至OD值达到1.0后得到种子培养液。再取种子液以5%的接种量转接至发酵培养基中,同样的条件下继续培养。从接种时起第一次取样,然后每隔2 h取样一次。每次取样4 mL发酵液进行检测:2 mL样品用于检测菌株生长情况,以新鲜培养基作为参照测定菌液在OD600下的吸光值;2 mL样品用于检测发酵液中的产酶情况,即采用茚三酮法检测发酵液中的酶活。每组样品重复3次平行实验。
1.9 菌落和细胞的形态观察
取冻存管中的菌液,在平板上划线活化菌株。挑取生长良好的单菌落接种至种子培养基中,30 ℃、180 r/min条件下的气浴摇瓶中培养至OD值达到1.0后得到种子培养液。取菌液制片后在光学显微镜下观察细胞形态、繁殖方式和运动能力等特征情况。同时,将菌液稀释后再次划线,以期得到生长良好、便于观察的单菌落。30 ℃恒温培养箱中培养,待平板上长出生长良好的单菌落后,对菌落的形貌特征进行观测记录。
1.10 生理生化试验分析
以《伯杰氏细菌鉴定手册》和《常用细菌系统鉴定手册》中所介绍的菌种分类鉴定方法,对筛选得到菌株进行生理生化特征分析。
1.11 分子生物学鉴定
取2 mL筛选得到的菌株种子液,送至杭州擎科生物公司进行菌属鉴定,并对鉴定结果进行分析。
1.12 明胶酶谱鉴定
在常规的SDS-PAGE分离胶中加入溶度为1%的明胶,使明胶在分离胶中的终浓度达到0.1%,明胶SDS-PAGE体系如表1所示。上样缓冲液为非变性还原条件,将发酵上清液离心后超滤,和上样缓冲液混匀后静置10 min,在冰浴的条件下电泳。电泳结束后,摇晃条件下将凝胶在洗脱液中浸泡复性45 min,2次;再在孵育液中摇晃温浴30 min,2次。之后将凝胶取下来,在蛋白染色仪中染色、脱色,观察水解带的出现[4]。

表1 明胶SDS-PAGE体系
2 结果与分析
2.1 菌种筛选
本实验主要以是否能水解明胶作为初步筛选产胶原蛋白酶菌株的依据。试验从海水样中经过菌液富集、平板涂布以及菌株挑选等常规步骤入手,根据初筛培养基平板上菌株形成透明圈的大小,最终成功分离到了10株具有明显水解明胶能力的菌株。将这些菌依次命名为YQ-1至YQ-10菌,并利用复筛方法进一步测定每种菌株发酵液中的产酶活力大小,实验结果如图1所示。

图1 各菌种酶活和对应HC值的大小
根据所测得各菌种所产胶原蛋白酶酶活的高低,结合相对应的菌落水解圈大小,最终确定以菌株YQ-1作为出发菌种进行后续的试验研究,此时该菌的酶活为(12.4±0.4)U/mL,其形成的水解圈如图2所示。

图2 菌株YQ-1水解圈
2.2 甘氨酸标准曲线
测定不同浓度甘氨酸的OD570值,制成由图3所示的甘氨酸标准曲线。该标准曲线可以标定胶原蛋白酶活力,通过曲线拟合得到线性标准方程为y=5.152x,R2=0.995 9>0.99,数值可用。

图3 甘氨酸标准曲线
由此可得酶活(U/mL)计算公式如公式(1)所示。

式(1)中,75为甘氨酸的相对分子质量;N为稀释倍数;30为反应时间。
2.3 菌株YQ-1生长曲线和酶活力曲线
图4为菌株YQ-1的生长曲线,可以看出其依次经历了迟滞期、对数期、稳定期、衰亡期4个不同的生长时期。从菌株的生长曲线不难发现,目标菌在培养4 h后,呈现出明显的指数式增长趋势;接近14 h时,生长速度则逐渐放缓,随即达到稳定期;稳定期持续10 h后进入衰亡期。而菌株在8 h左右才开始产酶,是由于发酵培养基中含有明胶,在前几个小时,菌株产酶量较低,明胶还没有被降解,培养基中明胶含量高导致溶液呈胶状,无法测出酶活,在发酵8 h后,溶液的明胶含量降低,才能检测出酶活,在40 h左右酶活达到最大,此时菌体浓度开始显著下降,说明菌体浓度显著影响菌株产酶。

图4 YQ-1菌株在发酵培养基中的生长曲线和产酶曲线
2.4 菌落和细胞的形态特征
菌株YQ-1在明胶培养基平板上培养2 d后,出现质地均一的菌落。同时可以观察到:菌落呈淡黄色,外轮廓规整且不黏稠,中间凸起,似水滴状。镜检发现为短杆状、有鞭毛,革兰氏阴性。菌落形态效果如图5及6所示。

图5 YQ-1涂布平板形成的菌落形态

图6 YQ-1显微镜形态图
2.5 生理生化试验结果及分析
以《伯杰氏细菌鉴定手册》和《常用细菌系统鉴定手册》中所介绍的菌种分类鉴定方法,对菌株YQ-1进行生理生化特征分析。结果显示此菌为好氧菌,能对大部分的糖类和少数的醇类合理利用,具有水解酪素、明胶的能力,繁殖速度快,无淀粉酶活力,对生存环境的温度要求不高,具体结果如表3所示。
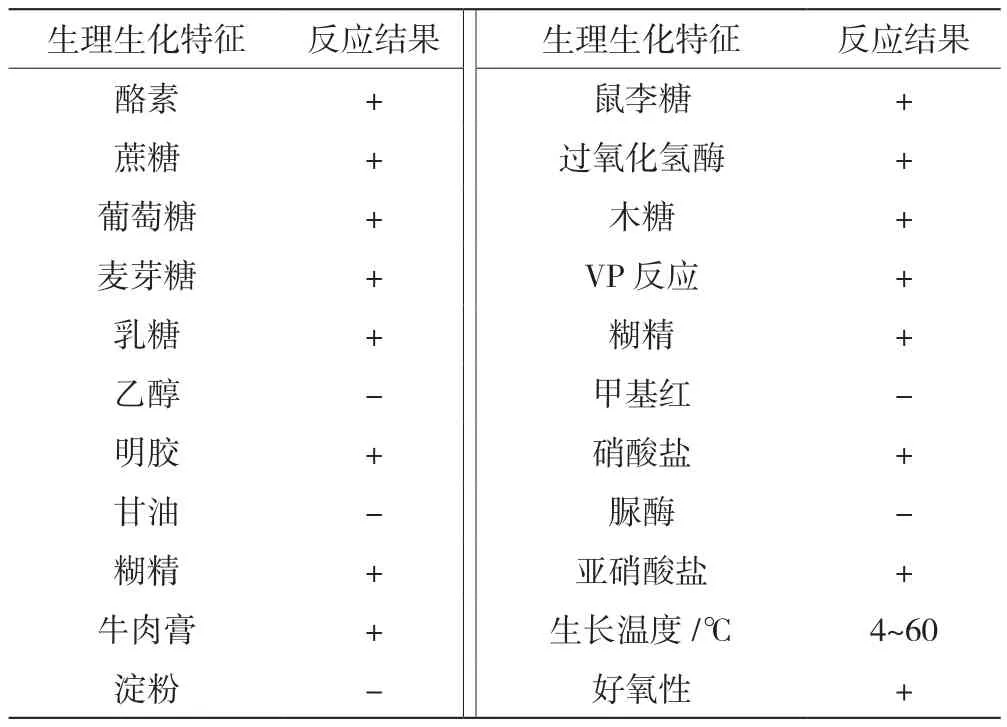
表3 生理生化试验结果
2.6 分子生物学鉴定
培养并收集YQ-1菌菌液,采用CTAB/NaCl法提取基因组DNA,采用通用引物以基因组DNA为模版进行PCR扩增后得到基因序列的长度为1 396 bp,利用Genbank中的BLAST程序检索结果表明该菌与嗜麦芽寡养单胞菌的相似度极高,几乎接近100%,因此将其确定为Stenotrophomonas maltophilia YQ-1。同时选择合适的模式菌株16S rRNA基因序列应用Clustal W (Version 2.0)进行多序列比对,再用Mega 7.0软件构建出YQ-1菌16S rRNA基因系统进化树如图7所示。

图7 基于16S rRNA序列构建嗜麦芽寡养单胞菌YQ-1与近源菌株的系统发育树
3.7 明胶酶谱鉴定结果
活性胶原蛋白变性后以明胶的方式存在,明胶酶和胶原蛋白酶有一定的相似性,活性胶原蛋白容易变性,不易溶解。因此,以明胶为活性底物,制备明胶SDSPAGE,对嗜麦芽寡养单胞菌YQ-1发酵液进行明胶酶活性分析,产生的胞外明胶酶结果如图8所示。可以看出,该菌株胞外至少产生2种不同的明胶活性的酶。

图8 明胶酶活性电泳分析
3 结论
本文从海水样中筛选出一株能在明胶平板上产生透明圈的菌株,综合菌株的形态、生理生化以及16S rDNA系统发育树分析等方面的试验结果,菌株YQ-1被鉴定为嗜麦芽寡养单胞菌属;形态为圆形、淡黄色。对该菌进行产酶试验发现,其能够产生过氧化氢酶、能分解酪素、无淀粉酶活性,能对大部分的糖类和少数的醇类合理利用;此菌为好氧菌,繁殖速度快,生长周期短,对生存环境的温度要求不高;该菌还能产生至少2种具有明胶活性的酶。目前,有关胶原蛋白酶活力体系比较成熟的是来源于溶组织梭菌,嗜麦芽寡养单胞菌的研究报道很少,没有相关的胶原蛋白酶活力的系统,具备深入优化研究的价值。
