高效液相色谱-荧光检测器法检测单克隆抗体注射液中吐温80的含量
2021-03-02张博慧贾戴辉许俊彦
张博慧,贾戴辉,许俊彦
(宝船生物医药科技(上海)有限公司药物分析部门,上海 201203)
吐温80又名聚山梨酯80,其化学名为聚氧乙烯20山梨醇酐单油酸酯,作为助溶剂、乳化剂和稳定剂,常用于治疗性单克隆抗体注射液制剂中[1]。近年来,关于吐温80能够诱发过敏反应的报道越来越多[2-6],建立一种准确有效的测定吐温80含量的方法尤为重要。
目前,用于检测吐温80含量的方法主要有比色法[7]、高效液相色谱-蒸发光散射(HPLC-ELSD)检测法[8]、水解法[9]、质谱法[10-11]等。比色法因对设备要求比较低而应用广泛,但该方法耗时、重复性较差,且对蛋白浓度较高样品适用性差;HPLC-ELSD法检测结果较准确,应用范围较广,但是ELSD系统易受蛋白污染而影响检测结果;水解法是将吐温80水解成油酸,利用高效液相色谱-紫外检测器检测,该方法耗时较长,易受油酸稳定性的影响;质谱法需要使用昂贵的仪器,因此使用范围受限。本研究建立了采用高效液相色谱仪配备荧光检测器检测单克隆抗体中吐温80含量的方法,并进行了方法学验证。
1 材料与方法
1.1 试验材料
供试品单抗1、单抗2、单抗3均为宝船生物医药科技(上海)有限公司生产的单克隆抗体注射液;Humira(修美乐)购自雅培公司;Opdivo(欧狄沃)购自百时美施贵宝公司;Erbitux(爱必妥)购自默克公司。
1.2 试剂与仪器
吐温80(药用级)购自威尔药业;十水四硼酸钠(ACS试剂级)、N-苯基-1-萘胺(NPN, 98%)均购自Sigma公司;氯化钠(HPLC级)购自阿拉丁公司;乙腈(ACN, HPLC级)购自Fisher公司;反应线圈(Reaction coil 750 μL)购自赛默飞公司;1260高效液相色谱仪,安捷伦,配备荧光检测器。
1.3 实验方法
1.3.1 色谱条件
柱温箱温度25 ℃,样品盘温度5 ℃,荧光检测器λex=350 nm、λem=420 nm;流动相为 0.15 mol/L氯化钠、0.025 mol/L十水四硼酸钠、5.0% ACN、5.0 mol/L NPN、2.5 mg/L吐温80;流速1.5 mL/min;进样量10 μL;等度洗脱。
1.3.2 除蛋白试验
(1)分别将1倍、3倍、5倍和7倍体积的乙醇-氯化钠饱和溶液以及5倍体积的乙醇、乙腈加入样品中,震荡后离心,取上清测蛋白浓度。将上清干燥后用超纯水复溶,上机检测吐温80含量。
(2)由3名实验人员分别用5倍体积的乙醇-氯化钠饱和溶液沉淀蛋白,进行吐温80含量的测定。
1.3.3 蛋白干扰试验
将不含吐温80的样品用超纯水稀释至蛋白浓度分别为20 mg/mL、30 mg/mL、40 mg/mL、50 mg/mL和60 mg/mL,应用“1.3.1”色谱条件直接进样分析。
1.3.4 方法验证
1.3.4.1 专属性
分别取阴性对照样品(不含吐温80,蛋白浓度20 mg/mL)、不含吐温80的稀释缓冲液、浓度为0.1 mg/mL的吐温80标准液和单抗1进行吐温80含量检测,验证各样品色谱图在吐温80保留时间内的出峰情况。
1.3.4.2 精密度
平行取6份单抗1进行吐温80含量检测,计算6个结果的保留时间和吐温80含量的RSD值进行重复性验证;由另一名实验人员重复该操作,计算两名实验人员12个结果的保留时间和吐温80含量的RSD值,并进行中间精密度验证。
1.3.4.3 准确度
配制吐温80含量分别为0.05 mg/mL、0.10 mg/mL和0.80 mg/mL,蛋白含量均为20 mg/mL的样品进行HPLC检测,统计各浓度样品的吐温80回收率。
1.3.4.4 线性和范围
将吐温80标准品分别稀释至浓度为0.800 mg/mL、0.400 mg/mL、0.200 mg/mL、0.100 mg/mL、0.050 mg/mL和0.025 mg/mL,进行吐温80含量检测。以吐温80含量为横坐标,峰面积为纵坐标绘制回归方程,并计算R2。符合精密度、准确度和线性的吐温80含量范围即为该方法的检测范围。
1.3.4.5 耐用性
将样品置于样品储存室(5±3)℃内,分别于0 h、8 h、24 h和48 h进行吐温80含量检测,计算各时间点相对于0 h的吐温80含量的相对差值。应用不同批号的反应线圈分别进行吐温80含量的检测,计算两个结果的相对差值。
1.3.5 单克隆抗体注射液中吐温80含量的测定
应用“1.3.1”色谱条件对6种单克隆抗体注射液进行吐温80含量的检测。
2 结果与讨论
2.1 除蛋白研究
为了消除蛋白对检测结果的影响,对供试品(单抗1,蛋白浓度20 mg/mL,吐温80含量0.1 mg/mL)进行除蛋白研究。用不同有机试剂(乙醇、乙腈、乙醇-氯化钠饱和溶液)及不同比例的乙醇-氯化钠饱和溶液沉淀蛋白,结果见表1。结果表明,虽然用乙醇沉淀蛋白后吐温80检测结果最高,但是由于其除蛋白效果较差,吐温80含量结果偏高有可能是受到蛋白的干扰所致。用乙腈及不同比例的乙醇-氯化钠饱和溶液除蛋白效果良好,5倍体积的乙醇-氯化钠饱和溶液吐温80回收率相对较好。

表1 不同种类和比例有机试剂除蛋白试验结果
由3名实验人员分别平行制备6个样品,考察除蛋白操作的重复性。,试验结果见表2。表2结果表明,吐温80的回收率低,重复性差。
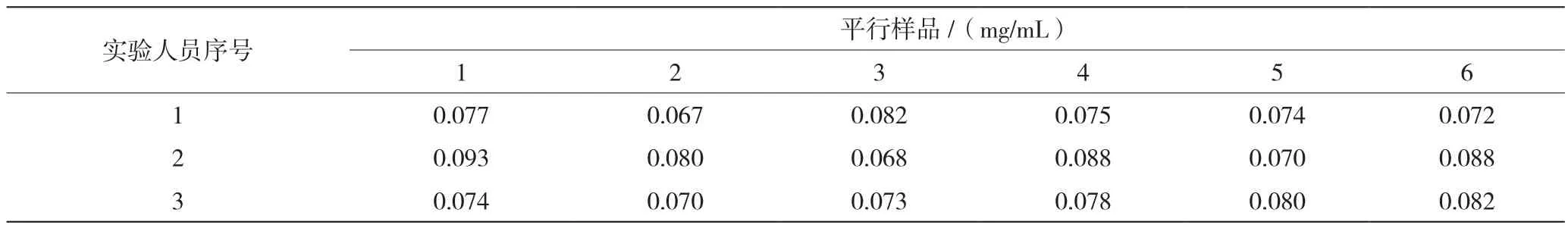
表2 不同实验人员吐温80检测结果
2.2 蛋白质干扰试验
由于除蛋白操作重复性差,吐温80含量回收率低,因此考虑用直接进样的方法进行上机检测,这需要研究蛋白质对检测的干扰。选择与单抗1吐温80含量一致的0.1 mg/mL吐温80标准品作为参比,计算不同蛋白浓度样品峰面积与0.1 mg/mL吐温80标准品峰面积的比值,结果见表3和图1。结果表明,在蛋白含量为20~60 mg/mL,蛋白的干扰均较小。值得注意的是,蛋白含量越高,对检测的干扰越大,因此对于高浓度的蛋白样品,若选择该方法进行吐温80含量的检测,需要首先评估蛋白对检测结果的干扰程度,决定该方法是否适用。

图1 蛋白干扰试验
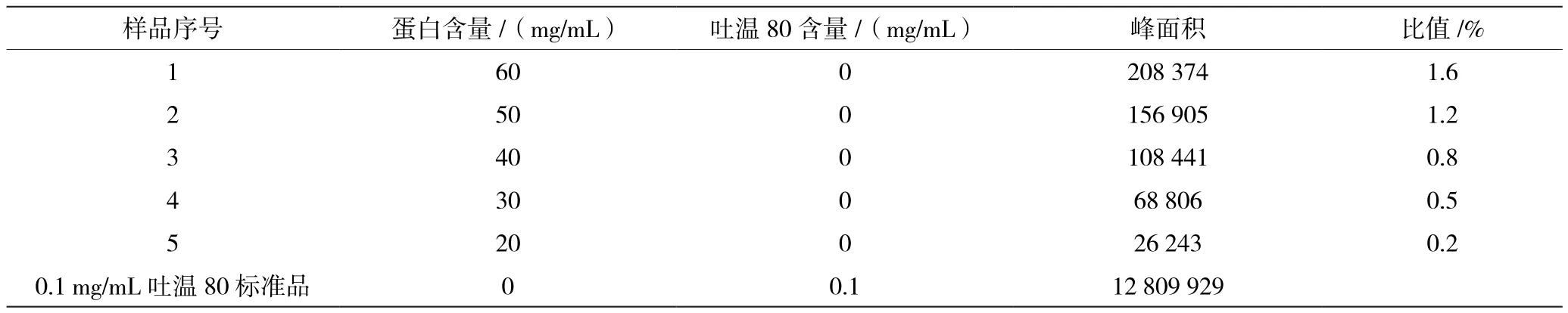
表3 蛋白干扰试验
2.3 方法学验证
2.3.1 专属性
图2显示,供试品和0.1 mg/mL吐温80标准品保留时间和峰面积一致;阴性对照样品峰和稀释缓冲液几乎无干扰(由于流动相中添加了一定比例的吐温80,所以稀释缓冲液在吐温80保留时间内出现倒峰,属正常现象)。
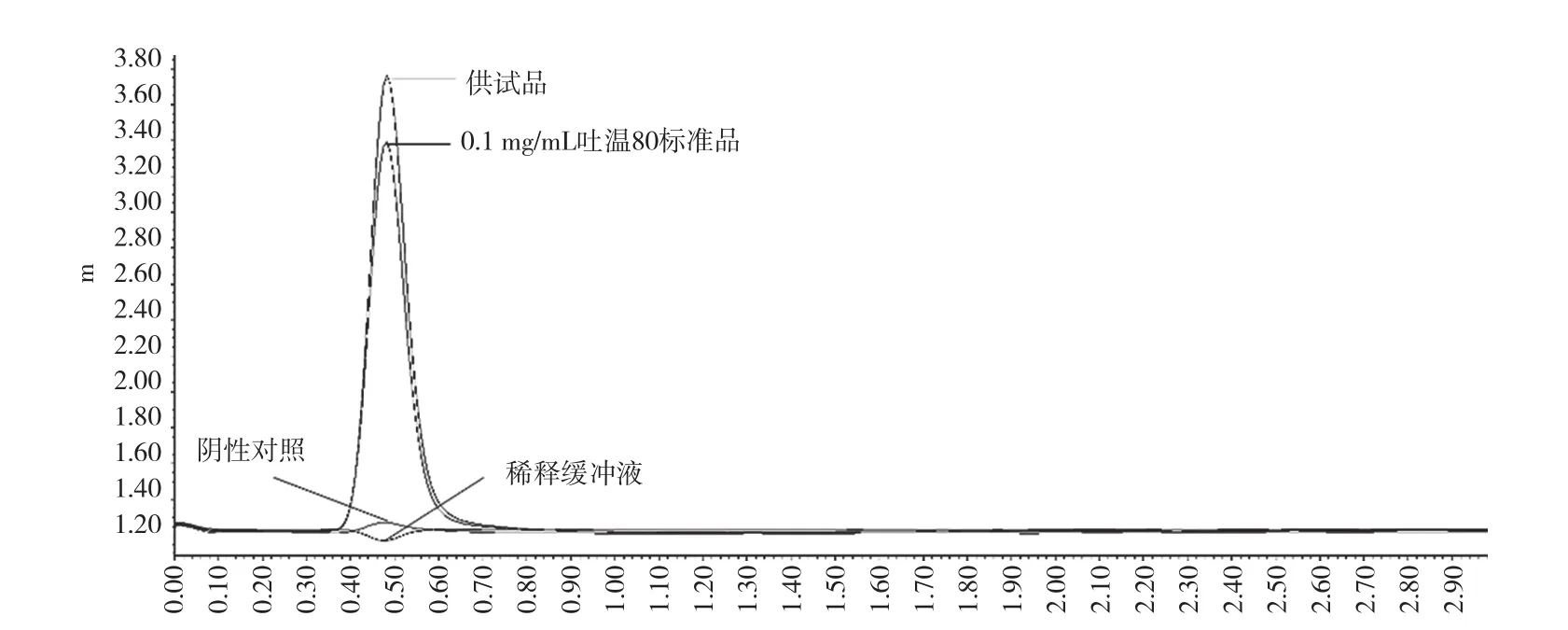
图2 专属性试验色谱图
2.3.2 精密度
2.3.2.1 重复性
重复性试验结果见表4,由结果可知,6个结果中保留时间和吐温80含量的RSD值分别为0.5%和0.4%。
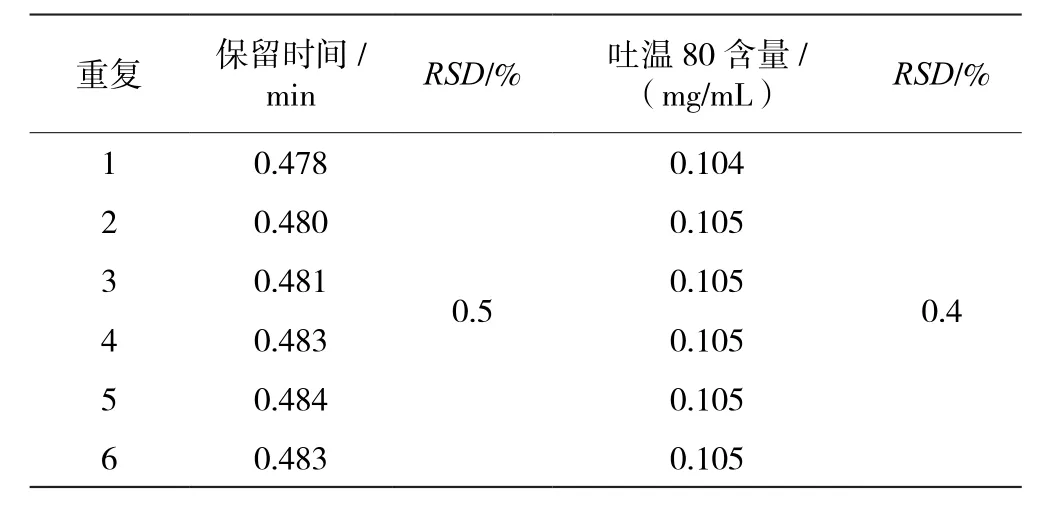
表4 重复性试验结果
2.3.2.2 中间精密度
中间精密度结果见表5,由结果可知,2名操作人员12个结果中保留时间和吐温80含量的RSD值分别为0.4%和2.2%,说明该方法的精密度良好。

表5 中间精密度试验结果
2.3.3 准确度
准确度试验结果见表6,结果表明3个浓度水平的样品回收率分别为105%、98%和108%,在90%~110%,说明该方法的准确度较高。

表6 准确度试验结果
2.3.4 线性和范围
线性试验结果如表7所示,结果表明在0.025~0.800 mg/mL范围内,吐温80含量和峰面积线性关系良好,标准曲线为Y=2×108X-4×106,线性相关系数R2为0.999 1。由以上结果可知,符合重复性、准确度和线性的检测范围为0.05~0.80 mg/mL。

表7 线性试验结果
2.3.5 耐用性
2.3.5.1 样品稳定性
样品稳定性试验结果见表8,结果表明样品在仪器样品储藏室(2~8 ℃)中放置8 h、24 h和48 h后,吐温80含量与0 h的相对差值分别为3.0%、4.0%和1.0%,说明样品在仪器样品储藏室内放置48 h后对检测结果几乎无影响。
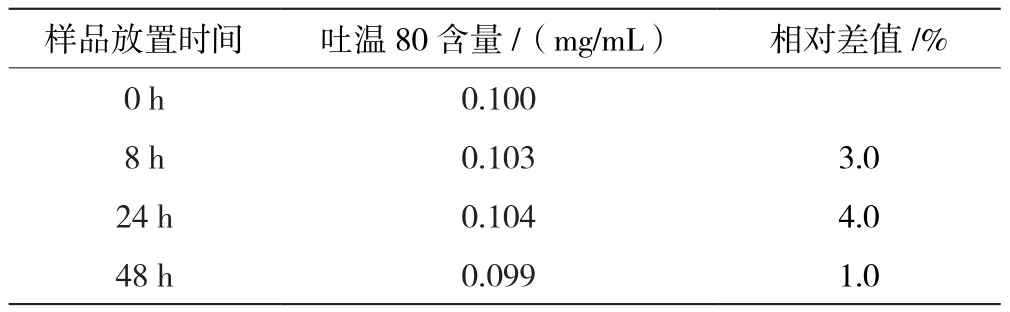
表8 样品稳定性试验结果
2.3.5.2 反应线圈批次
反应线圈批次试验结果见表9,结果表明应用不同批次的反应线圈的相对差值为3.3%,说明反应线圈批次对检测结果无影响。

表9 反应线圈批次试验结果
2.4 方法适用性研究
应用本方法对6种单克隆抗体注射液进行吐温80含量的检测,检测结果见表10。结果显示实测值与理论值的偏差介于0%~15%,准确度较高。

表10 方法适用性研究结果
在HPLC-FLD方法中,吐温80胶束可被荧光基团NPN标记,在波长为350 nm的紫外光激发下发出波长为420 nm的荧光信号,经荧光检测器检测后形成色谱图。该方法会在流动相中添加一定比例的吐温80,这样保证了检测过程中吐温80含量均大于临界胶束浓度,从而使检测结果更准确[12]。该方法为单克隆抗体注射液中吐温80含量的测定提供了另一种不同原理的检测方法,具有分析时间短、操作简便易行、重复性好、准确可靠以及成本低等优点。
3 结论
本研究表明,中低浓度蛋白含量(<60 mg/mL)的样品对吐温80含量检测结果几乎无干扰,而高浓度的单克隆抗体注射液,蛋白质的干扰是不能忽略的,因此消除蛋白对检测的干扰,提高高浓度蛋白含量样品的准确性,仍然是本方法需要关注和研究的内容。本研究针对HPLC-FLD法检测单克隆抗体注射液中吐温80含量进行了专属性、精密度、准确度、线性和范围、耐用性的验证,并采用不同的单抗注射液进行了该方法的适用性研究,证明该方法适用于中低浓度蛋白含量(<60 mg/mL)单克隆抗体注射液中吐温80含量的检测。
