UV-C照射与壳聚糖涂膜对鲜切淮山的保鲜效果
2021-03-02崔媛媛
刘 容,崔媛媛
(1.南宁学院机电与质量技术工程学院,广西 南宁 530200;2.广西大学轻工与食品工程学院,广西 南宁 530004)
淮山是营养价值很高的药食同源食品,集食用、药用、保健三大功能于一体,是国家卫生部公布的药食同源的蔬菜[1]。然而,淮山携带不便、清洗和去皮繁琐、食用处理过程中产生易导致过敏的黏液物质,影响了其消费。鲜切淮山因新鲜、方便、营养、100%可食率的特点,符合当前社会人们对饮食的要求,颇受消费者喜爱[2]。但经鲜切处理的淮山易褐变、贮藏期短,制约了鲜切淮山的发展。现有的低温、热处理、化学处理等方法存在效果不理想、化学保鲜剂残留等缺点,未能广泛使用。
短波紫外线(short-wave ultraviolet,UV-C)照射作为一种可杀菌的物理方法,成为一种简单、安全、经济的果蔬采后处理技术,被处理的产品无污染、无化学残留,符合绿色食品的要求,在食品保鲜中具有良好的应用前景[3-5]。大量研究表明,UV-C处理有利于保持梨类[6-8]、草莓[9]、蓝莓[10]、西兰花[11]等果蔬的采后品质,延长贮藏期。壳聚糖是甲壳素脱乙酰基后的产物,对人体安全,具有良好的成膜性和很强的杀菌能力,对多种常见的食物致病菌有较强的抑制作用。基于此,壳聚糖以其良好的保鲜特性也被广泛应用于果蔬的保鲜[12]。
本研究针对鲜切淮山的保鲜与贮藏问题,探索有效、安全、经济的保鲜方法处理鲜切淮山,将UV-C照射技术协同壳聚糖涂膜处理引入到鲜切淮山的保鲜中,分别研究两种处理方法及其协同处理的保鲜效果,为其他鲜切果蔬的贮藏提供借鉴。
1 材料与方法
1.1 材料与试剂
淮山产于广西南宁市邕宁区那楼镇。
壳聚糖(脱乙酰度92.2%) 南通兴成生物制品厂;芦丁、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(生化试剂,纯度均不小于98%) 上海源叶生物科技有限公司;菌落总数测试片 广州达元绿洲食品安全科技股份有限公司。所用其他试剂均为分析纯。
1.2 仪器与设备
UV-1100紫外-可见分光光度计 上海美谱达仪器有限公司;FE38-Standard电导率仪 瑞士梅特勒-托利多仪器有限公司;TUV G30 T8低压汞蒸汽紫外杀菌灯管飞利浦(中国)投资有限公司。
1.3 方法
1.3.1 鲜切淮山的制备
新鲜淮山(4.0 ℃冷藏)→清水洗净→去皮、去头、去尾→切分成厚度为5.0 mm薄片,待用。
1.3.2 鲜切淮山处理
分别对鲜切淮山进行UV-C照射、壳聚糖涂膜、UV-C照射与壳聚糖涂膜共同处理,以不做任何处理为对照,进行处理后用纸托盘和保鲜膜进行包装,放置于4 ℃冰箱中贮藏,于第0、3、6、9、12天检测相关生理指标。
UV-C照射光源:低压灯管长92 cm、直径2.8 cm、功率30 W、发射紫外波长253.7 nm。将灯管固定于无菌操作台,下方台面距离灯管中心的垂直距离为15 cm,用紫外照度计测得在该距离的短波紫外照射强度为0.828 mW/cm2。按照式(1)计算UV-C照射剂量,得到UV-C照射剂量为3.0 kJ/m2。
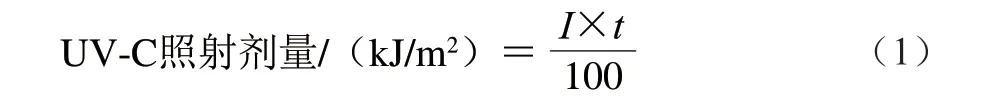
式中:I为UV-C照射强度/(mW/cm2);t为UV-C照射时间/s。
UV-C照射处理:鲜切淮山→UV-C灯管下方照射180 s→翻转,照射另一面180 s。
壳聚糖涂膜处理:鲜切淮山于10 g/L壳聚糖溶液浸泡2 min,捞出、沥干,其中10 g/L壳聚糖溶液制备:称取1.0 g壳聚糖置于100 mL的蒸馏水中,加入1.0 g柠檬酸、0.1 g抗坏血酸和0.1 g无水氯化钙,用磁力搅拌器搅拌20 min制得。
UV-C照射处理与壳聚糖涂膜协同处理:鲜切淮山于UV-C灯管下方照射180 s,翻转,照射另一面180 s,再于10 g/L壳聚糖溶液浸泡2 min,捞出、沥干。
1.3.3 指标测定
1.3.3.1 呼吸强度测定
采用静置法测定呼吸强度[13]。选取干燥广口瓶,加入20 mL 0.4 mol/L NaOH溶液,塞紧瓶塞,称取一定质量的鲜切淮山,放入网兜中,将网兜悬于广口瓶中,并塞紧瓶塞。每隔20 min匀速晃动广口瓶,避免溶液溅到网兜上。1 h之后,打开广口瓶塞,迅速取出鲜切淮山,向瓶中加入5 mL饱和BaCl2溶液和2~3 滴酚酞指示剂,并快速塞上瓶塞,充分摇晃2 min。用0.1 mol/L草酸溶液滴定,直到红色慢慢褪去为止。记下滴定所用草酸体积,呼吸强度以每千克鲜切淮山每小时产生的CO2质量计。按照同样方法,不加鲜切淮山样品进行空白组对照实验,按式(2)计算呼吸强度。

式中:m为鲜切淮山质量/kg;c为草酸浓度/(mol/L);t为测定的时间/h;V2为鲜切淮山消耗草酸的体积/mL;V1为空白对照组滴定消耗草酸的体积/mL。
1.3.3.2 菌落总数测定
采用菌落总数测试片测定菌落总数[14]。在无菌操作台上,称取鲜切淮山1.0 g,在研钵中研磨至匀浆,用已灭菌的生理盐水配制成100、10-1、10-2、10-3、10-4和10-5(m/V)6 个浓度梯度的样品稀释液。用移液枪分别吸取1.0 mL不同浓度的稀释液,均匀滴加至菌落总数测试片上,每个浓度稀释液做3 个平行。待微生物片上溶液凝固后,用自封袋将菌落总数测试片封装,放置于37.0 ℃的恒温培养箱中培养24 h。选择菌落数量(红色斑点)在10~100的测试片计数。
1.3.3.3 丙二醛含量测定
称取2.0 g鲜切淮山,加入10 mL 5 g/L的三氯乙酸,置于研钵中研磨至匀浆状,全部转移至离心管中,冷冻离心(4 ℃、10 000 r/min)20 min,取上清液放置冰箱中冷藏以备用。加入5.0 mL 0.67 g/L的硫代巴比妥酸溶液,100 ℃煮沸20 min后,冷却至室温,置于离心管中冷冻离心(4 ℃、5 000 r/min)10 min,取上清液,采用紫外-可见分光光度计于450、532 nm和600 nm波长处测吸光度。
1.3.3.4 多酚氧化酶活力测定
多酚氧化酶(polyphenol oxidase,PPO)粗提取液:称取鲜切淮山1.0 g置于研钵中,加入石英砂,再加入5 mL pH 6.8、0.1 mol/L的磷酸缓冲液(phosphate buffer,PB),在冰浴条件下研磨至匀浆状,全部转移到10 mL的离心管中冷冻离心(4 ℃、12 000 r/min)20 min,收集上清液于干净的试管中,放置于4 ℃的冰箱中保存。
PPO活力测定:用移液枪移取1.5 mL PB于试管中,加入1 mL 0.02 mol/L邻苯二酚溶液,在40 ℃的水浴锅中保温10 min。取出至室温中,加入1 mL PPO粗提取液,开始计时,将溶液混合后倒入比色皿中,采用紫外-可见分光光度计于410 nm波长处测吸光度。以蒸馏水为对比参照,每30 s记录A410nm,连续测定,记录10 个以上的A410nm。以每克鲜质量淮山每分钟吸光度变化1为一个酶活力单位(U),PPO活力具体计算见公式(3)。
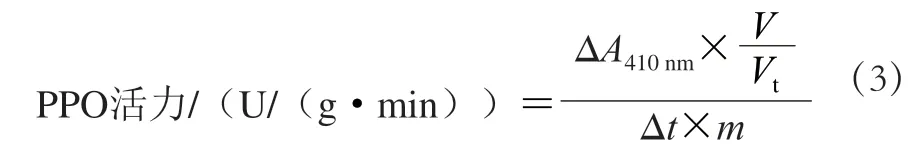
式中:ΔA410nm为反应时间内吸光度变化;V为PB提取液体积(5 mL);Vt为测定所用PPO粗提取液体积(1 mL);Δt为反应时间/min;m为鲜切淮山质量/g。
1.3.3.5 过氧化物酶活力测定
过氧化物酶(peroxidase,POD)粗提取液制备:称取鲜切淮山2.0 g置于研钵中,加入石英砂,再加入5 mL pH 6.0 0.1 mol/L PB,在冰浴条件下研磨至匀浆状,全部转移到10 mL的离心管中冷冻离心(4 ℃、12 000 r/min)20 min,收集上清液于干净的试管中,放置于4 ℃的冰箱中保存。
POD活力的测定:用移液枪移取2 mL 25 mmol/L愈创木酚溶液于试管中,加入1 mL POD提取液,再加入200 μL 0.5 mol/L H2O2,摇匀,同时开始计时,将溶液混合后倒入比色皿中,于470 nm波长处测吸光度。以蒸馏水为对比参照,每30 s记录下A470nm,连续测定,记录10 个以上的A410nm。以每克鲜质量淮山每分钟吸光度变化0.001为1 个酶活力单位(U),具体计算见公式(4)。

式中:ΔA470nm为反应时间内吸光度的变化;V为PB提取液的体积(5 mL);Vt为测定所用POD粗提取液的体积(1 mL);Δt为反应时间/min;m为鲜切淮山的质量/g。
1.3.3.6 总酚含量与类黄酮含量测定
总酚含量测定参照李晓博等[15]的方法,并稍作修改。称取1.0 g鲜切淮山置于研钵中,加入少量预冷的体积分数1%盐酸-甲醇溶液,在冰浴条件下研磨至匀浆状,转移到带刻度的试管中,定容至20.0 mL,放置4 ℃冰箱中避光提取20 min,每隔5 min摇晃一次,以提取充分。提取完毕后过滤,收集滤液,在280 nm波长处测定吸光度,以体积分数1%盐酸-甲醇溶液为参照调零,以没食子酸为标准品,得到标准曲线:y=6.85x+0.018 4,R2=0.997。类黄酮含量测定:类黄酮提取方法及芦丁标准曲线的制作方法同上,在波长325 nm波长处测定吸光度,得到线性回归方程为:y=5.78x+0.020 6,R2=0.986。
1.3.3.7 相对电导率测定
通过相对电导率来表征贮藏过程中鲜切淮山的细胞膜透性,其测定参照陆仙英等[16]的方法。用直径为1 cm的打孔器对鲜切淮山片打孔,并将其切成较薄且厚度均匀的圆片,取样10 g,置于250 mL烧杯中,加入50 mL超纯水,放入到真空干燥器中抽气渗透10 min,再放入恒温振荡器中振荡30 min。用电导率仪测定此时的电导率κ1/(S/m)。然后,再将样品煮沸10 min,冷却至室温后,再检测此时电导率κ2/(S/m)。相对电导率按照公式(5)计算。

1.3.3.8 DPPH自由基清除率测定
样品前处理与溶液配制:在室温条件下,称取5.0 g鲜切淮山于研钵中,研磨至匀浆状,加入25 mL、体积分数95%乙醇溶液混合均匀后,在50 ℃下超声30 min,离心20 min,取上清液用于测定DPPH自由基清除能力。准确称取22.0 mg DPPH,溶于体积分数95%乙醇溶液中,定容至250 mL,得到DPPH溶液。将得到的上清液与DPPH溶液置于冰箱中4℃保存。
DPPH自由基清除能力测定[17]:取2 mL上清液与2 mL DPPH溶液混合摇匀后避光孵育10 min。在517 nm波长处测定吸光度(AIi),对照组采用同体积95%乙醇溶液与DPPH溶液混合,其他操作步骤相同,记下吸光度(At)。采用95%乙醇溶液对分光光度计调零,DPPH自由基清除率按照公式(6)计算。
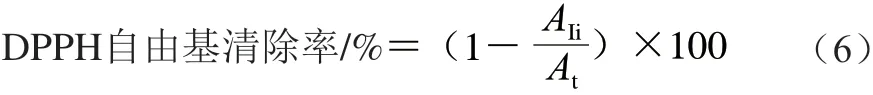
1.4 数据处理与分析
每组实验做3 次平行,实验数据以平均值±标准差表示。采用Origin 8.0软件作图。
2 结果与分析
2.1 UV-C照射与壳聚糖涂膜对鲜切淮山呼吸强度的影响
呼吸作用会消耗果蔬中的营养成分,加速果蔬的衰老,因此降低呼吸强度是延缓果蔬衰老、延长货架期的重要方法。果蔬组织细胞在采后仍会进行呼吸作用,呼吸作用消耗氧气,释放二氧化碳,膜内的二氧化碳不能完全释放出去,浓度就会增加,从而抑制组织细胞的呼吸作用[18]。不同处理对鲜切淮山呼吸作用的影响见图1,鲜切淮山在整个贮藏期间,呼吸强度呈先上升后下降的趋势,属于跃变型呼吸。新鲜淮山采摘后,还未完全成熟,当呼吸作用达到顶峰的时候,说明淮山已经成熟并且开始进入衰老期。10 g/L壳聚糖涂膜处理可以阻止氧气侵入细胞,从而有效降低淮山的呼吸强度;UV-C照射鲜切淮山,抑制了呼吸作用的相关酶活力,从而达到抑制呼吸强度的作用。总体上,协同处理组较单一方法处理组具有更低的呼吸强度,当鲜切淮山贮藏12 d,与对照组相比较,协同处理组、壳聚糖涂膜组、UV-C照射处理组的呼吸强度分别降低了23.6%、21.3%和15.7%。二者的协同作用对呼吸作用起到了双重抑制的作用,都有效推迟了呼吸高峰的出现,延缓了鲜切淮山的衰老。
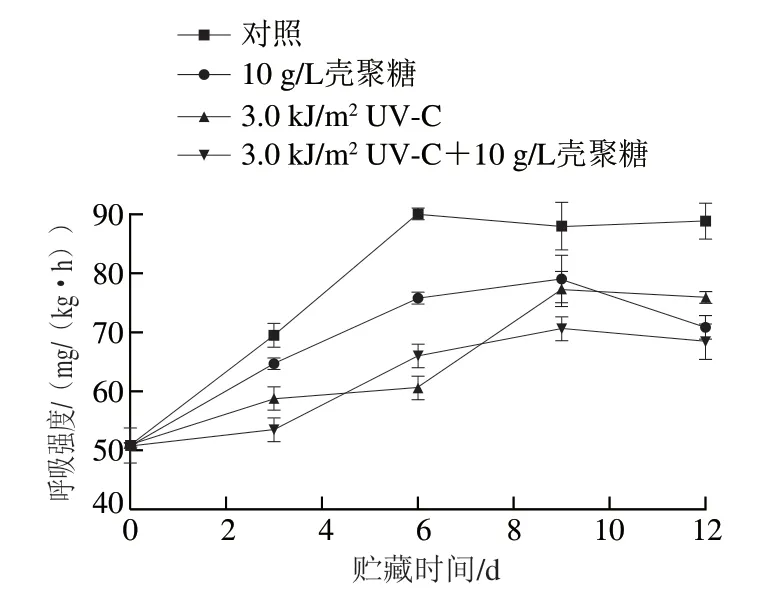
图1 不同处理对鲜切淮山呼吸作用的影响Fig.1 Effect of individual and combined treatments on respiration intensity of fresh-cut Chinese yam
2.2 UV-C照射与壳聚糖涂膜对鲜切淮山菌落总数的影响
鲜切淮山由于经过去皮和切分失去了重要的保护层,微生物侵入的机会大大增加,从组织中渗出的营养成分以及汁液促进了微生物的生长繁殖。可用菌落总数来判断鲜切淮山感染微生物的程度,随着暴露时间的延长,微生物不断繁殖,在贮藏期间,菌落总数会成倍增加。如图2所示,在鲜切淮山的整个贮藏期间,壳聚糖涂膜处理和UV-C处理都能有效抑制菌落总数。当鲜切淮山贮藏达到12 d,与对照组相比较,协同处理组、壳聚糖涂膜组、UV-C照射处理组的菌落总数分别降低了30.8%、18.5%和24.6%。其中UV-C照射处理比单独壳聚糖涂膜处理的效果更好一些,二者协同处理后菌落总数最小。UV-C照射鲜切果蔬,可能通过破坏微生物的DNA直接杀死微生物,同时,也会提升鲜切淮山自身的抗病性。壳聚糖本身是一种抑菌物质,涂膜形成一层保护膜,可减少微生物侵入,涂膜方式被证明比直接将抑菌物质注入鲜切果蔬内的抑菌效果更好[19]。Durango等使用质量分数1.5%壳聚糖涂膜鲜切胡萝卜有效抑制了大肠杆菌和乳酸菌数量[20]。
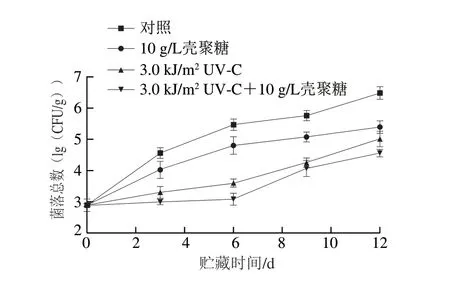
图2 不同处理对鲜切淮山菌落总数的影响Fig.2 Effect of individual and combined treatments on total microbial load of fresh-cut Chinese yam
2.3 UV-C照射与壳聚糖涂膜对鲜切淮山丙二醛含量的影响

图3 不同处理对鲜切淮山丙二醛含量的影响Fig.3 Effect of individual and combined treatments on malonaldehyde content of fresh-cut Chinese yam
丙二醛是细胞膜脂质过氧化的最终产物,它能与细胞中的多种物质发生反应,从而导致细胞中的膜系统以及酶系统发生严重损伤[21],因此丙二醛含量是衡量果蔬品质的一个重要指标。如图3所示,在鲜切淮山贮藏期间,丙二醛含量持续上升,且含量从高到低排序依次为:对照组>3 kJ/m2UV-C照射处理组>10 g/L壳聚糖涂膜组>协同处理组。随着贮藏时间延长,丙二醛含量增加速率加快,说明淮山的细胞膜破坏程度越来越大,细胞膜透性越来越高,后期淮山已经明显老化。实验表明,壳聚糖涂膜和UV-C照射处理能够有效抑制鲜切淮山中丙二醛累积,延缓鲜切淮山的老化腐败,延长贮藏时间。当鲜切淮山贮藏达到12 d,与对照组相比较,协同处理组、壳聚糖涂膜组、UV-C照射处理组的丙二醛含量分别降低了23.5%、17.8%和15.3%。
2.4 UV-C照射与壳聚糖涂膜对鲜切淮山PPO活力的影响
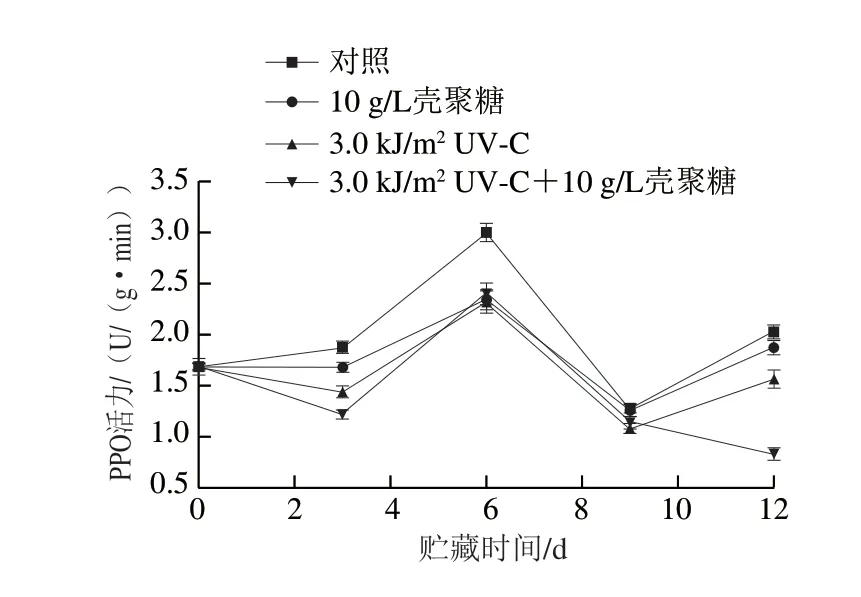
图4 不同处理对鲜切淮山PPO活力的影响Fig.4 Effect of individual and combined treatments on polyphenol oxidase activity of fresh-cut Chinese yam
PPO是果蔬中引起褐变的主要的酶类,它能催化氧气与果蔬中多酚类物质结合,形成醌类物质,醌类物质发生聚合形成褐色沉积物,即为果蔬褐变,因此PPO活力直接影响着果蔬感官品质。果蔬细胞中完整的酶系统会将内源性的酚类底物与PPO分为不同的区域。当果蔬受到外界机械性损伤后,膜系统遭到破坏,酚类底物与PPO之间不再有区域隔离,就会发生严重褐变反应。如图4所示,在整个贮藏期间,PPO活力先急剧上升,这是由于细胞中的膜系统受到破坏,底物与酶发生区域化接触,导致大量的褐变反应。在贮藏6 d时达到峰值,此后PPO活力快速下降。在贮藏3 d时,不同处理组PPO的活力有明显差异,但在贮藏6 d时,对照组PPO活力最高,3 种处理方法对鲜切淮山中PPO活力的抑制作用没有明显差异,这可能是鲜切淮山的其他生理指标协同作用的结果[22-24]。当鲜切淮山贮藏达到12 d,与对照组相比较,协同处理组、壳聚糖涂膜组、UV-C照射处理组的PPO活力分别降低了61.4%、15.3%和24.8%。总体上,UV-C照射和壳聚糖涂膜处理都在一定程度上抑制了PPO的活力,其中UV-C照射处理的作用大于壳聚糖涂膜,两者结合时抑制效果最明显。
2.5 UV-C照射与壳聚糖涂膜对鲜切淮山POD活力的影响
POD在老化组织中的活力较高,在新鲜组织中的活力较低。通常POD与PPO活力具有一定的相关性[25]。POD活力可以反映组织中的氧化应激程度。当植物组织受到压迫、机械损伤时会使POD活力激增。在植物组织褐变中,PPO起到增强褐变的作用。POD可以清除过氧化物,延缓组织的衰老,其活力升高是果蔬老化的一种标志。当过氧化氢含量很低时,POD作用不明显[22,26]。如图5所示,当淮山鲜切被处理后,组织发生氧化应激,POD活力升高。对照组和壳聚糖涂膜处理组都有明显的活力高峰,壳聚糖涂膜处理的峰值低于对照组,说明壳聚糖处理抑制了POD活力。当鲜切淮山贮藏达到12 d,与对照组相比较,协同处理组、壳聚糖涂膜组、UV-C照射处理组的POD活力分别降低了81.1%、38.5%和71.3%。UV-C照射处理和二者协同处理没有明显的峰值,说明这两种处理方式有效延缓了鲜切淮山的衰老,壳聚糖涂膜和UV-C照射协同处理的效果最佳。

图5 不同处理对鲜切淮山POD活力的影响Fig.5 Effect of individual and combined treatments on peroxidase activity of Chinese yam
2.6 UV-C照射与壳聚糖涂膜对鲜切淮山总酚与类黄酮含量的影响
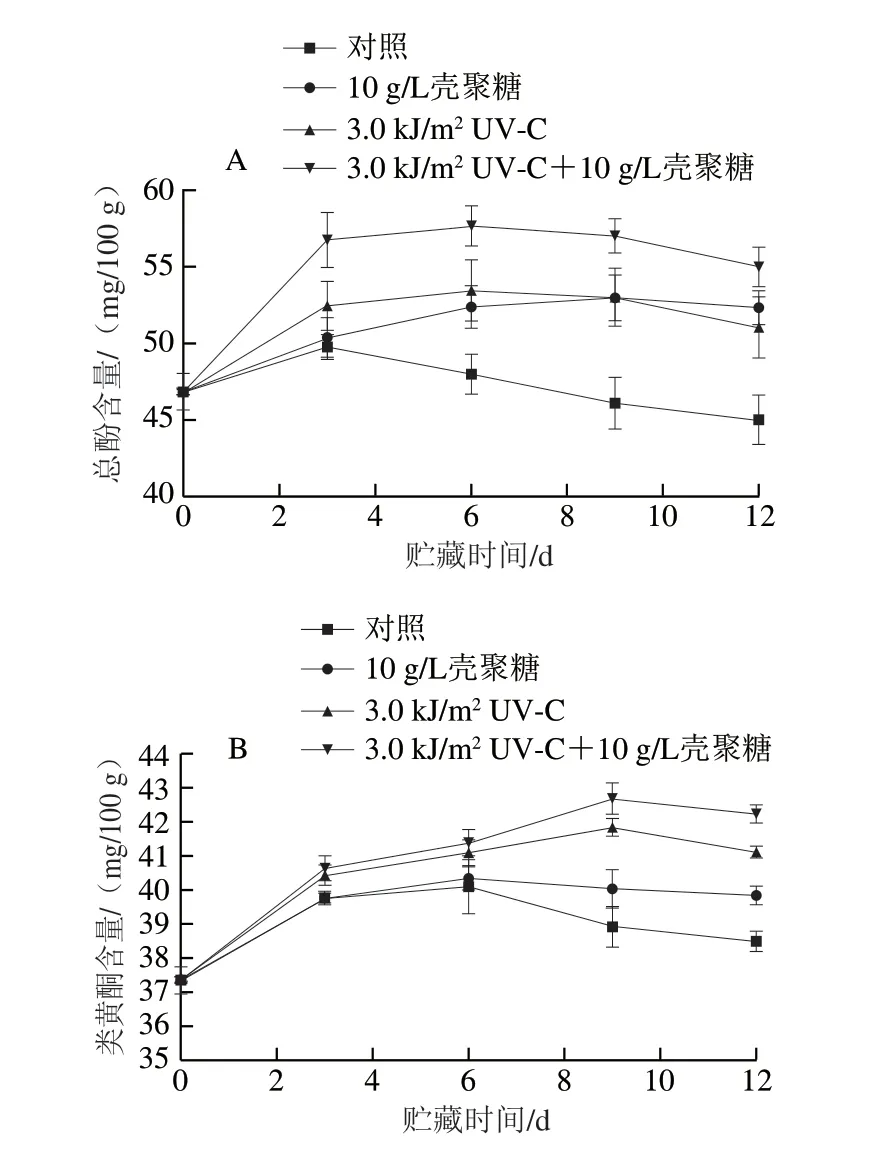
图6 不同处理对鲜切淮山总酚(A)和类黄酮(B)含量的影响Fig.6 Effect of individual and combined treatments on total phenol (A)and flavonoid (B) contents of fresh-cut Chinese yam
鲜切处理对果蔬中的多酚类有一定的诱导作用[27]。酚类物质是重要的次生代谢产物,是植物组织抗逆性和抗病性产物。由图6可知,总酚含量与类黄酮含量均呈现先上升后下降的趋势,这主要是鲜切处理导致的应激反应。当鲜切淮山贮藏达到12 d,与对照组相比较,协同处理组、壳聚糖涂膜组、UV-C照射处理组的总酚含量分别增加了22.2%、16.7%和13.3%,类黄酮含量分别增加了9.9%、3.4%和6.5%。两种处理方式都能使鲜切淮山的总酚和类黄酮保持较高的含量,且贮藏过程中基本上都呈现出UV-C照射作用高于壳聚糖涂膜处理。这可能是由于UV-C处理增强了鲜切淮山苯丙氨酸解氨酶的活性[23],这种酶能促进酚类物质和类黄酮物质的生成,从而延缓氧化损伤[23,28]。酚类物质含量在贮藏后期下降,可能是由于细胞膜损伤增强,酚类物质氧化速率大于合成速率[23,28]。类黄酮含量在贮藏后期呈下降趋势,可能是淮山中微生物发酵产生乳酸,导致pH值下降,抑制了类黄酮的合成。
2.7 UV-C照射与壳聚糖涂膜对鲜切淮山细胞膜透性的影响

图7 不同处理对鲜切淮山细胞膜透性的影响Fig.7 Effect of individual and combined treatments on cell memberane permeability of fresh-cut Chinese yam
细胞膜是一种选择透过性膜,对维持细胞内的新陈代谢有重要作用。当果蔬受到机械损伤或者化学伤害时,细胞膜就会遭到破坏,使膜透性增加,发生电解质外泄,导致膜相对电导率升高。因此相对电导率可以作为评判细胞膜透性的一个指标。由图7可知,在整个贮藏期间,细胞膜透性在不断升高。壳聚糖涂膜处理组细胞膜透性低于对照组。一方面,壳聚糖具有抑菌作用,降低了微生物对组织细胞的侵害,降低了细胞膜破损;另一方面,壳聚糖能有效抑制呼吸作用,同时能阻止外界氧气接触组织细胞,降低了细胞膜的脂过氧化。虽然在UV-C照射组贮藏的前期和中期,细胞膜透性与对照组没有明显差异,但贮藏后期,细胞膜透性稍微低于对照组。说明UV-C照射对细胞膜透性的影响并不大。两者协同处理后,在贮藏初期,鲜切淮山的细胞膜透性高于10 g/L壳聚糖涂膜处理组,在贮藏后期,细胞膜透性低于10 g/L壳聚糖涂膜处理组,两者协同处理在一定程度上减轻了呼吸作用、氧化作用等对细胞膜的损伤。当鲜切淮山贮藏达到12 d,与对照组相比较,协同处理组、壳聚糖涂膜组、UV-C照射处理组的细胞膜透性分别降低了15.7%、7.4%和6.9%。
2.8 UV-C照射与壳聚糖涂膜对鲜切淮山DPPH自由基清除率的影响

图8 不同处理对鲜切淮山DPPH自由基清除率的影响Fig.8 Effect of individual and combined treatments on DPPH radical scavenging activity of fresh-cut Chinese yam
酚类物质含量与抗氧化能力有一定的相关性[29]。姜爱丽等[24]研究发现,各种方式的鲜切都会导致山药中总酚、类黄酮等还原性物质含量下降,而不进行鲜切的山药抗氧化性以及相关的抗氧化酶含量都相对稳定。DPPH自由基清除率能反映抗氧化能力。由图8可以看出,在贮藏期间,鲜切淮山的DPPH自由基清除率呈先上升后下降的趋势。3 种不同方式处理后鲜切淮山的DPPH自由基清除率都明显高于对照组。当鲜切淮山贮藏达到12 d,与对照组相比较,协同处理组、壳聚糖涂膜组、UV-C照射处理组的DPPH自由基清除率分别提高了20.2%、9.6%和17.5%,显然各组DPPH自由基清除率从高到低依次为:10 g/L壳聚糖处理组<3.0 kJ/m2UV-C照射组<协同处理组。高梵[28]和陈晨[30]等研究也发现,UV-C照射处理能够增强鲜切胡萝卜的抗氧化性。可以推断,UV-C照射与壳聚糖涂膜处理过的鲜切淮山对DPPH自由基清除率的提高是由于总酚类物质和类黄酮等物质的增加。
2.9 鲜切淮山生理指标的相关性分析结果
鲜切淮山贮藏过程中的主要生理指标存在一定的代谢关系,对上述鲜切淮山生理指标进行了相关性分析。丙二醛是细胞膜脂氧化的最终产物,丙二醛的积累量代表细胞膜被氧化破坏的程度。当细胞膜发生破坏时,电解质就会外渗,电导率升高,即细胞膜透性增大,两者可能存在相关性。经过相关性分析可知,丙二醛含量与细胞膜透性的相关系数(r)为0.946,呈显著相关(P=0.015<0.05)。总酚与类黄酮是果蔬细胞的次生代谢产物,都是组织抗病性和抗逆性产物,苯丙氨酸解氨酶能同时促进二者的合成。经过相关性分析可知,总酚含量与类黄酮含量的相关系数为0.882,呈显著相关(P=0.048<0.05)。总酚和类黄酮物质都具有清除自由基的能力,二者的含量还存在显著的相关性。通过对两者的含量与DPPH自由基清除率进行相关性分析,发现总酚含量与DPPH自由基清除率的相关系数为0.935,两者之间存在显著相关性(P=0.02<0.05);类黄酮含量与DPPH自由基清除率的相关系数为0.742,两者总体趋势有一致性,但不存在显著的相关性(P=0.151>0.05)。
3 结 论
通过对鲜切淮山主要生理指标的研究,探究鲜切淮山贮藏过程中UV-C照射或(和)壳聚糖涂膜对其保鲜效果与机理。淮山在经去皮、切分处理后,失去表皮保护,组织细胞受到损伤,生理代谢受到影响。3.0 kJ/m2的UV-C处理鲜切淮山,一方面明显抑制细菌的繁殖;另一方面主要通过提高鲜切淮山中苯丙烷类代谢关键酶活性来促进酚类物质和类黄酮类物质的积累,增强鲜切淮山的抗氧化能力,抑制氧化损伤,提升保鲜效果。质量浓度10 g/L壳聚糖涂膜鲜切淮山,除了抑菌以外,主要通过抑制呼吸作用降低细胞膜的通透性,降低PPO与POD活力,从而降低细胞膜脂的过氧化而延长保鲜时间。两种处理方法的保鲜机理存在差别,二者共同处理时可从不同角度发挥各自保鲜效果。当鲜切淮山贮藏达到12 d时,与对照组相比较,UV-C照射、壳聚糖涂膜、协同处理能够使呼吸强度分别降低15.7%、21.3%、23.6%,菌落总数分别降低24.6%、18.5%、30.8%,丙二醛含量分别降低15.3%、17.8%、23.5%,PPO活力分别降低24.8%、15.3%、61.4%,POD活力分别降低71.3%、38.5%、81.1%,总酚含量分别增加13.3%、16.7%、22.2%,类黄酮含量分别增加6.5%、3.4%、9.9%,细胞膜透性分别降低6.9%、7.4%、15.7%,DPPH自由基清除率分别提高17.5%、9.6%、20.2%。因此两者协同该处理比单独一种方法处理更有利于鲜切淮山的保鲜和贮藏。
