ThF4浓度对CeF3-ThF4-LiCl-KCl熔盐中Th电解沉积的影响
2021-03-02王先彬朱铁建郑海洋佘长锋李晴暖
王先彬,蒋 锋,朱铁建,郑海洋,佘长锋,黄 卫,*,李晴暖,*
1.中国科学院 上海应用物理研究所,上海 201800;2.中国科学院大学,北京 100049
熔盐堆由于使用液态燃料而具有便于进行燃料处理的特性,这使其非常适合钍资源的核能利用[1]。在钍基熔盐堆(TMSR)的闭式燃料循环方案中,乏燃料中钍的分离回收是不可获缺的环节之一,这不仅有利于钍资源的循环使用和提高利用率,而且也将使得反应堆乏燃料的废物量大大减少,符合“废物最小化”原则[2]。
在TMSR的燃料处理流程中,首先将通过氟化挥发和减压蒸馏两种处理技术分离回收燃料盐中的铀和7LiF-BeF2载体盐,而钍则与绝大部分裂变产物共存在蒸馏尾料中[3]。因此,钍与裂变产物的分离是燃料盐中钍分离回收的关键问题。但是,由于蒸馏尾料中的氟化钍和裂变产物的氟化物均难溶于水,传统的水法处理技术难以直接在此使用。因此,直接在熔盐相中采用电化学方法分离钍和裂变产物将是一种不错的选择[4]。
在熔盐中采用电化学方法处理乏燃料已有几十年的历史,一般采用氯化物熔盐作为电解质体系[5]。本课题组在前期工作中也对氟化钍和稀土氟化物在LiCl-KCl中的溶解和电化学行为开展了研究,并通过电解的方法初步实现了稀土与钍的分离以及钍的提取[6-8]。在电化学处理过程中,一方面需要通过连续加料的方式将燃料盐的蒸馏尾料溶解进入氯盐电解质中,以确保电解过程的稳定进行;另一方面,考虑到能耗、熔盐用量、操作空间和放射性废物最小化等问题,要求单位体积的氯盐电解质中能够处理尽可能多的乏燃料,这就需要尽可能的提高熔盐中的氟化钍浓度。因此,本工作拟研究较高ThF4浓度下的CeF3-ThF4-LiCl-KCl熔盐中Th的电解沉积行为,以此考察高浓度ThF4对LiCl-KCl熔盐中Th电解分离效果的影响。
1 实验部分
1.1 试剂和仪器
实验用的LiCl、KCl、CeF3均购自Sigma-Aldrich公司,纯度为99.99%。ThF4由中国科学院长春应用化学研究所提供,纯度为99.999%,使用前在200 ℃下干燥20 h。工作电极(WE)为Mo丝(φ1.5 mm和φ1.0 mm),纯度99.99%,Alfa-Aesar公司;对电极(CE)为石墨棒(φ3 mm×50 mm),光谱纯,烟台美尔森石墨有限公司;参比电极(RE)为自制的Ag/AgCl(x=5%)-LiCl-KCl参比电极[9]。作为熔盐容器的刚玉坩埚(内径74 mm,高82 mm)购自国药集团化学试剂有限公司。
Optima 8000型电感耦合等离子体原子发射光谱仪(ICP-AES),美国Perkin Elmer公司;X’Pert Pro MPD型X 射线衍射仪(XRD),荷兰PANalytical公司。
1.2 CeF3-ThF4-LiCl-KCl四元熔盐的制备
所有的实验均在一个与氩气手套箱连接的自制电炉内进行,炉内的最高温度可达1 000 ℃[10]。
通过混合特定比例(摩尔比为59∶41)的LiCl和KCl粉末制备LiCl-KCl共晶盐。将混合粉末放置在刚玉坩埚内并置入炉膛。密封炉膛,升温至573 K,在该温度下对炉膛进行抽真空和充氩气处理。重复数次抽/充氩气操作,以除去微量水分。然后加热至773 K,并保温过夜,使共晶盐充分混合。最后将制备的共晶熔盐缓慢冷却至室温。
称取一定量经预处理的ThF4粉末,加入到盛有LiCl-KCl共晶熔盐的刚玉坩埚内,使用上述相同方法处理混合物用来制备不同浓度的ThF4-LiCl-KCl熔盐,自然冷却后研磨成粉末。向ThF4-LiCl-KCl熔盐中加入一定比例的CeF3粉末,使CeF3的质量分数为0.3%,混合均匀后转移至刚玉坩埚内,将其放入电炉后升温至573 K,保温2 h,以除去微量水分,然后加热至773 K,保温12 h后对熔盐进行电化学性质测量或电解沉积实验。
1.3 Th(Ⅳ)和Ce(Ⅲ)的电化学行为研究
所有电化学测试均使用石墨为对电极,Mo丝为工作电极,Ag/AgCl作参比电极。将电极插入到熔盐中,保持工作电极的插入深度为5~8 mm。使用AUTOLAB PGSSTAT 302N电化学工作站进行实验,使用的软件为Nova 1.9。使用循环伏安法(CV)进行电化学参数测试。
1.4 CeF3-ThF4-LiCl-KCl熔盐体系中Th的电解沉积
采用脉冲电位电解方法[6]在CeF3-ThF4-LiCl-KCl体系中进行Th的电解沉积实验。每个脉冲电解过程包含四个阶段:(1) 在阴极施加一个比Th(Ⅳ)沉积电位更负的电位(但正于Ce(Ⅲ)的沉积电位),在较短的时间内使电活性物质在电极表面局部聚集;(2) 在阴极施加略负于Th(Ⅳ)析出电位的沉积电位,进行Th的沉积;(3) 在阴极施加一个略正的电压,使沉积在阴极的部分活性析出物重新溶解;(4) 施加一个稳定电位,尽可能减少电极与熔盐本体之间Th的析出和溶解。
电解前后熔盐中Th和Ce的浓度采用电感耦合等离子体原子发射光谱分析,电解产物采用X 射线衍射仪表征。
2 结果与讨论
2.1 CeF3-ThF4-LiCl-KCl熔盐体系中Th(Ⅳ)和Ce(Ⅲ)的电化学行为
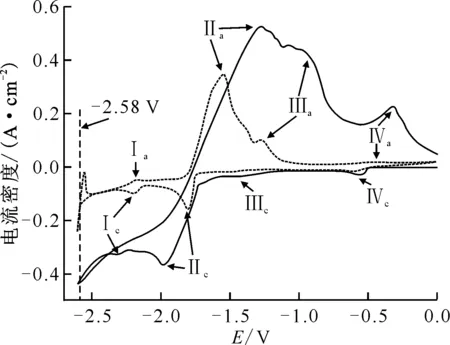
扫描速率为100 mV/s,电极面积为0.35 cm2,对电极:石墨棒(φ3.0 mm),参比电极:Ag/AgCl(x=5%)-- ——0.3%CeF3-10%ThF4-LiCl-KCl, ——0.3%CeF3-3%ThF4-LiCl-KCl图1 773 K下CeF3-ThF4-LiCl-KCl熔盐在Mo电极上的循环伏安图Fig.1 Cyclic voltammograms of CeF3-ThF4-LiCl-KCl molten salt system at 773 K
773 K下CeF3-ThF4-LiCl-KCl熔盐在0~-2.60 V范围内的CV曲线示于图1。由图1可知:在0.3%(质量分数,下同)CeF3-3%ThF4-LiCl-KCl熔盐体系中,除-2.58 V处的熔盐电化学窗口的氧化还原峰外,依次出现四对较为明显的氧化还原峰Ⅳc/Ⅳa、Ⅲc/Ⅲa、Ⅱc/Ⅱa和Ⅰc/Ⅰa。其中Ⅰc/Ⅰa和Ⅱc/Ⅱa分别对应Ce(Ⅲ) 和Th(Ⅳ)在电极上的还原/氧化,峰电位基本与三元体系一致。Ⅳc/Ⅳa可能是熔盐中杂质离子(例如金属铜的电极接口和导线的腐蚀产物)的氧化还原峰,相应的Ⅲc/Ⅲa则可能来自于Th和Cu的共还原沉积和氧化[6-8,11-12]。
与3%ThF4的熔盐体系CV曲线比较,10%ThF4的熔盐体系有明显差异:1) 碱金属离子的还原析出电位显示不明显,观察不到熔盐的电化学窗口;2) Th(Ⅳ)的初始还原电位略微正移(从-1.75 V正移至-1.72 V,如表1所示),还原峰电流和氧化峰电流增大,峰的宽度增大;3) Ce(Ⅲ)/Ce的信号弱,观察不到它的氧化还原峰;4) 杂质峰依然存在。这些变化可能是氯盐中Th(Ⅳ)和F-浓度的增大造成的。一方面,根据Nernst方程,随着Th(Ⅳ)浓度的增大,其初始还原电位会随之正移;另一方面,F-浓度的增大会引起Th(Ⅳ)周围的熔盐环境发生变化,由于F-的强络合作用,与Th(Ⅳ)形成稳定的大团簇络合物[11],这种大团簇络合物的形成会造成自由Th(Ⅳ)的浓度减少,导致Th(Ⅳ)的初始还原电位负移[6-7]。由于体系中Th(Ⅳ)与F-的比例是按照ThF4的化学计量比增加,Th-F络合对自由Th(Ⅳ)浓度的影响效果低于ThF4的引入,因此这两方面的作用综合在一起,最终造成Th(Ⅳ)初始还原电位略微正移。此外,在高浓度下,电极表面初始Th(Ⅳ)浓度增大,导致无论是Th(Ⅳ)的还原峰电流还是其对应的氧化峰电流都增大,峰的宽度也相应增大,甚至部分掩盖了Ce(Ⅲ)/Ce的信号。而熔盐电化学窗口的缺失,可能是高浓度的Th4+在熔盐中形成了较为稳定的LiTh2F9络合物结构,熔盐结构的变化使得Li+的活度下降、还原峰负移,最终超出扫描电位的范围。
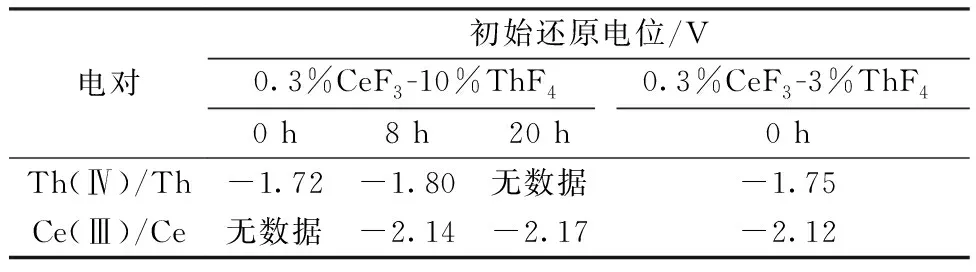
表1 电解不同阶段CeF3-ThF4-LiCl-KCl熔盐中Th(Ⅳ)和Ce(Ⅲ)的初始还原电位Table 1 Onset reduction potential of Th(Ⅳ) and Ce(Ⅲ) in CeF3-ThF4-LiCl-KCl molten salt before and after electrolysis
2.2 电解与电解过程监测
根据从CeF3-ThF4-LiCl-KCl熔盐体系的CV曲线中获取的信息,为避免Ce(Ⅲ)和Th(Ⅳ)在电解时共同还原导致电解产物中Th与Ce的分离系数降低,采用脉冲电解方法(图2)对熔盐体系进行电解;同时在电解过程中应用CV法对熔盐中Th(Ⅳ)和Ce(Ⅲ)的浓度进行初步监测,判断电解进程。

图2 CeF3-ThF4-LiCl-KCl熔盐体系脉冲电位电解参数设置Fig.2 Parameters applied during pulse potential electrodeposition in CeF3-ThF4-LiCl-KCl molten salt system
脉冲电解电位设置:脉冲周期为60 s;脉冲电解的四个阶段(离子富集、电解沉积、不稳定物溶解和熔盐体系静置)的电位分别为-2.00 V、-1.90 V、-1.60 V和-1.70 V,如图2所示。离子富集和电解沉积电位设定介于Ce(Ⅲ)和Th(Ⅳ)的还原电位之间,避免Ce(Ⅲ)的析出;溶解阶段的电位为-1.60 V,略正于Th(Ⅳ)的沉积电位,将电极表面沉积相中疏松层溶解到熔盐中;熔盐静置阶段的电位为-1.70 V,接近Th(Ⅳ)/Th电对的平衡电位,该电位下Th(Ⅳ)沉积和金属Th的溶解达到平衡,熔盐体系处于稳定状态。
773 K时CeF3-ThF4-LiCl-KCl(0.3%CeF3-10%ThF4)熔盐体系电解前后的CV曲线示于图3。由图3可知:随着电解的进行,0.3%CeF3-10%ThF4-LiCl-KCl熔盐体系的CV图中Th4+氧化还原峰信号逐渐减弱;与此同时,Ce(Ⅲ)的氧化还原峰信号逐渐清晰,并且可以清晰地观察到熔盐的电化学窗口。电解进行到 8 h时,Th(Ⅳ)的还原峰强度和位置与图1中0.3%CeF3-3%ThF4-LiCl-KCl熔盐体系的结果相似;这个结果与表2中ICP-AES的分析结果相吻合,此时熔盐中Th(Ⅳ)的浓度为9.96×10-2mol/kg,与3%ThF4的熔盐体系接近(7.89×10-2mol/kg)。但是随着电解的进行,Th(Ⅳ)/Th的初始还原电位不断负移(表1)。10%ThF4熔盐体系中,电解8 h后Th(Ⅳ)的初始还原电位负移0.08 V(-1.72 V vs. -1.80 V);而相比具有相似Th(Ⅳ)浓度的3%ThF4熔盐体系,Th(Ⅳ)的初始还原电位也负移了0.05 V(-1.75 V vs. -1.80 V)。导致这个现象的原因可能有两个:一方面,随着Th(Ⅳ)在阴极上沉积,熔盐中Th(Ⅳ)的浓度不断减少;另一方面,由于Cl-在石墨阳极上的氧化电位较低,因而在电解时先于F-被氧化,这使得熔盐中F-浓度不变,导致熔盐中自由的Th(Ⅳ)浓度进一步降低。这两个因素的共同作用使得熔盐中Th(Ⅳ)的活度降低,促使Th(Ⅳ)/Th的还原电位不断负移。
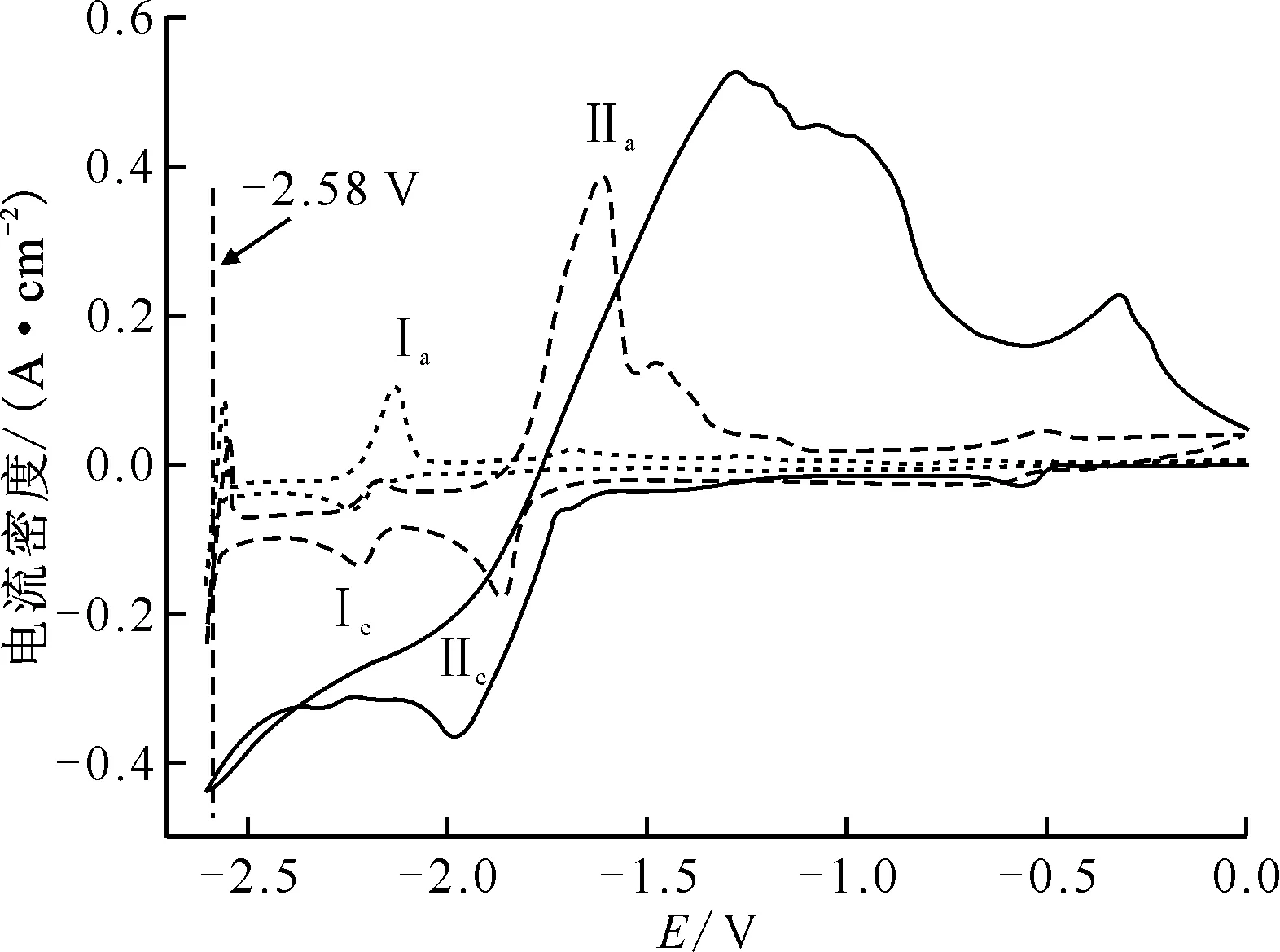
扫描速率为100 mV/s,电极面积为0.35 cm2,对电极:石墨棒(φ3.0 mm),参比电极:Ag/AgCl(x=5%)-- ——电解前,---- ——电解8 h, ——电解20 h图3 773 K时CeF3-ThF4-LiCl-KCl(0.3%CeF3-10%ThF4)熔盐体系电解前后的CV曲线Fig.3 Cyclic voltammograms of CeF3-ThF4-LiCl-KCl(0.3%CeF3-10%ThF4) molten salt system at 773 K
电解进行20 h后,整个电化学窗口内只能观测到Ce(Ⅲ)的信号,可以判断熔盐中绝大部分Th(Ⅳ)已被还原沉积在Mo阴极上。表1的电位数据显示,随着电解的进行,Ce(Ⅲ)/Ce的初始还原电位也发生了负移。0.3%CeF3-10%ThF4的熔盐电解8 h时后与0.3%CeF3-3%ThF4的熔盐这两个体系中,Ce(Ⅲ)/Ce的初始还原电位分别为-2.14 V和-2.12 V。此时两者的Ce(Ⅲ)和Th(Ⅳ)浓度均相近,而前者F-浓度远高于后者;0.3%CeF3-10%ThF4的熔盐电解8 h和20 h后,两个体系的Ce(Ⅲ)/Ce的初始还原电位分别为-2.14 V和-2.17 V。此时两者的Ce(Ⅲ)和F-浓度相近,而前者的Th(Ⅳ)浓度远高于后者。对这两种情形的结果比较显示,当c(F-)/c(Ce(Ⅲ))比值增加或竞争络合F-的阳离子(Th4+)浓度降低时,均会导致熔盐中Ce(Ⅲ)的活度降低,促使Ce(Ⅲ)/Ce的还原电位不断负移。这些结果进一步说明,LiCl-KCl熔盐中F-的存在会同时促使Th(Ⅳ)和Ce(Ⅲ)的还原电位负移,F-浓度越大,影响越明显。
通过ICP-AES对电解不同时间的0.3%CeF3-10%ThF4熔盐中的Th(Ⅳ)和Ce(Ⅲ)浓度进行分析,结果列入表2。根据表2数据计算,电解20 h后Th的分离率可达99.7%,而电解前后熔盐中Ce(Ⅲ)的浓度保持不变。这个结果表明,通过电解可以从LiCl-KCl熔盐中有效分离ThF4,同时使得CeF3滞留在熔盐中。
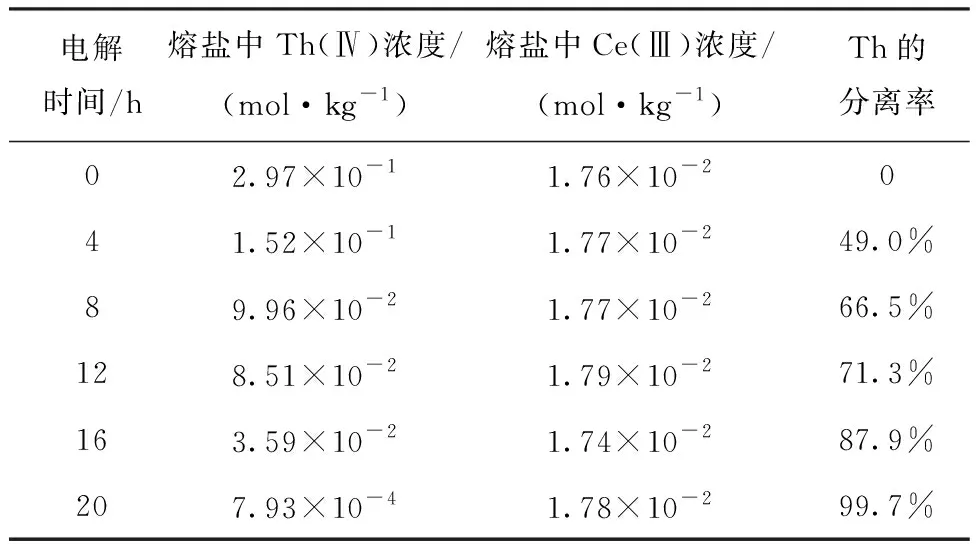
表2 电解不同时间的CeF3-ThF4-LiCl-KCl(0.3%CeF3-10%ThF4)熔盐中Th(Ⅳ)和Ce(Ⅲ)的浓度变化及Th的分离率Table 2 Concentration of Th(Ⅳ) and Ce(Ⅲ)in CeF3-ThF4-LiCl-KCl (0.3%CeF3-10%ThF4) molten salt before and after electrolysis and separation ratio of thorium
2.3 电解产物的表征
CeF3-ThF4-LiCl-KCl(0.3%CeF3-10%ThF4)熔盐体系电解沉积物的XRD谱图示于图4。由图4可知:除了防止样品吸潮的聚合物包覆膜以外,沉积物信号显示电解产物主要由LiCl和KCl熔盐以及电解还原产物Th组成。LiCl和KCl熔盐来自于氯盐电解质在固态电解产物上的附着和夹带,可以通过后续的蒸馏处理过程将其与钍电解产物分离[7]。

●——Th,*——LiCl,○——KCl,◇——密封薄膜图4 773 K下CeF3-ThF4-LiCl-KCl(0.3%CeF3-10%ThF4)熔盐体系电解后Mo电极上的阴极产物XRD谱图Fig.4 XRD pattern of cathodic deposit obtained from CeF3-ThF4-LiCl-KCl(0.3%CeF3-10%ThF4) molten salt on molybdenum electrode at 773 K
2.4 Th(Ⅳ)浓度对电解速率的影响
ThF4质量分数分别为3%和10%的两种CeF3-ThF4-LiCl-KCl熔盐体系在不同电解时间段的Th(Ⅳ)浓度、阴极Th累计沉积量和Th(Ⅳ)电解速率结果列入表3。这两种熔盐体系中Th(Ⅳ)的电解速率随体系Th(Ⅳ)浓度(bTh)的变化示于图5。从表3和图5的数据可以看出:
(1) 整体来看,随着电解时间的延长,Th在阴极上的沉积质量(表3)逐渐增大,延长电解时间可以提高Th的分离率。
(2) Th(Ⅳ)浓度影响其电解速率。10%ThF4体系中Th的初始电解速率明显高于3%ThF4体系;随着熔盐中Th(Ⅳ)浓度不断减小,其电解速率(图5虚线)呈下降趋势。这个结果表明,熔盐中Th(Ⅳ)浓度是影响Th电解速率的重要因素:离子浓度越大,电解沉积效率越高。反过来说,离子浓度越低,电解沉积效率越低。结合结果(1),说明低浓度时降低同样的离子浓度差需要的电解时间将延长。因此,需要平衡电解分离率和电解效率,通过工艺优化来确定合理的技术指标和工艺参数。
(3) F-浓度对电解速率存在明显影响。LiCl-KCl熔盐中ThF4含量的增加不仅会增加Th(Ⅳ)浓度,同时也增加了F-浓度。由于氧化电位的差异,在电解过程中F-不会在阳极上被氧化而从熔盐中析出,因此F-/Th(Ⅳ)的离子浓度比一直在增加,这使得相同Th4+浓度下电解速率出现变化。10%ThF4体系电解8 h时Th(Ⅳ)浓度(9.96×10-2mol/kg)与3%ThF4体系的初始浓度(7.92×10-2mol/kg)较为接近,但是前者从第8 h到12 h的4 h内平均电解速率为0.675 g/h,而后者相应的4 h内平均电解速率为0.886 g/h;10%ThF4体系电解16 h时Th(Ⅳ)浓度(3.59×10-2mol/kg)与3%ThF4体系电解2 h时(3.98×10-2mol/kg)接近,但是前者从第16 h到20 h的4 h内平均电解速率为0.160 g/h,而后者相应的4 h内平均电解速率为0.471 g/h。这些数据显示,在Th(Ⅳ)浓度相近时,初始ThF4浓度为10%的熔盐体系中Th的平均电解速率明显小于3%的熔盐体系(图5)。考虑到上述电解阶段内10%ThF4体系和3%ThF4体系中Th(Ⅳ)、Ce(Ⅲ)浓度相近,仅F-的浓度相差较大,因此引起电解速率不同的原因极有可能是熔盐中F-/Th(Ⅳ)的比例差异。以上结果表明,熔盐中F-浓度也是影响Th电解速率的因素之一,在Th(Ⅳ)浓度相同的情况下,F-浓度越大,电解速率越低。
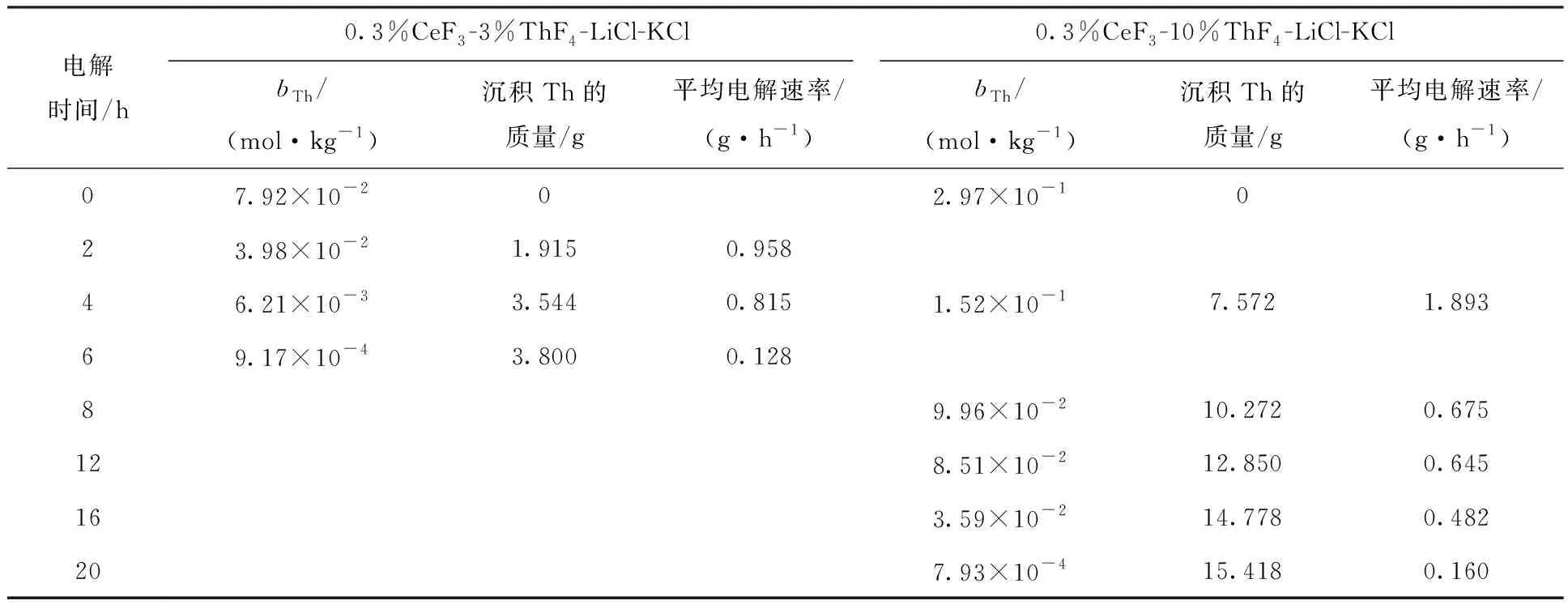
表3 CeF3-ThF4-LiCl-KCl熔盐体系电解过程中的Th浓度、阴极Th累计沉积量和不同电解阶段的平均电解速率Table 3 Molality of thorium in, total deposit mass of thorium from and average electrolytic rate of thorium from CeF3-ThF4-LiCl-KCl molten salt during electrolysis
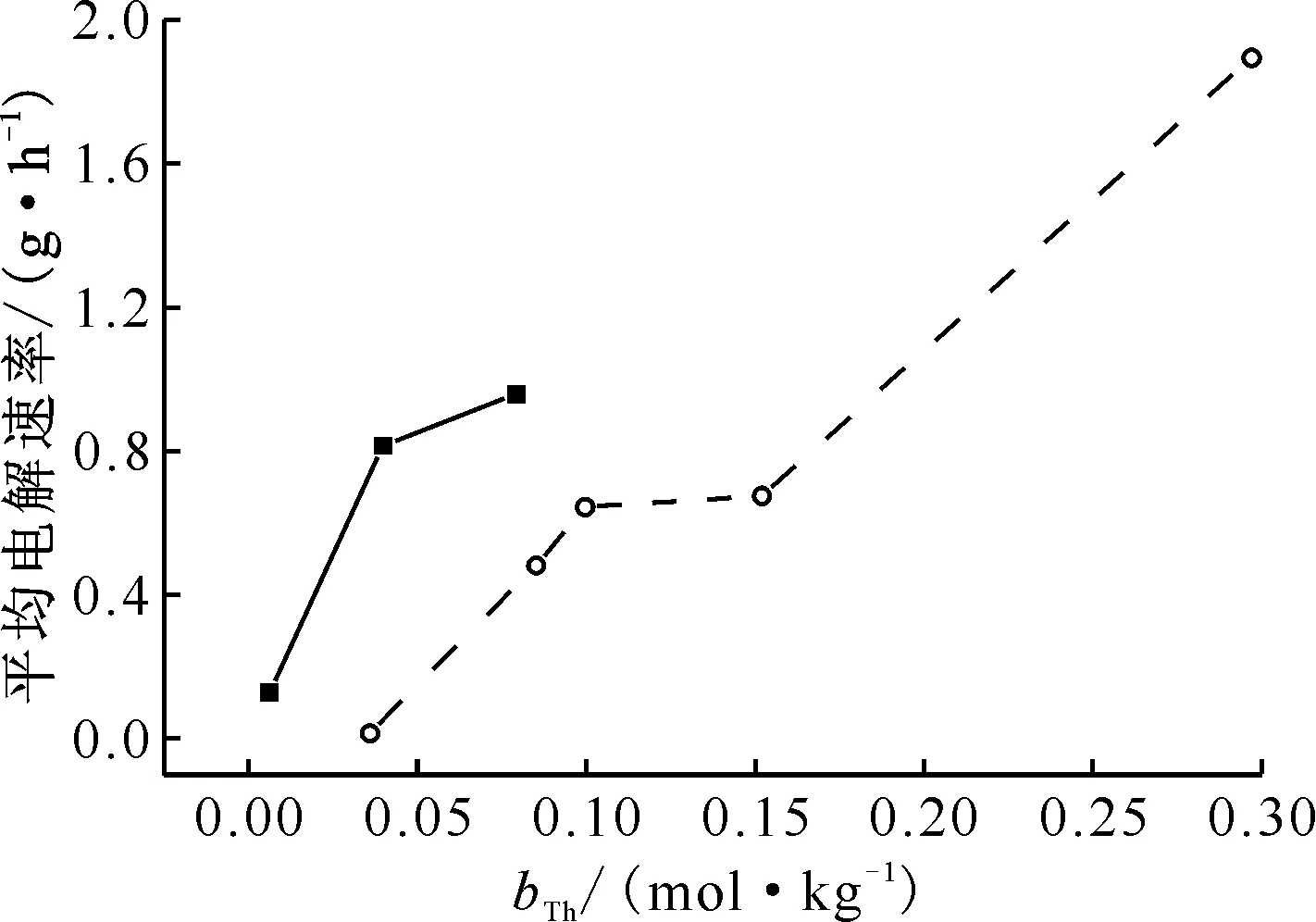
■——3%ThF4,○——10%ThF4图5 CeF3-ThF4-LiCl-KCl熔盐在脉冲电位电解过程中平均电解速率随熔盐Th浓度的变化曲线Fig.5 Average electrolytic rate from CeF3-ThF4-LiCl-KCl molten salt depending on molality of thorium during pulse potential electrolysis
3 结 论
使用循环伏安法研究了773 K下Th(Ⅳ)在不同ThF4含量的CeF3-ThF4-LiCl-KCl熔盐体系中的电化学行为。在ThF4质量分数为3%的CeF3-ThF4-LiCl-KCl四元熔盐体系中,Th(Ⅳ)的初始还原电位为-1.75 V;ThF4质量分数增加为10%时,Th(Ⅳ)的初始还原电位略微正移(从-1.75 V正移至-1.72 V)。Th(Ⅳ)的还原电位变化与氯盐中Th(Ⅳ)和F-浓度的增加有关。Th(Ⅳ)浓度的增大导致其初始还原电位正移,而F-浓度的增大则会促进F-与Th(Ⅳ)形成大团簇络合物,这种大团簇络合物的形成会造成自由Th(Ⅳ)的浓度减少,导致Th(Ⅳ)的初始还原电位负移。这两方面的综合作用最终使得Th(Ⅳ)初始还原电位略微正移。
采用脉冲电位电解法对不同ThF4浓度的CeF3-ThF4-LiCl-KCl熔盐体系开展了详细的Th电解研究,发现10%ThF4体系的初始电解速率和阴极Th沉积量明显高于3%ThF4体系,表明氯盐中Th(Ⅳ)浓度是影响钍电解速率的重要因素:Th含量越高,电解速率越高。随着电解过程中Th(Ⅳ)含量逐步降低,当两个熔盐体系中Th含量相近时,10%ThF4的体系中钍的平均电解速率明显小于3%的ThF4体系,这表明氯盐中的F-浓度也是影响Th的电解效率的因素之一:在Th(Ⅳ)含量相同的情况下,F-浓度越大,电解效率越低。电解结果表明,0.3%CeF3-10%ThF4-LiCl-KCl四元熔盐中Th的分离率可达99.7%,而Ce几乎无析出。
综上,氯盐中Th(Ⅳ)和F-的浓度均是Th电解速率的影响因素,且两者作用的效果相反。这对于氟化物乏燃料的电化学处理工艺设计具有很好的指导意义:若在LiCl-KCl熔盐中电解分离Th和稀土裂变产物的氟化物,为最大化分离效果、节约能源,应在处理过程中持续加料以保证熔盐中较高的Th(Ⅳ)浓度;同时,在熔盐中F-的累计浓度增加后,需定期对其进行处理去除,以提高Th电解分离的效率。
