端粒相关蛋白PinX1和磷酸化激酶Aurora A的相互作用
2021-03-02李梦亚张好好王树娟刘延方姜中兴
李梦亚,王 冲,张好好,王树娟,刘延方,姜中兴
1)郑州大学第一附属医院血液科 郑州 450052 2) 郑州大学第一附属医院内分泌及代谢病科 郑州 450052
端粒是一种位于真核细胞染色体末端由重复DNA序列和相关结合蛋白共同组成的特殊复合体,在维持末端染色体结构稳定以及防止染色体末端融合方面发挥重要作用[1]。端粒相关蛋白通过直接或间接与端粒DNA相互作用来维持端粒结构和功能的稳定[2]。PinX1是2001年鉴定出的一个新的端粒结合蛋白,是目前为止发现的最强力的端粒酶活性抑制蛋白[3]。本课题组前期研究[4]发现:除了端粒定位以及端粒酶抑制作用外,PinX1与多种细胞有丝分裂期重要调控蛋白也存在相互作用;抑制PinX1蛋白表达可直接导致细胞有丝分裂严重阻滞。但是PinX1调控细胞有丝分裂期的具体机制目前仍不清楚。本研究采用酵母双杂交、免疫共沉淀、体外沉降及免疫荧光染色实验方法,初步研究PinX1与有丝分裂期重要的极光激酶(Aurora Rinasa A,Aurora A)的相互作用,旨在进一步探讨PinX1参与细胞有丝分裂期调控的具体机制。
1 材料与方法
1.1细胞和主要试剂人宫颈癌HeLa细胞株来自本课题组;胎牛血清和DMEM培养基购自Invitrogen公司;胰蛋白酶购自华美(SABC)公司。含有GST标记的PinX1原核表达质粒、含有GST标记的Aurora A原核表达质粒、pGBKT酵母表达载体质粒、pGBKT-P53酵母表达质粒来自本课题组。鼠抗Aurora A单克隆抗体购自Invitrogen公司;鼠抗PinX1单克隆抗体购自Abnova公司;FITC标记的羊抗鼠IgG抗体、Aurora A特异性小分子抑制剂VX680购自Sigma公司。鼠抗GFP单克隆抗体和鼠抗磷酸化丝氨酸单克隆抗体购自Abcam公司;限制性内切酶EcoRⅠ、SalⅠ、T4 DNA连接酶及相关缓冲液购自TaKaRa公司;Lipofectamine 2000购自Invitrogen公司;AH109酵母菌种及BL21大肠杆菌菌种由郑州大学血液病研究所提供;人HeLa细胞cDNA文库、MatchmakerTMGAL4 Two-HybridSystem 3试剂盒购自Clontech公司;GST蛋白纯化树脂购自Qiagen公司。
1.2PinX1酵母诱饵蛋白表达载体的构建及鉴定以含有PinX1全长的pEGFP-C2-PinX1真核表达质粒为模板,通过PCR扩增PinX1基因全长片段,亚克隆进入酵母表达载体pGBKT7,小量抽提质粒后,经EcoRⅠ和SalⅠ酶切鉴定、测序。将pGBKT7-P53阳性对照质粒和pGBKT7-PinX1质粒分别转化AH109感受态酵母菌,并接种于SD/-Leu培养板,Western blot检测PinX1蛋白表达。
1.3酵母双杂交实验按Clontech公司酵母双杂交操作手册进行,以构建成功的pGBKT7-PinX1质粒筛选人HeLa细胞cDNA文库,将大约1×108个克隆中的100个大的白色菌克隆种于SDP/-Trp/-Leu/-His/-Ade/X-α-gal培养板,培养72 h后,对所得阳性菌克隆提取质粒并进行PCR 反应(上游引物:5’-TAGTCGACATGGACCCGGCCGAGGCGGTGCTGC-3’;下游引物:5’ -GCGGGATCCAACTCCTTTG CTTGTTTCACTTCGGC -3’;反应条件:94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35个循环),所得PCR 产物大小一致的质粒行酶切排除重复质粒后,通过测序进一步鉴定,并与GenBank数据库进行同源性比较。
1.4免疫共沉淀实验免疫共沉淀实验步骤参见文献[5]。收集HeLa细胞,加入RIPA缓冲液进行裂解;将细胞裂解液与正常小鼠血清及蛋白A和蛋白G琼脂凝胶珠共孵育后,加入1 μg相关抗体,旋转摇床上4 ℃过夜孵育以捕获目的蛋白。免疫沉淀复合物经SDS-PAGE凝胶电泳分离后,以鼠抗PinX1和鼠抗Aurora A单克隆抗体(均按照1∶2 000稀释)行Western blot检测。
1.5GST融合蛋白纯化及体外沉降实验GST-Aurora A融合蛋白纯化按照GST蛋白纯化树脂说明书进行操作;将构建好的GST融合蛋白重组质粒转化大肠杆菌BL21菌株,接种于200 mL含抗生素的LB液体培养基中,37 ℃培养过夜, 在菌液中加入IPTG至终浓度为1 mmol/L,诱导蛋白表达后,于30 ℃、250 r/min振摇约3 h,采用压力破碎仪破碎菌体,离心后收集上清,以GST蛋白纯化树脂收集GST融合蛋白。蛋白质体外沉降实验步骤参见文献[5]。HeLa细胞裂解液经RIPA缓冲液预清除后,首先取20 μL裂解液作为内参对照,再分别与GST对照蛋白和GST-Aurora A融合蛋白共同孵育捕获目的蛋白,将体外沉降蛋白复合物经SDS-PAGE凝胶电泳分离后,以鼠抗PinX1抗体(按照1∶2 000稀释)和鼠抗GST单克隆抗体(按照1∶5 000稀释)进行Western blot检测,再以HRP偶联羊抗鼠IgG(按照1∶10 000稀释)孵育后,用ECL发光底物压片显影。
1.6免疫荧光染色实验免疫荧光染色实验具体操作步骤见文献[5]。Hela细胞培养24 h后,以甲醛溶液固定细胞,TBST缓冲液(50 mmol/L Tris-HCl, 50 mmol/L NaCl, 体积分数0.05% Tween-20)室温下封闭30 min,分别以一抗(鼠抗Aurora A和PinX单克隆抗体)及二抗(FITC标记的羊抗鼠IgG抗体)室温下孵育1 h,TBST缓冲液清洗后,以DAPI染色,滴加抗淬灭剂并封片。以Zeiss Axiovert 200荧光倒置显微镜进行免疫荧光观察。
1.7体内磷酸化实验将Flag-PinX1真核表达质粒转染HeLa细胞,以100 nmol/L Nocodazole处理18 h,分别加入DMSO、VX680处理8 h,随后收集HeLa细胞,加入RIPA缓冲液进行裂解;将anti-Flag M2琼脂凝胶珠加入细胞裂解液后,旋转摇床上4 ℃旋转过夜以捕获目的蛋白。所得免疫沉淀复合物经SDS-PAGE凝胶电泳分离后,以鼠抗Flag单克隆抗体(按照1∶5 000稀释)和鼠抗磷酸化丝氨酸单克隆抗体(按照1∶1 000稀释)行Western blot检测,再以HRP偶联羊抗鼠IgG(按照1∶10 000稀释)孵育后,用ECL发光底物压片显影。
2 结果
2.1PinX1酵母诱饵蛋白表达载体的构建及检测pGBKT7-PinX1酵母表达质粒构建示意图见图1,双酶切后的电泳结果见图2。pGBKT7-PinX1转化AH109酵母菌株生长良好,pGBKT7-PinX1能够在AH109酵母菌株中正确表达(图3)。
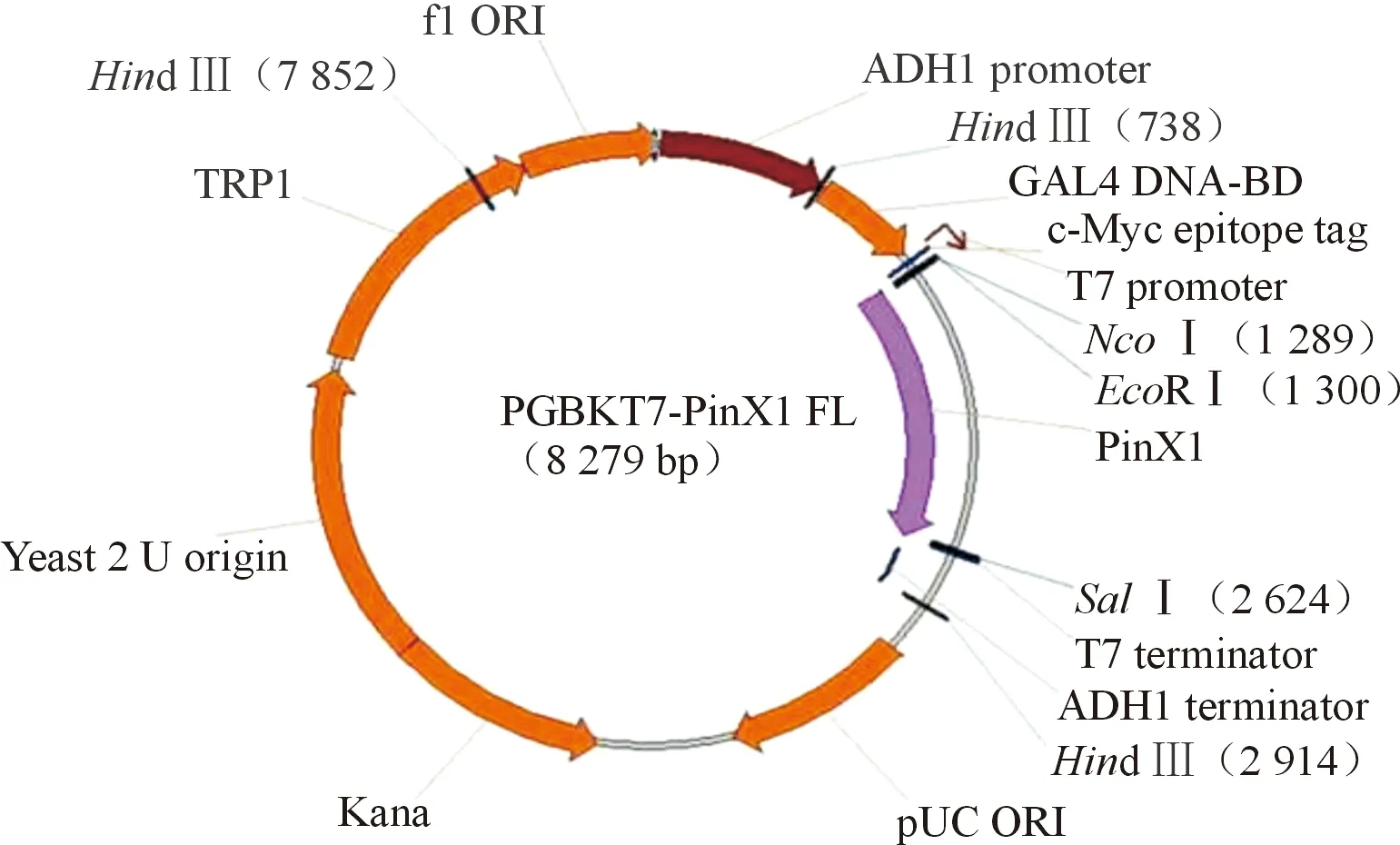
图1 重组质粒pGBKT7-PinX1构建图
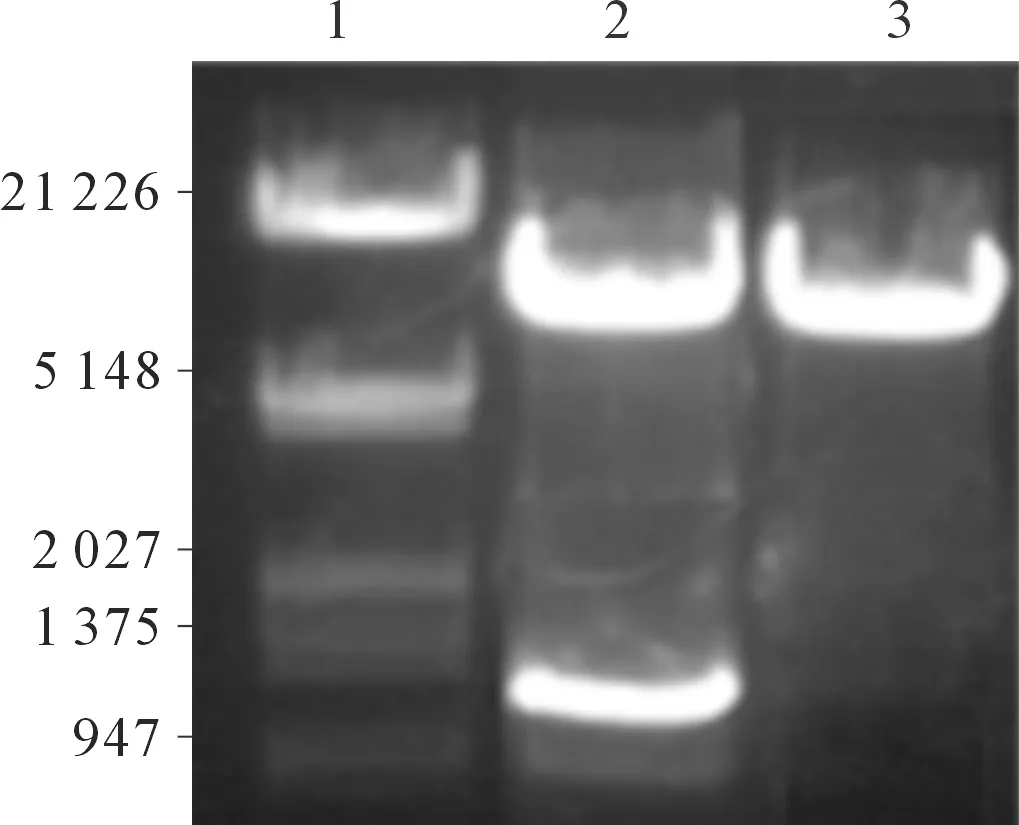
1:DNA Marker;2:双酶切后的pGBKT7-PinX1;3:PGBKT7空白对照载体

1:pGBKT7-P53阳性对照质粒转化菌株裂解液;2:pGBKT7-PinX1质粒转化菌株裂解液
2.2酵母双杂交筛选结果以pGBKT7-PinX1诱饵质粒筛选人HeLa细胞cDNA文库,得到的阳性克隆提取质粒并进行PCR反应后行酶切处理,再行琼脂糖凝胶电泳,排除大小一致的重复质粒后,进一步测序鉴定,最终筛选出3个可能与PinX1相互作用的新蛋白,分别是HSP(Heat Shock Protein)60、Aurora A和着丝粒蛋白-U(CENP-U)。
2.3Aurora A与PinX1的免疫共沉淀实验和体外蛋白沉降实验结果免疫沉淀结果显示:内源性PinX1能够与Aurora A抗体形成复合物,而与空白对照血清未结合(图4),表明PinX1与Aurora A能够在细胞内相互结合。体外蛋白沉降实验显示:GST-Aurora A能够与PinX1相互结合形成复合物,而GST蛋白则无法将PinX1沉淀下来(图5),提示Aurora A能够与PinX1在体外相互结合。
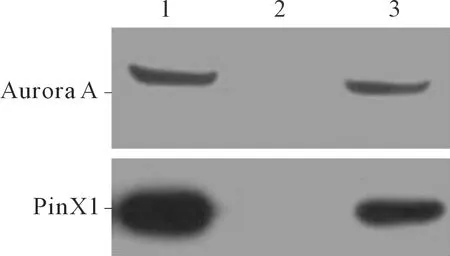
1:样品对照组;2:空白对照组;3:免疫共沉淀组
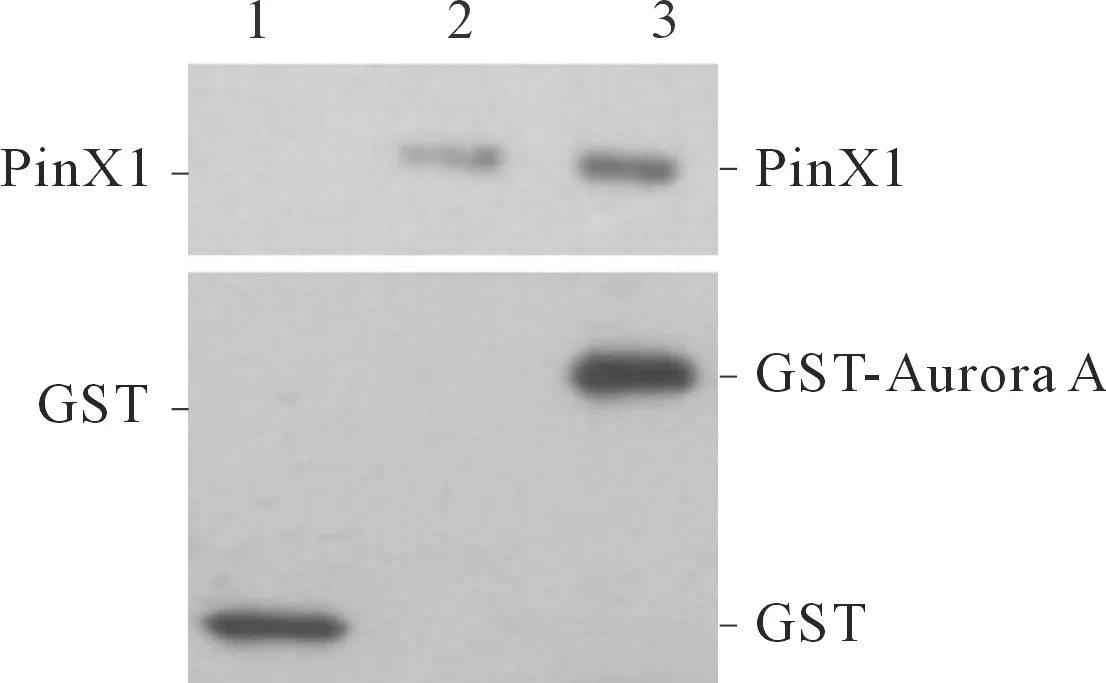
1:GST对照蛋白组;2:内参对照组;3:GST-Aurora A融合蛋白组
2.4免疫荧光染色实验结果见图6。PinX1与Aurora A在HeLa细胞有丝分裂期存在共定位。
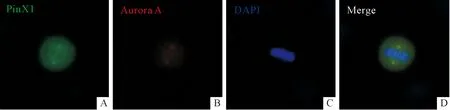
A:内源性PinX1;B:内源性Aurora A;C:DAPI;D:Merge
2.5体内磷酸化实验结果加入Aurora A特异性小分子抑制剂VX680处理后,PinX1磷酸化条带明显减弱,提示PinX1磷酸化水平明显下降(图7),表明Aurora A能够在体内磷酸化修饰PinX1。
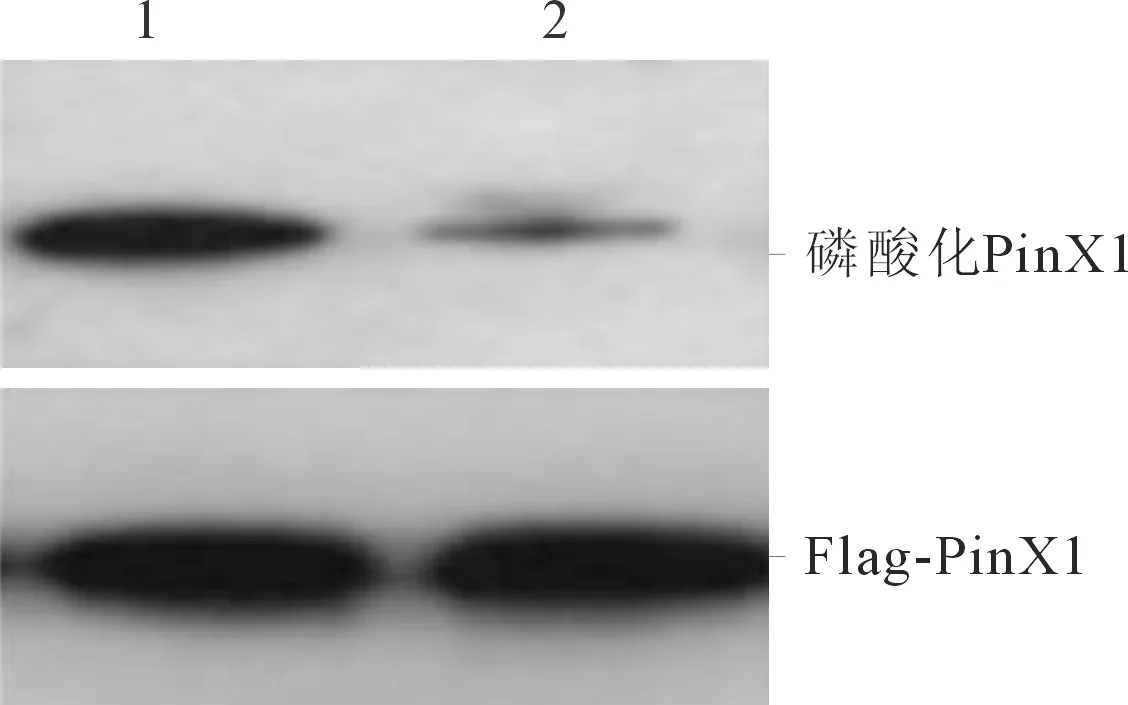
1:DMSO对照组;2:VX680实验组
3 讨论
真核生物细胞通过复杂精确的时空调节确保染色体正确及平均分配到子代细胞,DNA复制和染色体分离过程的异常则会导致染色体不稳定性和非整倍体的形成,从而增加血液系统恶性肿瘤的发生风险[6]。PinX1最初是作为一个新的端粒相关蛋白于2001年被发现,是迄今为止发现的最强力的端粒酶抑制因子,PinX1的端粒酶抑制作用是通过其本身与hTERT和hTR直接作用来实现。本课题组[4,7]在前期研究中发现:PinX1在有丝分裂期能够定位于染色体周边以及动点外层,siRNA敲除PinX1能够导致滞后染色体的出现,表明端粒相关蛋白PinX1在调控细胞有丝分裂进程中可能起到重要作用,但是PinX1参与有丝分裂调控的具体机制及途径目前仍未阐明。
本研究中采用酵母双杂交技术,从人HeLa细胞cDNA文库中筛选出3个新的PinX1相互作用蛋白。本课题组首次发现有丝分裂期重要磷酸化激酶Aurora A能够与PinX1在体内及体外相互作用。Aurora A属于Aurora/Ipl1激酶家族成员,在调节细胞有丝分裂纺锤体组装、中心体分离以及细胞G2/M期转换过程中均发挥极其重要的作用[8]。本研究首次发现端粒相关蛋白PinX1能够与有丝分裂期磷酸化激酶Aurora A发生相互作用,且PinX1与Aurora A在有丝分裂期能够共定位于中心体;进一步研究发现Aurora A能够在体内磷酸化修饰PinX1。以上结果为进一步探讨端粒相关蛋白参与细胞有丝分裂期调控的具体机制以及端粒和细胞周期调节的关联提供了新的研究线索及实验依据。
综上所述,本研究证实Aurora A是一个新的PinX1相互作用蛋白,PinX1与Aurora A在细胞内有共定位;进一步研究发现,Aurora A能够在细胞内磷酸化修饰PinX1。上述结果表明端粒相关蛋白PinX1可能通过与Aurora A的相互作用参与细胞有丝分裂期的具体调控。本项研究有助于进一步探讨恶性肿瘤发生发展的机制,也为开发针对染色体不稳定性的靶向治疗药物提供了新的实验依据。