尼可地尔对大鼠脑梗死后神经元再生的影响
2021-03-03赵源征杨卓滢何远宏孙若楠苑和平
赵源征,杨卓滢,何远宏,孙若楠,苑和平
郑州大学第五附属医院神经内科 郑州 450052
脑卒中是我国最常见的脑血管病之一,分为缺血性卒中和出血性卒中。缺血性卒中即脑梗死最为常见。患者多有感觉、运动功能障碍,认知功能障碍和这些障碍给生活带来极大不便。脑梗死目前的有效治疗仍是超早期的溶栓治疗以及后续的对症药物治疗和康复治疗,条件十分有限且治疗效果欠佳[1-2]。尼可地尔(2-烟酰胺乙基-硝酸盐酯)是一种ATP敏感型钾离子通道(ATP-sensitive potassium channel,KATP)开放剂,同时具有类硝酸酯活性,临床上主要用于心脏疾病的治疗。近来有研究[3-4]发现尼可地尔在血管性痴呆,亨廷顿病等脑部疾病中发挥保护作用。本研究通过建立大鼠脑梗死模型,探讨尼可地尔对神经元再生的作用和机制,为脑梗死的临床药物研究提供相关的理论基础。
1 材料与方法
1.1主要试剂与仪器尼可地尔(北京四环科宝制药有限公司),5-溴脱氧尿嘧啶核苷(BrdU,美国Sigma公司),大鼠用大脑中动脉闭塞(MCAO)线栓(北京西浓科技有限公司),SDS-PAGE凝胶制备试剂盒(北京康为试剂生物科技有限公司),小鼠抗大鼠BrdU(抗体美国CST公司),兔抗大鼠NeuN抗体、驴抗小鼠二抗、山羊抗兔二抗(美国Abcam公司),辣根过氧化物酶标记的山羊抗兔二抗、PCR所用引物的设计(上海生工生物工程有限公司)。冰冻切片机(德国莱卡仪器有限公司),Western blot电泳及转印槽(美国BIO-RAD仪器有限公司),PCR仪(德国Eppendorf有限公司),荧光显微镜(德国ZEISS光学仪器有限公司)。
1.2大鼠MCAO模型[5]的建立及分组处理90只SPF级雄性SD大鼠,体重200~240 g,分为3组:假手术组、脑梗死组和尼可地尔组,每组30只。大鼠经体积分数10%水合氯醛(3.5 mL/kg)腹腔注射麻醉后,取仰卧位固定,颈部备皮、消毒,沿正中线剪开皮肤,小心剥离组织,露出右侧颈内动脉、颈外动脉和颈总动脉,结扎颈外动脉,活结结扎颈总动脉和颈内动脉,在动脉间剪一小口,将线栓小心送入,直至大脑中动脉起始段,长度约为(20.0±2.0)mm,停止线栓送入,1.5 h后拔出线栓尾端约10 mm,假手术组线栓送入大脑中动脉起始段后立马拔出,其余步骤同另外两组。手术期间使用恒温加热垫,使大鼠体温保持在37 ℃左右。Zea-Longa法评分1~3分为造模成功。尼可地尔为粉末状,溶于生理盐水中,术后24 h按7.5 mg/(kg·d)的剂量给尼可地尔组大鼠灌胃,其余组给予同等剂量的生理盐水[6],直至实验前1天。脑梗死组和尼可地尔组自术后24 h开始腹腔注射BrdU,剂量为50 mg/kg,连续注射13 d[7]。
1.3神经功能缺损评分术后第1、3、7、14天,脑梗死组和尼可地尔组每组取10只大鼠。按照Zea-Longa标准[8]对两组大鼠的神经功能进行评分。0分:正常,无神经功能缺损;1分:左侧(瘫痪侧)前爪不能完全伸展,轻度神经功能缺损;2分:行走时大鼠向左侧(瘫痪侧)转圈,中度神经功能缺损;3分:行走时大鼠身体向左侧(瘫痪侧)倾倒,重度神经功能缺损;4分:不能自发行走,有意识丧失。
1.4脑含水量测定术后第3天,各组取6只大鼠麻醉,快速取脑,剥离梗死侧大脑半球,立即称重,以获得湿重。随后在100 ℃的干燥箱内烘干24 h,再次称重,获得干重。脑含水量=(湿重-干重)/湿重×100%[9]。
1.5TUNEL法[10]检测大鼠脑梗死周围区细胞凋亡术后第3天,每组取6只大鼠,用PBS、体积分数4%多聚甲醛灌注心脏,至大鼠全身僵硬,快速取脑,放于体积分数4%多聚甲醛固定后,再置体积分数30%蔗糖中直至沉底。OCT包埋,20 μm厚冰冻切片。取脑片,室温下放置于PBS中漂洗3次(10 min/次),37 ℃湿盒中避光孵育,置于TUNEL混合液中1 h,再次置于PBS中漂洗,滴加DAPI,封片,显微镜(×400)下观察梗死周围区细胞凋亡情况。每张切片选择3个视野,Image J软件计算阳性细胞数,取均值。
1.6脑组织BrdU/NeuN免疫荧光双染检测术后第14天,每组取6只大鼠,快速取脑,制作20 μm厚的冰冻切片。取脑片置于PBS中漂洗3次(5 min/次),37 ℃下置于2 mol/L盐酸溶液15 min,于0.1 mol/l硼酸溶液漂洗3次(10 min/次)[11]。PBS漂洗,PBST溶液处理30 min,体积分数1%BSA封闭30 min。加小鼠抗大鼠BrdU一抗(按照1∶1 000稀释),4 ℃冰箱过夜。PBS漂洗,驴抗小鼠二抗(按照1∶500稀释)室温孵育2 h。PBS漂洗,体积分数1%BSA封闭30 min,再加兔抗大鼠NeuN(按照1∶300稀释),4 ℃冰箱过夜,PBS漂洗,山羊抗兔二抗(按照1∶500稀释)室温孵育2 h,PBS漂洗,滴加DAPI,封片。荧光显微镜下观察染色情况。每个切片选择梗死周围区域的3个不重叠的区域,Image J软件计算阳性细胞数,取均值。
1.7大鼠脑梗死周围区NeuN的mRNA的RT-PCR检测术后第14天,3组各取6只大鼠(来自1.3实验后),深度麻醉后,快速取脑,剥离梗死周围区组织,采用Trizol试剂盒提取总RNA,反转录合成cDNA后,进行PCR扩增反应,引物序列如下:NeuN上游5’-CCCTCCCTCAGCAGACAC-3’,下游5’-TCAGCAGCCGCATAGACTCTACC-3’;GAPDH上游5’-GACATGCCGGGAGAAAC-3’,下游 5’-AGC CCAGGATACCCTTTAGT-3’。反应条件:95 ℃预变性5 min;95 ℃变性30 s, 61 ℃退火30 s, 75 ℃延伸1 min,共35个循环;72 ℃延伸10 min。PCR产物用20 g/L琼脂糖凝胶进行分离。凝胶使用Alpha Innotech成像仪(BIO-RAD)进行分析。以目的基因条带与内参条带灰度值的比值作为目的基因的相对表达水平。实验重复3次。
1.8大鼠脑梗死周围区NeuN蛋白的Western blot检测术后第14天,3组各取6只大鼠(4只来自1.3实验后,2只为另取),麻醉后,快速取脑,剥离出梗死周围区组织,与RIPA裂解液充分混匀,置于匀浆机上充分匀浆后,4 ℃、14 000 r/min离心[12]。吸取上清液,加入5×SDS上样缓冲液煮沸后离心,再次吸取上清液,置-80 ℃冰箱备用。蛋白样品用80 g/L SDS-PAGE凝胶电泳,将蛋白小心转移至PVDF膜上,50 g/L脱脂牛奶封闭1 h,TBST漂洗3次(10 min/次),4 ℃冰箱孵育兔抗大鼠NeuN一抗(按照1∶5 000稀释)过夜,TBST漂洗3次(10 min/次),加入辣根过氧化物酶标记的山羊抗兔二抗(按照1∶2 000稀释)后室温孵育1 h,TBST漂洗后,加入ECL发光液,置于光密度成像系统中观察蛋白条带情况并拍照,以GAPDH作内参。以目的蛋白条带与内参条带灰度值的比值作为目的蛋白的相对表达水平。实验重复3次。
1.9统计学处理采用SPSS 22.0进行数据分析,两组大鼠神经功能缺损评分的比较采用重复测量数据的方差分析;3组大鼠脑含水量,梗死周围区凋亡细胞数、BrdU/NeuN阳性细胞数、NeuN mRNA和蛋白表达的比较采用单因素方差分析和SNK-q检验。检验水准α=0.05。
2 结果
2.1两组大鼠神经功能缺损评分结果见表1。

表1 两组大鼠不同时间点Zea-Longa评分(n=10)
与脑梗死组相比,尼可地尔组在第3、7、14天的评分明显降低。且随着时间的推移,两组脑梗死大鼠神经功能缺损评分均有下降的趋势。
2.23组大鼠脑含水量及梗死周围区凋亡细胞个数比较结果见表2。脑梗死组较假手术组脑含水量明显升高;与脑梗死组相比,尼可地尔组脑含水量明显降低。假手术组仅见到少数凋亡细胞,而脑梗死组凋亡细胞数明显增加,尼可地尔组较脑梗死组凋亡细胞数明显降低。
2.33组大鼠脑组织BrdU/NeuN的免疫荧光双染结果见图1、表2。
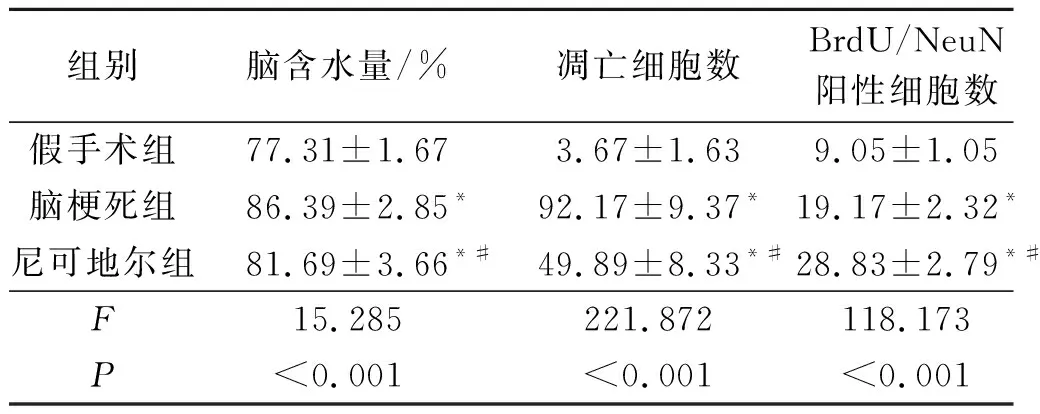
表2 3组大鼠脑含水量及凋亡细胞个数(n=6)

A:假手术组;B:脑梗死组;C:尼可地尔组;1:BrdU(红色);2:NeuN(绿色);3:Merged(橙色)
2.43组大鼠脑梗死周围区NeuN mRNA和蛋白表达的比较结果见表3。假手术组NeuN的mRNA以及蛋白含量较低,脑梗死组NeuN的mRNA以及蛋白含量明显增加;尼可地尔组NeuN的mRNA以及蛋白含进一步升高。

表3 3组大鼠脑梗死周围区NeuN的mRNA和蛋白表达的比较(n=6)
3 讨论
脑梗死为脑部血管狭窄、闭塞或供血不足,使得血管支配区域脑组织缺血坏死,神经功能受到破坏。梗死区中心部分的细胞缺血坏死,难以逆转,梗死中心区周围的区域被称为缺血半暗带,其中的细胞大部分处于休眠状态或半休眠状态,仅能维持自身形态的完整,而无法行使正常功能[13],拯救“缺血半暗带”是临床治疗脑梗死的关键。本研究把重点区域固定在缺血半暗带。
尼可地尔具有激活KATP通道的活性,同时具有类硝酸酯活性[14]。KATP通道是一种ATP敏感型钾通道,开闭受胞内ATP/ADP比值的调节,其活性可被ATP抑制并被ADP激活。脑缺血时,ATP水平降低,KATP通道激活,引起细胞膜超极化,细胞兴奋性降低,因此可以通过负反馈机制来稳定膜电位,调节神经元电活动和能量代谢的平衡[15]。同时,尼可地尔具有的类硝酸酯作用,可以通过释放一氧化氮,起到扩张血管的作用。既往有研究[16]表明,尼可地尔可以通过增加脑血流量起到神经保护作用。
本研究结果表明尼可地尔组第3、7、14天的神经缺损明显减轻,证明尼可地尔改善了脑梗死后的神经功能,促进其恢复。同时,脑含水量反映脑水肿的程度,脑水肿的程度可以反映脑部的炎症情况,以及血脑屏障的通透性被破坏的程度。本研究结果显示术后第3天(脑软化期)尼可地尔组脑水肿明显减轻。尼可地尔可能是通过激活KATP通道,膜电位回到静息态,细胞兴奋性降低,减少了兴奋性递质谷氨酸的释放,抑制了Na+、Ca2+的大量内流,进而减轻了脑水肿[14]。
神经元是构成神经系统结构和功能的基本单位,在神经系统中占有重要地位。本研究用BrdU标记增殖的细胞,用NeuN标记成熟的神经元。BrdU是一种合成的胸腺嘧啶类似物,可替代胸腺嘧啶并在DNA合成的S阶段渗透到复制的DNA分子中。如果靶细胞同时被两种标记物标记,则我们将其视为双阳性细胞,代表新增殖的神经元[17-18]。本研究结果显示术后第14天,尼可地尔组大鼠脑梗死周围区呈现更多的双阳性细胞,表明尼可地尔促进神经发生。这可能和激活KATP通道的活性有关。既往有研究[19]表明,KATP通道开放剂会促进神经再生,具体机制可能是通过减少炎症化合物的形成。本研究结果亦显示尼可地尔的使用可以提高大鼠脑梗死周围区NeuN mRNA和蛋白的含量。同时,我们发现尼可地尔的处理能明显减少凋亡,这可能是由于激活了KATP通道,然后一方面通过维持离子稳态,另一方面通过降低细胞的能量需求,延缓一些有害的分解代谢过程的激活,减少由此带来的酶系统的激活而引起的不可逆的细胞损伤[20-21]。
综上所述,尼可地尔可以通过促进神经功能恢复、减轻脑水肿、减少细胞凋亡、促进神经元再生来达到神经保护,进而为脑梗死的临床治疗提供参考。