卵巢上皮性癌细胞中miR-338-3p过表达对MACC1表达及细胞迁移和侵袭的影响
2021-03-02张瑞涛史惠蓉刘哲颖姬鹏程
张瑞涛,李 松,史惠蓉,冯 巍,刘哲颖,姬鹏程
1)郑州大学第一附属医院妇科 郑州 450052 2)南阳市中心医院妇科 河南南阳 473000
肿瘤细胞的广泛侵袭和转移是导致卵巢上皮性癌患者预后不良和生存期较短的首要原因,但其侵袭和转移的分子机制仍不清楚[1]。越来越多的研究[2-3]显示,微小RNA参与调节大多数恶性肿瘤的侵袭和转移,与恶性肿瘤的上皮-间质转化(epithelial-mesenchymal transition,EMT)、肿瘤微环境、血管生成等侵袭和转移相关过程关系密切。本课题组的前期研究结果[4]显示,微小RNA-338-3p(microRNA-338-3p,miR-338-3p)在卵巢上皮性癌组织中的表达明显低于正常卵巢组织,且与患者的预后不良相关,并利用生物信息数据库检索预测发现MET 转录调节因子(MACC1)可能是miR-338-3p的下游靶基因。MACC1既往称为结肠癌转移相关基因1,与多种人类恶性肿瘤的侵袭和转移关系密切;本课题组前期研究结果[5-6]表明MACC1异常表达与卵巢癌细胞的侵袭和转移相关。目前,有关miR-338-3p与卵巢癌细胞侵袭和转移关系的报道较少,为此,作者进行了以下研究,拟探讨卵巢上皮性癌细胞中过表达miR-338-3p对MACC1表达及细胞迁移和侵袭的影响。
1 材料与方法
1.1材料人上皮性卵巢癌细胞OVCAR-3和OVCAR-8购自中国典型培养物保藏中心(武汉大学保藏中心),RPMI 1640完全培养基购自美国HyClone公司。Trizol为美国Invitrogen公司产品,TaqMan MicroRNA反转录试剂盒购自美国Applied Biosystems公司,SYBR Green PCR试剂盒购自大连TaKaRa公司,pMIR-GLOTM双荧光素miRNA靶向表达载体购自美国Promega公司,Transwell和基质胶购自美国BD公司,miR-338-3p过表达慢病毒载体(pLenti-Ⅲ-miR-338-3p-GFP)和MACC1过表达慢病毒载体(pLenti-GIII-MACC1-CMV)由广州RiboBio公司构建。兔抗人MACC1、Wnt3a、p-LRP6、LRP6多克隆抗体购自美国Cell Signaling公司,鼠抗人GAPDH单克隆抗体、WB及IP蛋白裂解液、增强化学发光试剂盒、Wnt/β-catenin 通路抑制剂IWP-2购自上海碧云天生物科技公司。
1.2miR-338-3p与MACC1靶向关系的预测及双荧光素酶报告实验验证利用在线医学数据库dbDEMC检索miR-338-3p在上皮性卵巢癌组织中的表达,TargetScan Human数据库检索预测miR-338-3p调节的下游靶基因。由广州RiboBio科技公司设计合成可与miR-338-3p结合的野生型MACC1基因3’端非转录区(untranslated region,UTR)序列和突变型序列,并插入pMIR-GLOTM双荧光素miRNA靶向表达载体。分别将1×104个OVCAR-3和OVCAR-8细胞加入96孔板中,设置3孔重复,参照说明书将野生型和突变型MACC1 3’UTR载体分别与miR-338-3p过表达慢病毒载体共转染OVCAR-3和OVCAR-8细胞,孵育48 h后收集细胞,按照双荧光素酶报告实验检测试剂盒说明书操作测定荧光值,以海肾荧光素酶活性为对照。实验重复3次。
1.3细胞培养和转染用含有体积分数10%胎牛血清的RPMI 1640完全培养基在37 ℃、体积分数5%CO2、相对湿度90%的培养箱中培养OVCAR-3、OVCAR-8细胞。将miR-338-3p和MACC1过表达慢病毒载体分别或同时转染OVCAR-3、OVCAR-8细胞,并以阴性对照慢病毒载体转染为对照,经5 mg/L嘌呤霉素筛选72 h后传代培养,至对数生长期收集细胞用于后续实验。
1.4Transwell迁移和侵袭实验各组实验细胞经无血清培养基预处理24 h,将含有3×105个细胞的300 μL无血清培养基分别加入Transwell小室(侵袭实验需提前2 h预铺100 μL基质胶),插入含有700 μL完全培养基的24孔板内,继续培养16 h(迁移实验)或36 h(侵袭实验),取出小室,无水甲醇固定20 min,结晶紫(迁移实验)或苏木精-伊红(侵袭实验)染色15 min,PBS溶液漂洗后擦去小室上层膜表面细胞,倒置显微镜下放大100倍计数3个视野内小室下层膜表面的细胞数。实验重复3次。
1.5各组细胞中miR-338-3p表达的qRT-PCR检测Trizol提取细胞总RNA,参照TaqMan MicroRNA反转录试剂盒说明书反转录合成cDNA模板。RT-PCR所用引物由上海生工生物工程有限公司设计合成,miR-338-3p上游引物5’-AACCGGTCCAG CATCAGTGATT-3’,下游引物5’-CAGTGCAGGGTC CGAGGT-3’(74 bp);U6上游引物5’-CTCGCTTCG GCAGCACA-3’,下游引物5’- AACGCTTCACGAATTTGCGT-3’(70 bp)。参照SYBR Green PCR试剂盒说明进行PCR反应,反应体系20 μL,含cDNA 模板 2 μL、SYBR Premix EX Taq酶Ⅱ 10 μL、上下游引物各0.8 μL、ROX Reference Dye 0.4 μL、核糖核酸游离水6 μL。反应条件:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 60 s,共40 个循环。将U6设为内参照,以2-ΔΔCt法计算miR-338-3p相对表达量。实验重复3次。
1.6各组细胞中MACC1、Wnt3a、p-LRP6、LRP6蛋白表达的Western blot检测提取细胞样本总蛋白,采用考马斯亮蓝法(Bradford法)进行蛋白定量。分别取50 μg总蛋白进行100 g/L SDS-PAGE电泳,恒压20V半干转至PVDF膜,含50 g/L脱脂奶粉、体积分数0.05%吐温20枸橼酸盐缓冲液室温封闭2 h,按说明书浓度分别用一抗(MACC1、Wnt3a、p-LRP6、LRP6)4 ℃孵育过夜,二抗IgG(按1∶2 000稀释)室温孵育2 h。ECL发光试剂盒显色后曝光,Image J软件分析特异性目的条带的灰度值,将GAPDH设为内参照,分别计算其相对表达水平。实验重复3次。将经典Wnt/β-catenin通路抑制剂IWP-2(30 μmol/L)处理24 h的卵巢癌细胞作为阳性对照,进一步观察了miR-338-3p和MACC1过表达对经典Wnt/β-catenin信号通路相关蛋白表达的影响。
1.7统计学处理采用GraphPad Prism 7.0软件分析数据,多组数据比较应用单因素方差分析和(或)非参数检验,两组数据之间采用独立样本t检验或析因设计的方差分析,检验水准α=0.05(双侧)。
2 结果
2.1miR-338-3p与MACC1靶向关系的验证结果利用TargetScan Human在线数据库检索显示,miR-338-3p可与MACC1基因的3’UTR靶向结合,MACC1是其下游靶基因之一,见图1。miR-338-3p过表达载体转染卵巢癌细胞后,qRT-PCR结果显示miR-338-3p表达水平明显升高(P<0.05),Western blot结果显示MACC1蛋白水平明显下降(P<0.05),详见表1、图2和表2。双荧光素酶报告实验显示,共转染miR-338-3p过表达载体和野生型MACC1基因3’UTR载体的卵巢癌细胞相对荧光值明显低于对照组(P<0.05),而共转染突变型MACC1基因3’UTR载体的卵巢癌细胞相对荧光值无明显变化,详见图3和表3。

A:dbDEMC数据库中miR-338-3p在卵巢上皮性癌组织的表达明显低于正常卵巢组织中的表达;B:TargetScan Human在线数据库检索预测MACC1为miR-338-3p潜在的下游靶基因之一
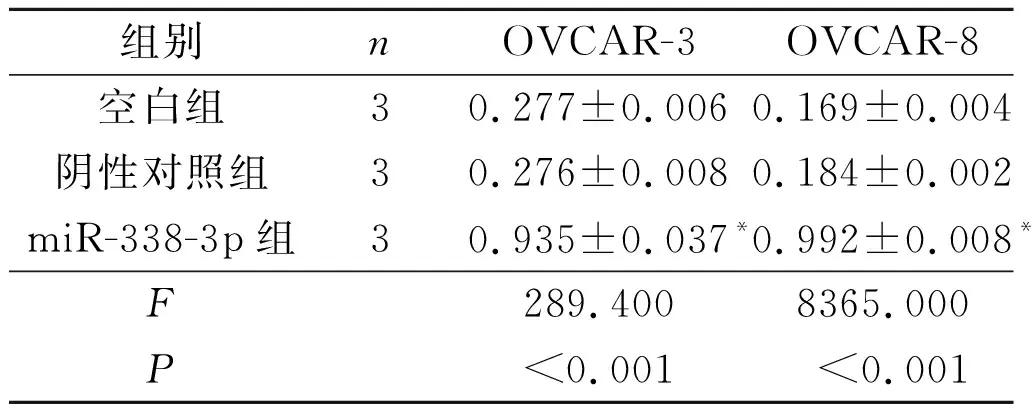
表1 各组卵巢癌细胞中miR-338-3p的表达
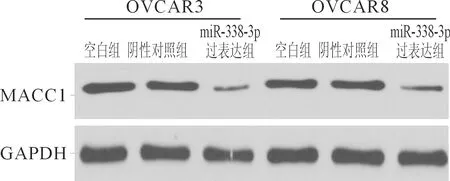
图2 各组卵巢癌细胞中MACC1蛋白的表达
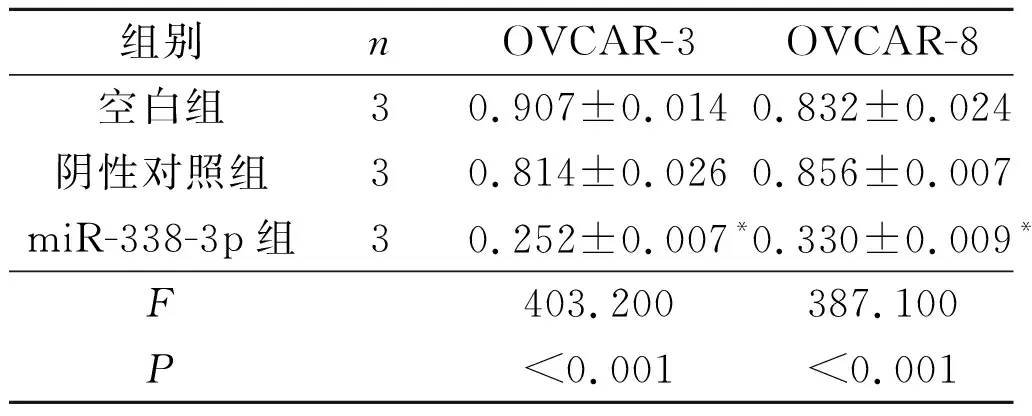
表2 各组卵巢癌细胞中MACC1蛋白的表达

图3 miR-338-3p与野生型及突变型MACC1基因3’UTR结合示意图
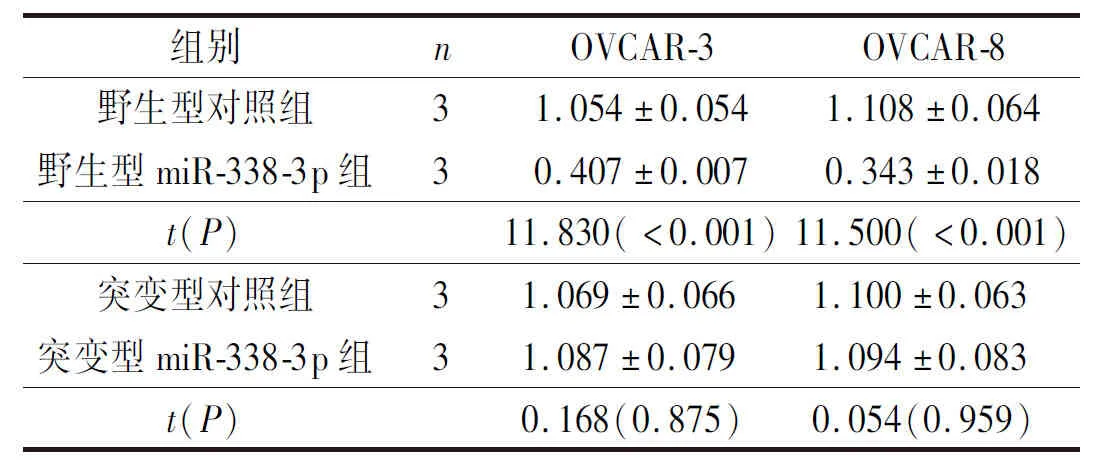
表3 双荧光素酶报告实验验证miR-338-3p与MACC1基因3’UTR结合情况
2.2过表达miR-338-3p和MACC1对卵巢癌细胞迁移和侵袭的影响Transwell实验结果显示,与转染阴性对照载体的卵巢癌细胞相比,转染miR-338-3p过表达载体可明显减少迁移和侵袭细胞的数量,转染MACC1过表达载体可显著增加迁移和侵袭细胞的数量(P<0.05)。与转染MACC1过表达载体细胞相比,共转染miR-338-3p和MACC1过表达载体的卵巢癌细胞迁移和侵袭细胞的数量明显降低(P<0.05)。见图4、表4、表5。
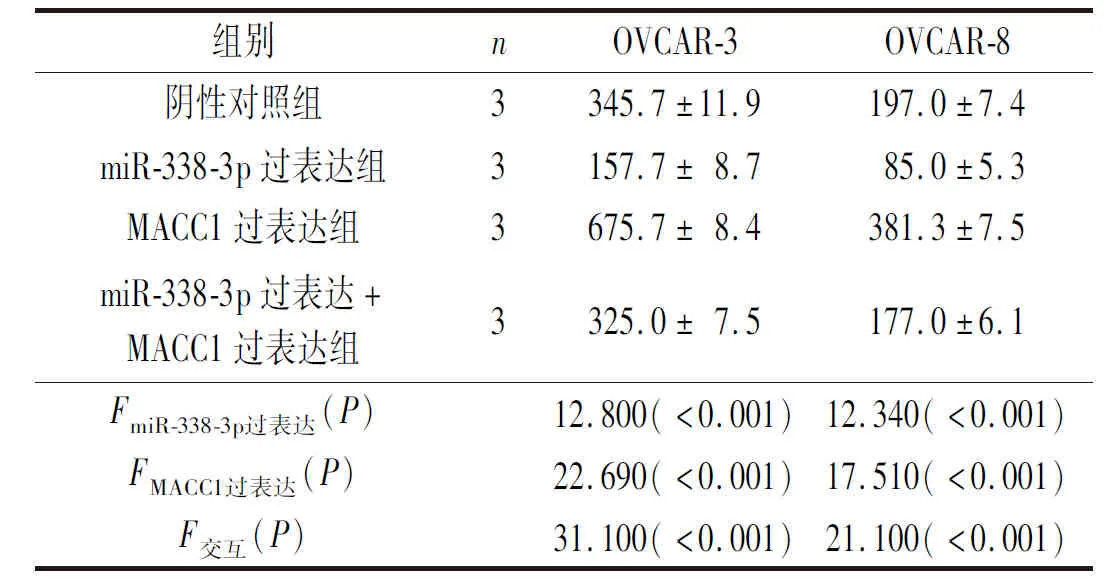
表4 各组卵巢癌细胞迁移数目的变化

表5 各组卵巢癌细胞侵袭数目的变化

上两行图:迁移实验;下两行图:侵袭实验
2.3过表达miR-338-3p和MACC1对Wnt/β-catenin通路相关蛋白表达的影响见图5、表6。Western blot结果显示,与阴性对照组相比,miR-338-3p过表达可抑制Wnt3a和p-LRP6的表达(P<0.05);与转染MACC1过表达的细胞相比,同时转染miR-338-3p和MACC1过表达载体的卵巢癌细胞Wnt3a和p-LRP6的表达明显降低(P<0.05),上述结果提示miR-338-3p可能通过调节MACC1抑制经典Wnt/β-catenin通路的活性。

1:阴性对照组;2:IWP-2组;3:miR-338-3p过表达组;4:MACC1过表达组;5:MACC1过表达+IWP-2组;6:miR-338-3p过表达+MACC1过表达组
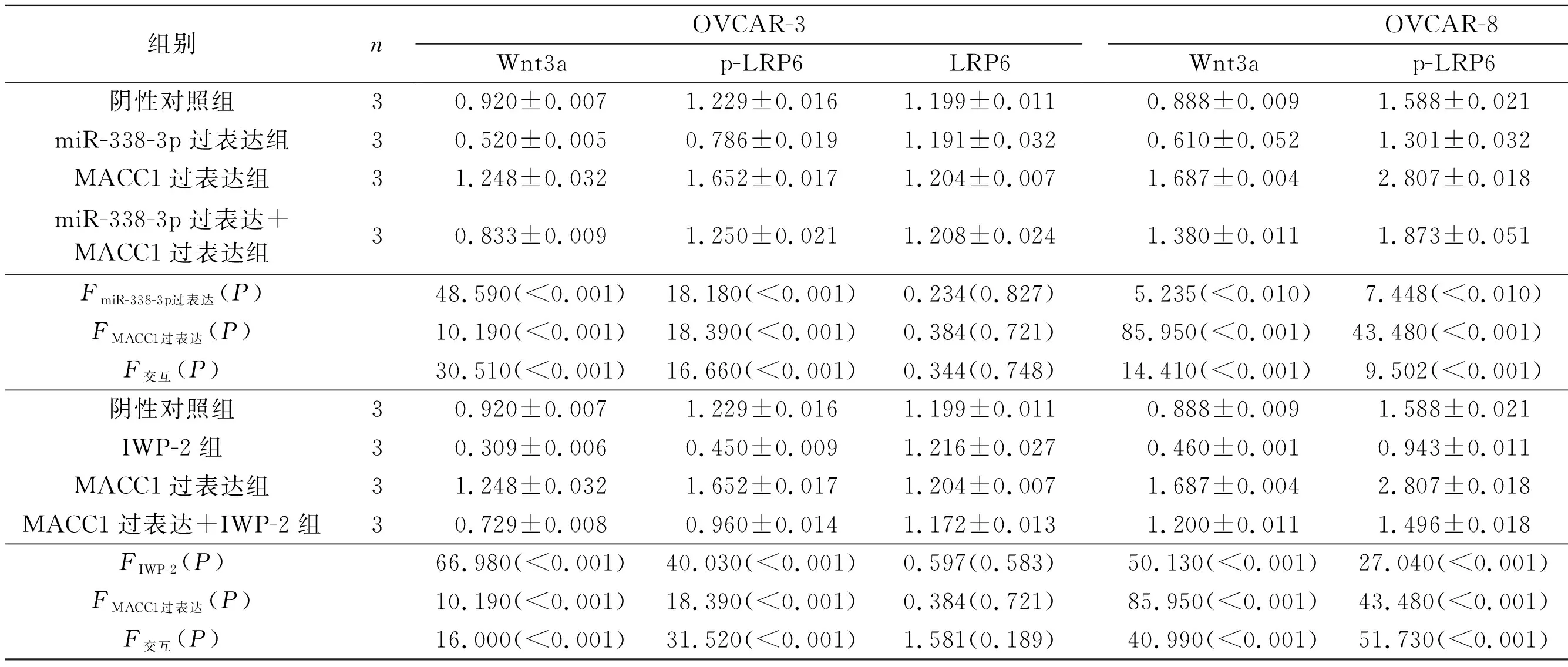
表6 各组卵巢癌细胞中经典Wnt/β-catenin通路相关蛋白表达的变化
3 讨论
侵袭和转移是人类恶性肿瘤细胞重要的生物学特点之一,在多数卵巢癌患者尤其是晚期卵巢癌患者中表现尤为明显[7]。半个世纪以来,关于卵巢癌发生发展的研究取得了长足进步,但其侵袭和转移的分子机制仍需进一步研究。研究[8-13]表明,miR-338-3p在胃癌、肺癌、神经母细胞瘤、肝癌、乳腺癌和食管癌等恶性肿瘤组织中低表达,并与患者预后不良相关;上调上述肿瘤细胞中miR-338-3p的表达可抑制肿瘤细胞的增殖、侵袭和转移。本课题组前期研究[5-6]结果显示卵巢上皮性癌组织中miR-338-3p的表达明显低于正常卵巢组织中的表达,本次研究中经在线数据库dbDEMC检索予以证实,提示miR-338-3p可能在卵巢癌发病过程中扮演抑癌基因的作用。
有研究[14]证实,miRNAs主要通过靶向结合下游靶基因的3’R,抑制基因表达或诱导基因降解,进而参与调节细胞的生理和病理过程。为了探讨miR-338-3p参与卵巢癌细胞侵袭和转移的分子机制,本研究利用在线数据库TargetScan Human检索显示MACC1是miR-338-3p的下游靶基因之一,双荧光素酶报告实验证实在卵巢癌细胞中miR-338-3p可与MACC1基因3’UTR靶向结合,Western blot结果提示在卵巢癌细胞中过表达miR-338-3p后可使MACC1表达降低。上述结果提示在卵巢癌细胞中miR-338-3p可靶向结合MACC1基因的3’UTR,进而调节MACC1的表达,该结果与胃癌、淋巴瘤、结肠癌、黑色素瘤和宫颈癌细胞等研究中的相关报道一致[15-19]。
为了进一步探讨miR-338-3p对MACC1表达及卵巢癌细胞侵袭和转移的关系,本研究分别将阴性对照病毒、miR-338-3p过表达病毒、MACC1过表达病毒及miR-338-3p过表达病毒联合MACC1过表达病毒转染卵巢癌OVCAR-3和OVCAR-8细胞。OVCAR-3和OVCAR-8均为卵巢上皮性癌细胞株,生物学特性均为贴壁生长,均为卵巢癌细胞体内外实验常用细胞株,适合模拟卵巢癌体内外实验病理生理过程。本实验结果显示,过表达MACC1可促进卵巢癌细胞的侵袭和转移,而过表达miR-338-3p可明显抑制阴性对照组和MACC1过表达组卵巢癌细胞的侵袭和转移,提示miR-338-3p可能通过调节MACC1抑制卵巢癌细胞的迁移和侵袭。
经典Wnt/β-catenin信号通路与恶性肿瘤细胞的侵袭和转移关系密切,Wnt3a作为Wnt蛋白的配体是经典Wnt/β-catenin 信号通路的主要因子,而磷酸化激活的LRP6是经典Wnt/β-catenin 信号通路活化所必需的蛋白因子[20-21]。MACC1通过调节MET基因启动子上游约60 bp的sp1位点调节控制肝细胞生长因子受体Met的表达,进而参与调节HGF-Met信号通路和细胞凋亡[22]。激活的Met可直接或间接激活β-catenin,活化的β-catenin进入细胞核后,诱导其他转录因子和下游基因的表达,进而参与恶性细胞增殖和侵袭等多种生物学过程[23-24]。本研究利用Wnt/β-catenin 信号通路抑制剂IWP-2作为阳性对照,Western blot分析显示,发现过表达MACC1可增加卵巢癌细胞中Wnt3a和p-LRP6的表达,而过表达miR-338-3p可明显抑制阴性对照组和MACC1过表达组卵巢癌细胞中MACC1、Wnt3a和p-LRP6的表达,提示在卵巢癌细胞中过表达的miR-338-3p可能通过下调MACC1,从而抑制经典Wnt/β-catenin 通路活性参与卵巢癌的侵袭和转移。
总之,本研究结果显示miR-338-3p可能通过调节MACC1和经典Wnt/β-catenin 信号通路参与卵巢癌细胞的侵袭和转移。本研究探讨的miR-338-3p/MACC1轴在卵巢癌细胞侵袭和转移中的作用,有助于完善卵巢癌侵袭和转移的分子机制,也可为阻断卵巢癌细胞的侵袭和转移提供潜在的靶点。